Warum ist die «Gelegenheitshysterektomie» bei urogynäkologischen Operationen immer noch so weit verbreitet? Die wissenschaftliche Evidenz dazu ist mager. Die einzige Erklärung dazu ist Tradition und Beibehalten des gewohnten Standards. Mit dem Ziel, Antworten auf die Fragen der Notwendigkeit der Hysterektomie bei der laparoskopischen Sakrokolpopexie zu geben, starteten wir im September 2018 eine randomisierte Studie bei Frauen mit Prolaps. Das eine Kollektiv beinhaltet 40 Frauen mit laparoskopischer Sakrokolpopexie und suprazervikaler Hysterektomie, das andere 40 Frauen mit uteruserhaltender Sakro-Hysterokolpopexie (Clinical Trials NCT02345954). Die Frauenklinik des Kantonsspitals Chur unterstützt uns bei dieser Multizenterstudie, welche nach wie vor offen ist. Zugleich beschäftigten wir uns mit dem Thema Auswirkungen der Hysterektomie auf die weibliche Gesundheit und durchforschten die Literatur bezüglich uteruserhaltender Deszensusoperationen. Dieser Beitrag ist ein kurz gefasster Bericht zu diesen Themen.
Noch bis zu den späten Neunzigerjahren wurde eine Deszensus- oder Inkontinenzoperation standardmässig mit einer Hysterektomie kombiniert. Bei Belastungsinkontinenz wurde zuerst eine abdominale Hysterektomie durchgeführt um dann via Cavum Retzii den Blasenhals darzustellen und eine Kolposuspension vorzunehmen. Dies wurde unter der Argumentation gerechtfertigt, dass der Uterus nach unten auf die Blase drücke. Deszensusoperationen wurden meist via den vaginalen Weg durch eine vordere und hintere Raffung des Fasziengewebes vorgenommen und allenfalls noch mit einer sakrospinalen Fixation des Apex vaginalis kombiniert. Die vaginale Hysterektomie war dabei standardmässig der erste Schritt.
Eine Datengrundlage mit Evidenz für die Notwendigkeit der simultanen Hysterektomie gab es nicht. Der «Goldstandard» wurde nicht hinterfragt. In den Achtziger- und Neunzigerjahren des letzten Jahrhunderts kam nach und nach Kritik an unnötigen Hysterektomien auf und unter den Frauen entstand zunehmend das Bedürfnis, die eigene Gebärmutter erhalten zu wollen. Die Operationen wurden nach und nach weniger invasiv. Abdominale, offene Operationen wurden durch die Laparoskopie ersetzt und die vaginalen Kontinenzschlingen Typ TVT setzten sich durch. Damit war es nicht mehr sinnvoll, einen minimal invasiven Eingriff mit einer nicht indizierten Uterusentfernung zu kombinieren. Dies hat sich aber bei den Deszensusoperationen bis heute nicht etabliert. Die laparoskopische Sakrokolpopexie wird mit einer suprazervikalen Hysterektomie kombiniert und die vaginale Deszensusoperation mit einer Hysterektomie. Diese Kombinationen werden nach wie vor international als ein Standard angesehen.
Epidemiologische Studien zur Auswirkung der Hysterektomie
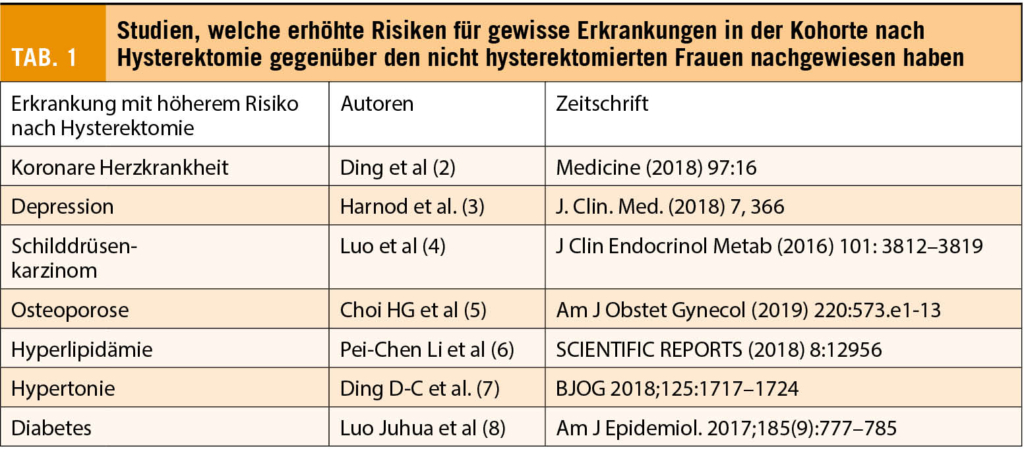
In den letzten drei bis vier Jahren wurde eine ansehnliche Zahl an Studien publiziert welche Kohorten von Frauen nach Hysterektomie mit nicht hysterektomierten Frauen verglichen haben. Solche Studien sind nicht ganz einfach durchzuführen und zu interpretieren da das Thema Ursache und Wirkung nicht immer klar ersichtlich ist. Eine zuverlässige Auswahl der Studienpopulationen muss die Grundlage bilden. Dabei muss darauf geachtet werden, dass in den Vergleichsgruppen ähnliche gesundheitliche Situationen herrschen. Wenn Frauen betreffend koronarer Herzkrankheit analysiert werden, sollte die Kohorte nach Hysterektomie betreffend Risikofaktoren gleich zusammengesetzt sein wie die Kohorte ohne Hysterektomie und idealerweise nur die Hysterektomie den Unterschied ausmachen. Solch ideale Kohorten gibt es im Leben nicht, ausser es seien riesige Kollektive welche die statistischen Unterschiede wieder unbedeutend machen. Dies muss erwähnt sein, wenn Tabelle 1 mit den erhöhten Risiken für die hysterektomierten Frauen studiert wird. Ist wirklich die Hysterektomie die Verursacherin des erhöhten Risikos für eine koronare Herzkrankheit (KHK) oder ist die Kohorte mit Hysterektomie adipöser, womit Blutungsstörungen aber auch die KHK naturgemäss häufiger vorkommen? Aus diesen Daten könnte herausgelesen werden, dass die Hysterektomie nennenswerte Risiken beherbergt. Die Wertigkeit dieser Studien muss also vorsichtig eingeschätzt und beurteilt werden. Statistische Berechnungen und Korrekturen dienen deshalb der Interpretation dieser Daten und können sie valider machen. Dies ist bei einigen dieser Studien tatsächlich durchgeführt worden und die Risiken haben sich nach statistischen Korrekturen bestätigt.
Gibt es Vorteile der Hysterektomie?
Die unmittelbaren Vorteile der Hysterektomie sind evident. Die komplette operative Entfernung des Uterus verhindert die Erkrankungswahrscheinlichkeit für ein Karzinom. Zervix- und Korpuskarzinome sowie Uterussarkome sind nicht mehr möglich. Dieser Vorteil muss den Operations- und den oben dargestellten Gesundheitsrisiken gegenübergestellt werden. Für die Deszensusoperationen kennen wir die Operationsrisiken, die Gesundheitsrisiken der Hysterektomie sind jedoch noch nicht zufriedenstellend geklärt um uns zu helfen, die betroffenen Frauen diesbezüglich zu beraten. Gutman und Maher äusserten sich 2013 wie folgt dazu. «While uterine preservation is a viable option for the surgical management of uterine prolapse, the evidence on safety and efficacy is currently lacking» (1). Auch sieben Jahre später kann diese Aussage unverändert stehen gelassen werden.
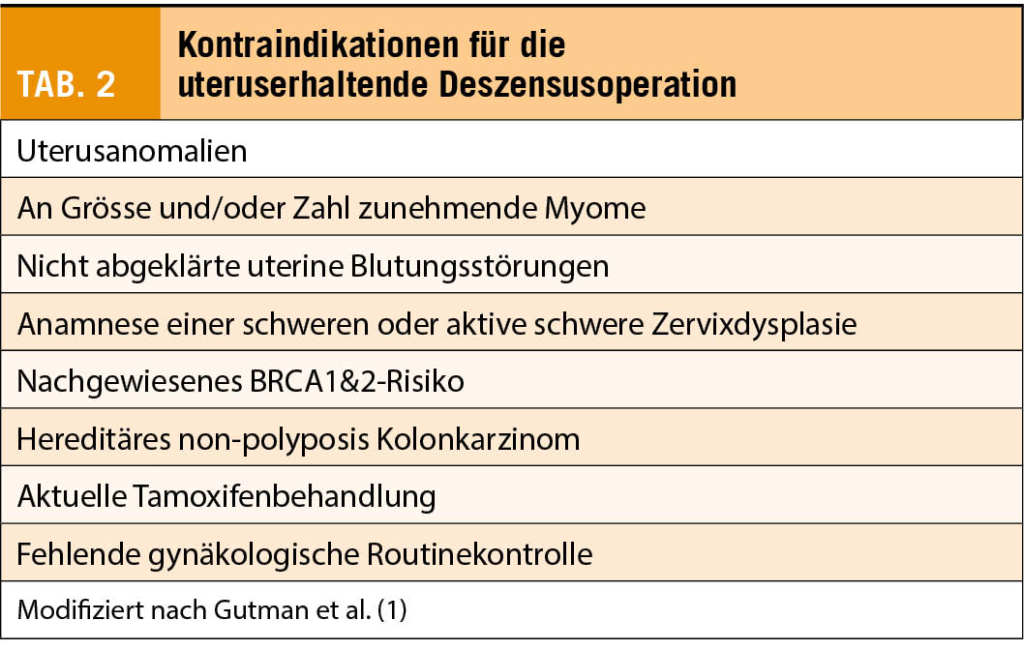
Kontraindikationen für eine uteruserhaltende Deszensusoperation
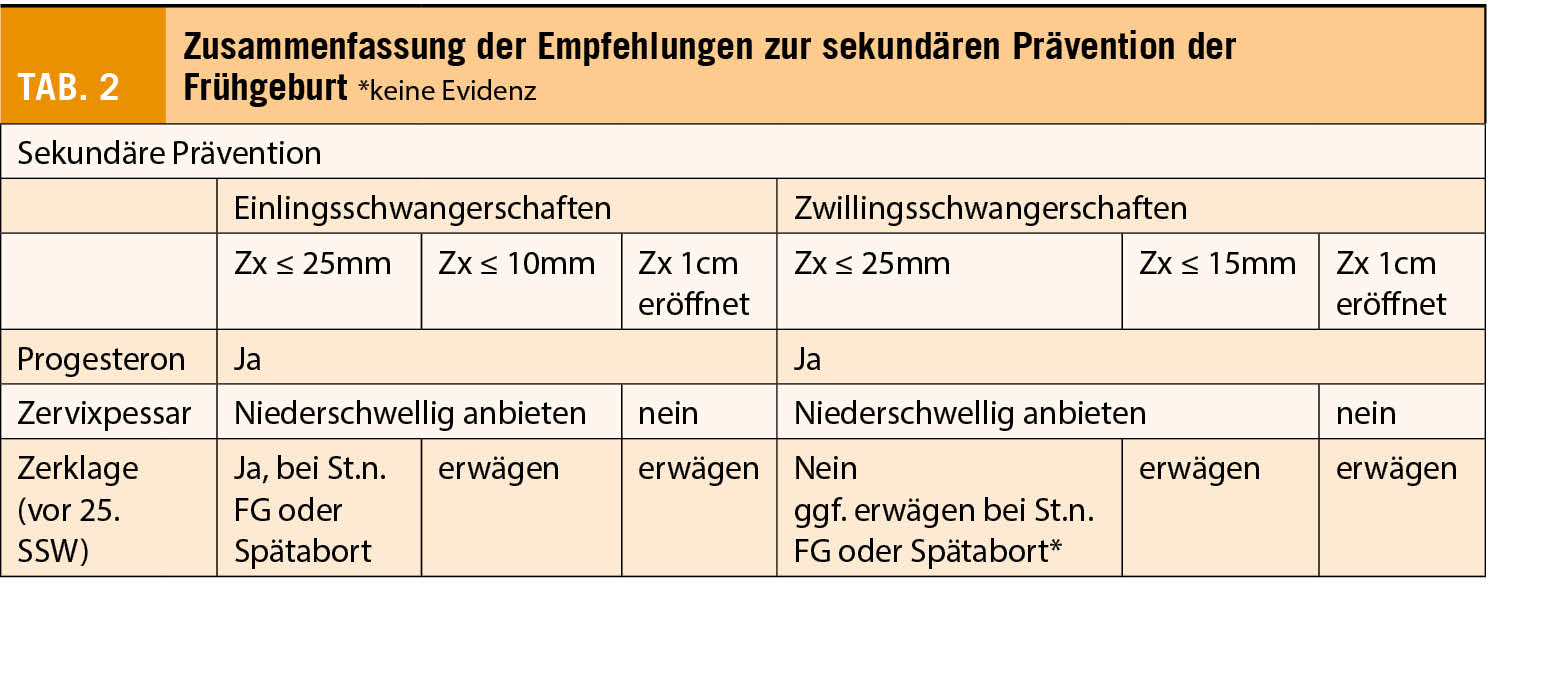
Tabelle 2 zeigt Kontraindikationen für eine uteruserhaltende Deszensusoperation. Sie sind unter logischen Überlegungen zu Zusammenhängen verschiedener Zustände, genetischer Informationen und Einflüssen von Lebensumständen entstanden ohne dass dazu wissenschaftliche Evidenz vorliegt.
Uteruserhaltende Deszensusoperationen bei apikalem Deszensus
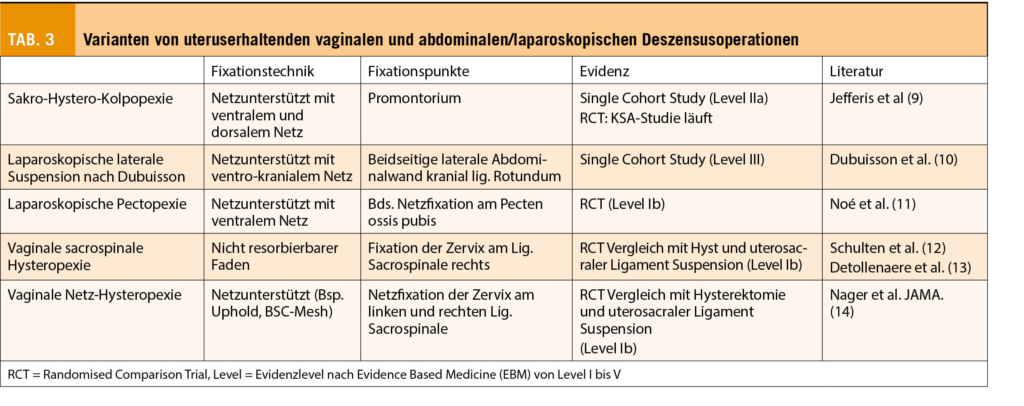
Die Hysterektomie steht vor allem bei Prolapsformen mit apikalem Deszensus des Uterus zur Diskussion. Deshalb werden hier nur diese Techniken diskutiert, nicht aber die Operationen zur Behebung einer ausschliesslichen Zystozele/Rektozele. Es gibt heute mehrere Varianten von uteruserhaltenden vaginalen und abdominalen/laparoskopischen Deszensusoperationen. Tabelle 3 zeigt eine entsprechende Zusammenstellung.
Operationstechnische Details
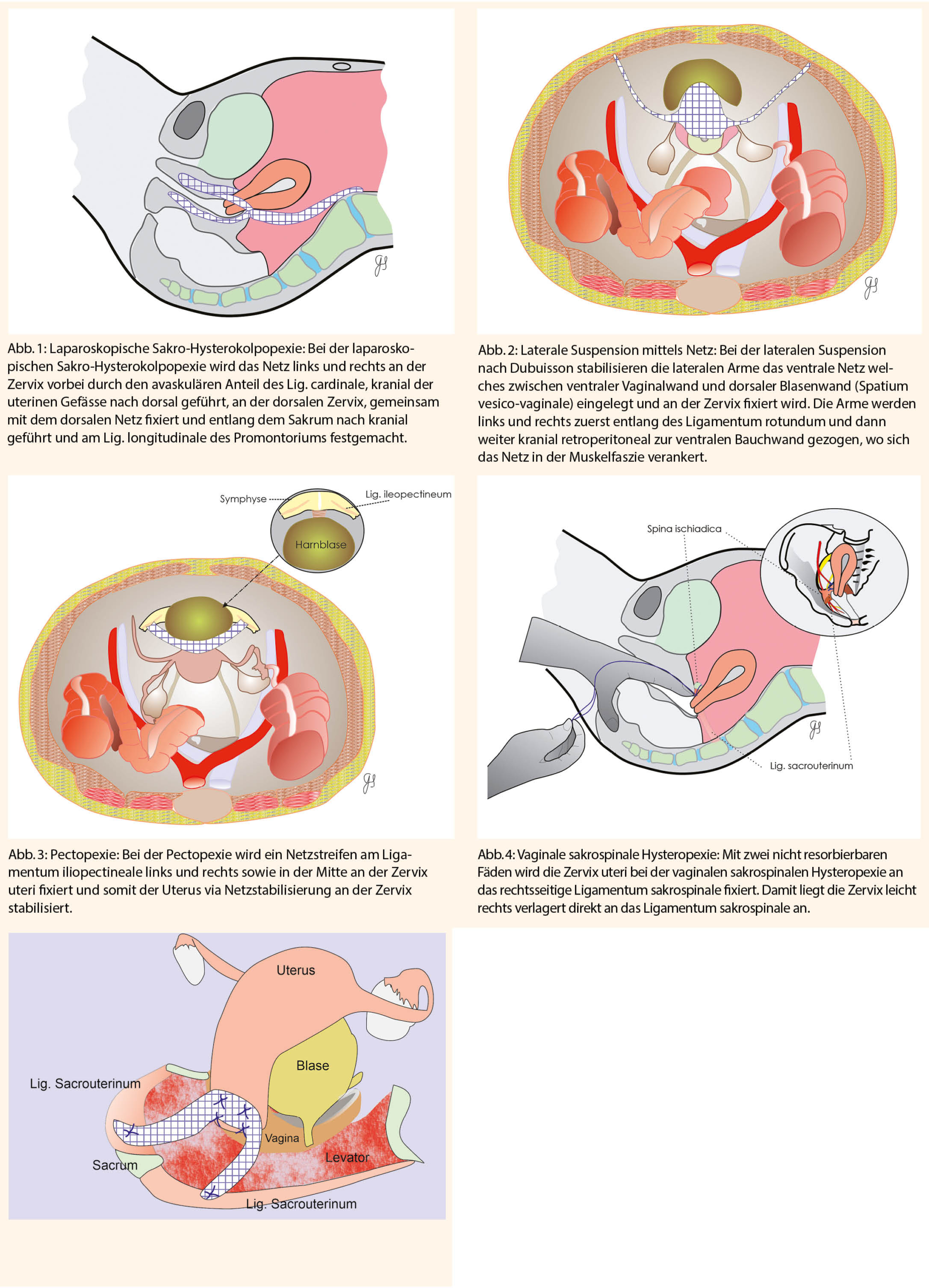
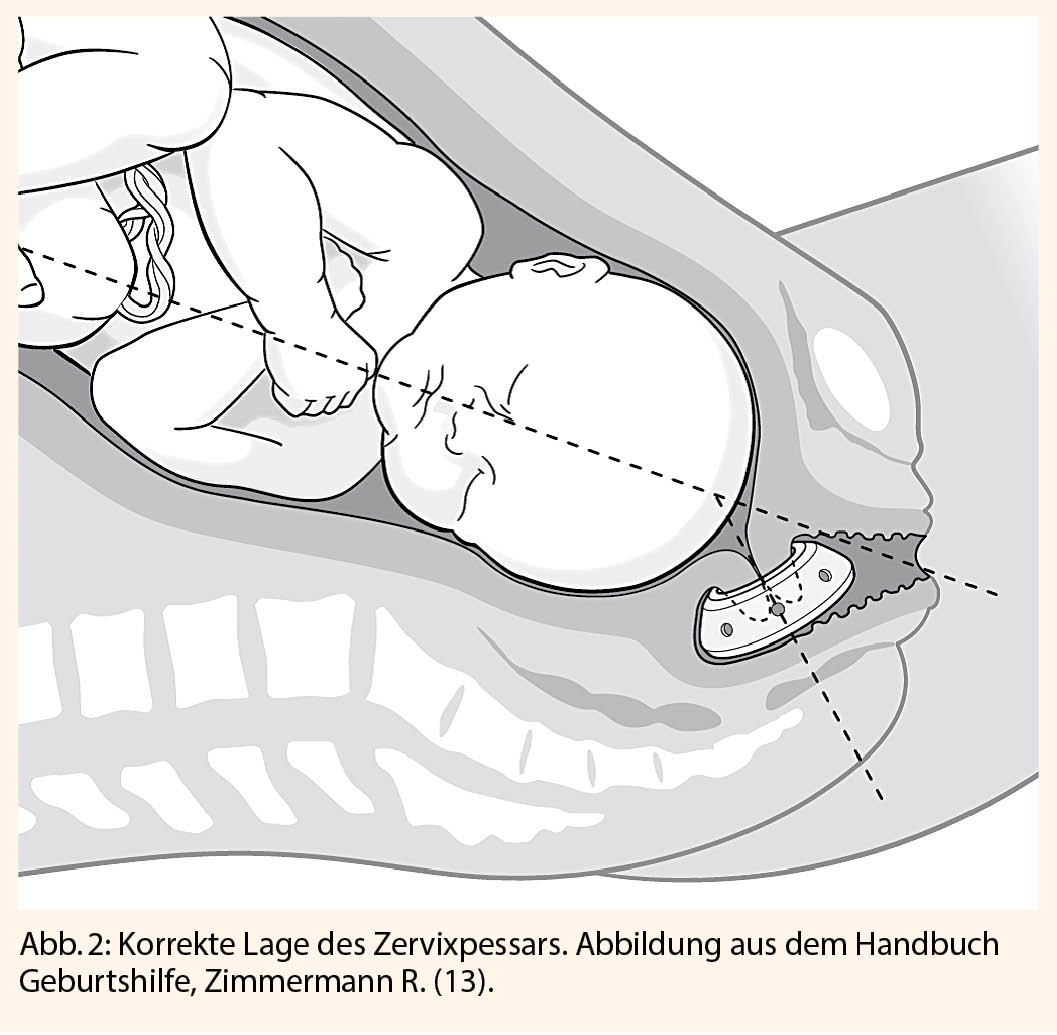
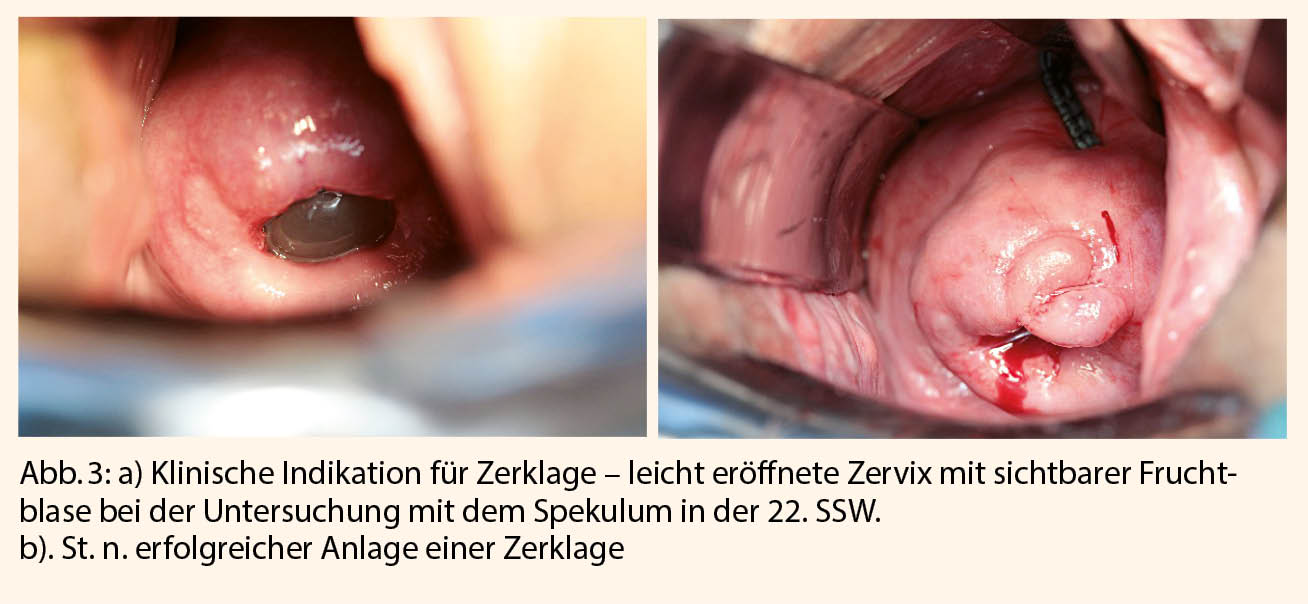
Abbildungen 1-5 zeigen schematisch die Durchführung der oben erwähnten Operationen.
Einschätzung der Wertigkeit der verschiedenen Methoden
Die laparoskopischen, apikalen Fixationstechniken zeichnen sich dadurch aus, dass sie eine geringe Anzahl an Netz-Erosionen verursachen. Dies insbesondere dann, wenn keine totale Hysterektomie durchgeführt wird und somit keine vaginalen Inzisionen vorliegen welche postoperativ eine Dehiszenz aufweisen können. Ein weiterer Vorteil ist die geringe Inzidenz der Dyspareunie. Mangels randomisierter Studien welche die Sakrokolpopexie mit und ohne suprazervikale Hysterektomie vergleichen, muss auf Metaanalysen zurückgegriffen werden. Im Review von Nair et al. (15) zeigte sich, dass bei 770 Patientinnen in 17 Studien eine Heilungsrate der Sakrohysteropexie von 92% besteht mit einer Reoperationsrate zwischen 0 bis 28%. Die vergleichenden Studien zwischen vaginaler und laparoskopischer Fixationstechnik zeigen, dass die apikale Fixation bei allen Techniken vergleichbare Resultate bezüglich kranialer Deszensuskorrektur ergibt. Die Studien weisen aber auch darauf hin, dass die in Tab. 3 aufgelisteten laparoskopischen und vaginalen apikalen Fixationstechniken besser sind als eine vaginale Hysterektomie mit Raffung der Ligamenta sakrouterina, welche auch unter dem Begriff McCall-Nähte bekannt ist (12). Dies wiederum bedeutet, dass die apikale Fixation ein zentraler Vorgang der adäquaten Deszensuskorrektur ist.
In unserer Indikationsstellung bevorzugen wir die laparoskopischen Techniken für Frauen welche sexuell aktiv sind und eine Laparoskopie mit Trendelenburglagerung kein Problem darstellt. Bei älteren Frauen mit apikalem Deszensus führen wir, insbesondere, wenn kardiale oder pulmonale Zusatzrisiken vorliegen, welche eine etwas längere Operationszeit in Trendelenburglagerung riskanter erscheinen lässt, eine vaginale Korrektur mit Hysteropexie am Lig. sacrospinale durch. Zusätzlich kann dabei eine Zysto- oder Rektozele mit Diaphragma- oder Kolpoperineoplastik korrigiert werden.
Die ventralen Fixationstechniken wie Pektopexie oder die laterale Fixation nach Dubuisson sind gute Optionen bei sehr adipösen Frauen, bei welchen wegen Darmüberlagerungen die Fixation am Promontorium erschwert oder unmöglich sein kann oder falls eine Trendelenburglagerung nicht genügend steil gestellt werden kann, weil sie Beatmungsprobleme auslöst.
Fazit
Die uteruserhaltende Korrektur des Deszensus ist ein zunehmendes Bedürfnis der betroffenen Frauen. Die hier vorgestellten laparoskopischen und vaginalen Techniken ermöglichen es, dem Wunsch der Uteruserhaltung gerecht zu werden. Die Datenlage ist sowohl bezüglich Wirksamkeit der Deszensuskorrektur aber auch bezüglich Nebenwirkungen und Spätproblemen wie Karzinomentstehung dürftig. Die Berücksichtigung von Kontraindikationen einer Uteruserhaltung ist dringend zu empfehlen. Es bleibt zu hoffen, dass in nächster Zeit gut durchgeführte randomisierte Studien zitiert werden können, um die betroffenen Frauen präoperativ gut beraten zu können. Mit unserer eigenen Studie wollen wir dazu beitragen.
Copyright bei Aerzteverlag medinfo AG
Aarau
gabriel.schaer@usz.ch
Der Autor hat im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Gutman R, Maher C. Uterine-preserving POP surgery. Int Urogynecol J. 2013;24(11):1803-13.
2. Ding DC, Tsai IJ, Hsu CY, Wang JH, Lin SZ. Hysterectomy is associated with higher risk of coronary artery disease: A nationwide retrospective cohort study in Taiwan. Medicine (Baltimore). 2018;97(16):e0421.
3. Harnod T, Chen W, Wang JH, Lin SZ, Ding DC. Hysterectomies Are Associated with an Increased Risk of Depression: A Population-Based Cohort Study. J Clin Med. 2018;7(10).
4. Luo J, Hendryx M, Manson JE, Liang X, Margolis KL. Hysterectomy, Oophorectomy, and Risk of Thyroid Cancer. J Clin Endocrinol Metab. 2016;101(10):3812-9.
5. Choi HG, Jung YJ, Lee SW. Increased risk of osteoporosis with hysterectomy: A longitudinal follow-up study using a national sample cohort. Am J Obstet Gynecol. 2019;220(6):573 e1- e13.
6. Li PC, Tsai IJ, Hsu CY, Wang JH, Lin SZ, Ding DC, et al. Risk of Hyperlipidemia in Women with Hysterectomy-A Retrospective Cohort Study in Taiwan. Sci Rep. 2018;8(1):12956.
7. Ding DC, Tsai IJ, Hsu CY, Wang JH, Lin SZ, Sung FC. Risk of hypertension after hysterectomy: a population-based study. BJOG. 2018;125(13):1717-24.
8. Luo J, Manson JE, Urrutia RP, Hendryx M, LeBlanc ES, Margolis KL. Risk of Diabetes After Hysterectomy With or Without Oophorectomy in Postmenopausal Women. Am J Epidemiol. 2017;185(9):777-85.
9. Jefferis H, Price N, Jackson S. Laparoscopic hysteropexy: 10 years‘ experience. Int Urogynecol J. 2017;28(8):1241-8.
10. Dubuisson J, Eperon I, Dallenbach P, Dubuisson JB. Laparoscopic repair of vaginal vault prolapse by lateral suspension with mesh. Arch Gynecol Obstet. 2013;287(2):307-12.
11. Noe KG, Spuntrup C, Anapolski M. Laparoscopic pectopexy: a randomised comparative clinical trial of standard laparoscopic sacral colpo-cervicopexy to the new laparoscopic pectopexy. Short-term postoperative results. Arch Gynecol Obstet. 2013;287(2):275-80.
12. Schulten SFM, Detollenaere RJ, Stekelenburg J, IntHout J, Kluivers KB, van Eijndhoven HWF. Sacrospinous hysteropexy versus vaginal hysterectomy with uterosacral ligament suspension in women with uterine prolapse stage 2 or higher: observational follow-up of a multicentre randomised trial. BMJ. 2019;366:l5149.
13. Detollenaere RJ, den Boon J, Stekelenburg J, IntHout J, Vierhout ME, Kluivers KB, et al. Sacrospinous hysteropexy versus vaginal hysterectomy with suspension of the uterosacral ligaments in women with uterine prolapse stage 2 or higher: multicentre randomised non-inferiority trial. BMJ. 2015;351:h3717.
14. Nager CW, Visco AG, Richter HE, Rardin CR, Rogers RG, Harvie HS, et al. Effect of Vaginal Mesh Hysteropexy vs Vaginal Hysterectomy With Uterosacral Ligament Suspension on Treatment Failure in Women With Uterovaginal Prolapse: A Randomized Clinical Trial. JAMA. 2019;322(11):1054-65.
15. Nair R, Nikolopoulos KI, Claydon LS. Clinical outcomes in women undergoing laparoscopic hysteropexy: A systematic review. Eur J Obstet Gynecol Reprod Biol. 2017;208:71-80.