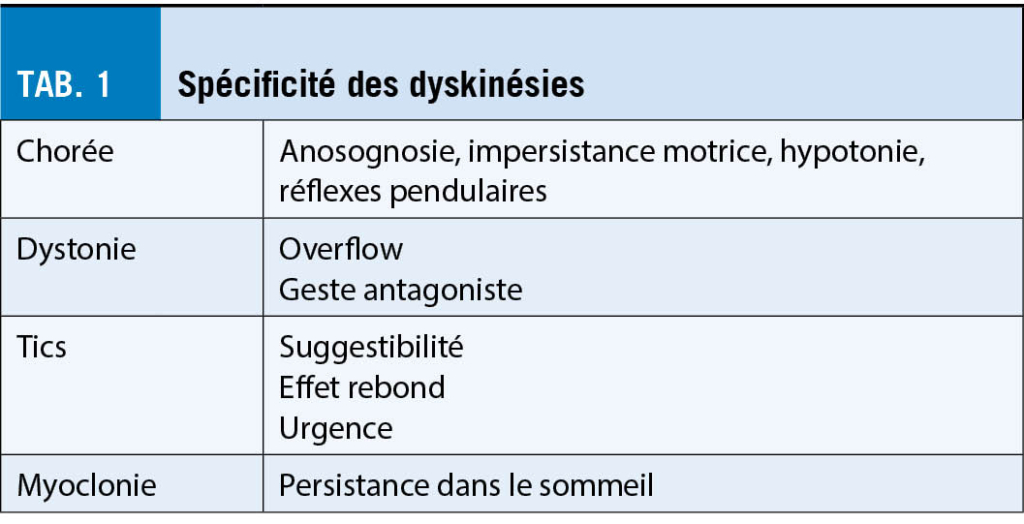
Douze vaccins contre le COVID-19 ont été approuvés dans le monde en mars 2021. Leur utilisation massive permettra de mettre fin à la pandémie. Outre les formats habituels, qui comprennent les virus inactivés (4 vaccins approuvés) et les vaccins à base de protéines (2 vaccins approuvés), deux nouveaux formats ont été validés : adénovirus recombinants (4 vaccins approuvés) et ARN messager (ARNm, 2 vaccins approuvés). Ce dernier fut le plus rapide (approuvé en 2020 dans l’ UE, aux États-Unis et en Suisse). La Suisse a réservé un vaccin protéique, un vaccin adénoviral et trois vaccins à ARNm. Je décris ici les différents formats de vaccins contre le COVID-19, je passe en revue les vaccins réservés par la Suisse et j’ indique pourquoi les vaccins à ARNm sont les plus bénéfiques.
Depuis la démonstration du principe de la vaccination par Jenner (à l’ aide du virus de la variole de la vache « vacca »), les virus atténués (p.ex., le virus de la fièvre jaune) et inactivés (p.ex., le virus de la grippe) sont des vaccins efficaces. Leur production qui nécessite des cellules animales (ou des œufs), peut parfois être difficile (surtout si le virus est lytique), et leur purification à partir de la culture cellulaire ne peut pas être trop poussée, sinon ils seraient détruits. Par conséquent, les vaccins à base de virus entiers contiennent des impuretés issues de la production qui peuvent poser des problèmes en induisant une immunité inutile ainsi que des intolérances/allergies.
Les vaccins sous-unitaires, en revanche, se sont révélés sûrs et efficaces et sont un peu plus faciles à produire, à purifier et à stocker (p.ex., l’ antigène de l’ hépatite B : HBsAg). Cependant, ils doivent être adjuvantés. Plus récemment, des vaccins ont été générés sur la base de virus recombinants. L’ avantage dans ce cas est d’ utiliser les conditions de production et de se baser sur les profils de sécurité et d’ efficacité établis pour les virus atténués modifiés (p.ex., les adénovirus). Ce type de vaccin a été approuvé pour la protection contre Ebola pas plus tard qu’ à l’ été 2020 (Source A).
Enfin, depuis la fin des années 1990, des sociétés (à commencer par celle que j’ai cofondée : CureVac) développent des vaccins basés sur des ARNm synthétiques transcrits in vitro (ARNm ivt) (1-6). Ce format a été négligé car les communautés scientifiques et médicales pensaient à tort que l’ ARNm était une molécule fragile. Or, ceci est incorrect. En raison de l’omniprésence des RNases, des enzymes qui dégradent rapidement l’ ARN, la manipulation de l’ ARNm doit certes s’ effectuer dans des conditions spéciales «sans RNase». Cependant, les molécules d’ ARNm en tant que telles sont très stables sur le plan physico-chimique en l’ absence de RNases. Elles peuvent être congelées, décongelées, lyophilisées et remises en suspension sans perdre leur fonctionnalité (1). En fait, l’ ARNm est la seule molécule biologique qui peut être chauffée jusqu’ à 95 °C sans perdre son activité. D’ autres molécules biologiques telles que l’ ADN ou les protéines (et les virus), perdent leur fonctionnalité lorsqu’ elles sont chauffées à 95°C. Ainsi, de manière contre-intuitive, l’ ARNm est la molécule biologique la plus stable pour la production de vaccins. En revanche, les liposomes, qui sont éventuellement utilisés pour formuler des vaccins à ARNm, peuvent ne pas être stables, c’ est pourquoi les vaccins à ARNm actuels doivent être conservés à basse température. L’ Union européenne a reconnu la grande stabilité de l’ ARNm vaccinal en décernant à CureVac un prix de 2 millions d’ euros en 2014 pour des vaccins pouvant être stockés à température ambiante (Source B).
Néanmoins, le préjugé selon lequel l’ ARNm était instable a persisté dans les communautés scientifiques et médicales et a affecté le développement de médicaments à base d’ ARNm au cours des vingt dernières années. La pandémie de coronavirus en 2020 a constitué un tournant définitif autour de ce préjugé et a permis au vaccin à ARNm de montrer son potentiel (production rapide et facile, sécurité et efficacité), devenant le premier format de vaccin à être approuvé contre le COVID-19, moins d’ un an après la publication de la séquence virale (7). Suite à cette validation remarquablement rapide, un certain nombre de vaccins anti-SRAS-CoV-2 basés sur des adénovirus atténués recombinants, sur des protéines du SRAS-CoV-2 et sur des virus SRAS-CoV-2 inactivés ont également été homologués, de sorte que le monde dispose désormais d’ un panel de 12 outils prophylactiques contre la pandémie (Source C).
Les profils de sécurité et d’ efficacité des vaccins autorisés sont-ils tous similaires ?
En termes de sécurité, tous les vaccins autorisés ont passé les processus de contrôle réglementaire et sont donc considérés comme sûrs (bien que, comme il faut s’ y attendre avec tous les vaccins, les effets secondaires comprennent une fatigue fréquente et des réactions locales, ainsi que rarement des réactions allergiques).
En termes d’ efficacité, tous les vaccins protègent bien contre le COVID-19 (plus de 70 % et jusqu’ à plus de 95 %). Bien que tous les vaccins recombinants actuels ciblent la protéine de surface «Spike» du SRAS-CoV-2, certains utilisent la protéine de type sauvage, tandis que d’ autres utilisent des versions mutantes qui possèdent deux prolines consécutives remplaçant la lysine 986 et la valine 987. Ce style de protéine «PP-Spike» fut inventé et validé pour vacciner contre SRAS-CoV et MERS-CoV. En effet, l’ expérience avec ces coronavirus antérieurs a montré que la protéine Spike est présente à la surface virale dans une conformation de préfusion et change de conformation à l’ entrée dans la cellule infectée (8). La modification de Spike en PP-Spike stabilise cette conformation de préfusion, ce qui engendre une réponse immunitaire protectrice.
Vaccins utilisés ou dont l’ utilisation est prévue en Suisse
Quatre plateformes vaccinales offrent actuellement des vaccins homologués contre le SRAS-CoV-2 :
1. Vaccins basés sur l’ ARNm ivt développés principalement en Europe et aux Etats-Unis par BioNTech/Pfizer, CureVac et Moderna.
2. Vaccins basés sur des adénovirus recombinants déficients, optimisés et produits dans différents pays et par des sociétés telles que AstraZeneca, Johnson & Johnson et CanSino.
3. Vaccins à base de protéines développés principalement aux Etats-Unis et en Russie.
4. Virus SRAS-CoV-2 inactivés développés principalement en Chine et en Inde.
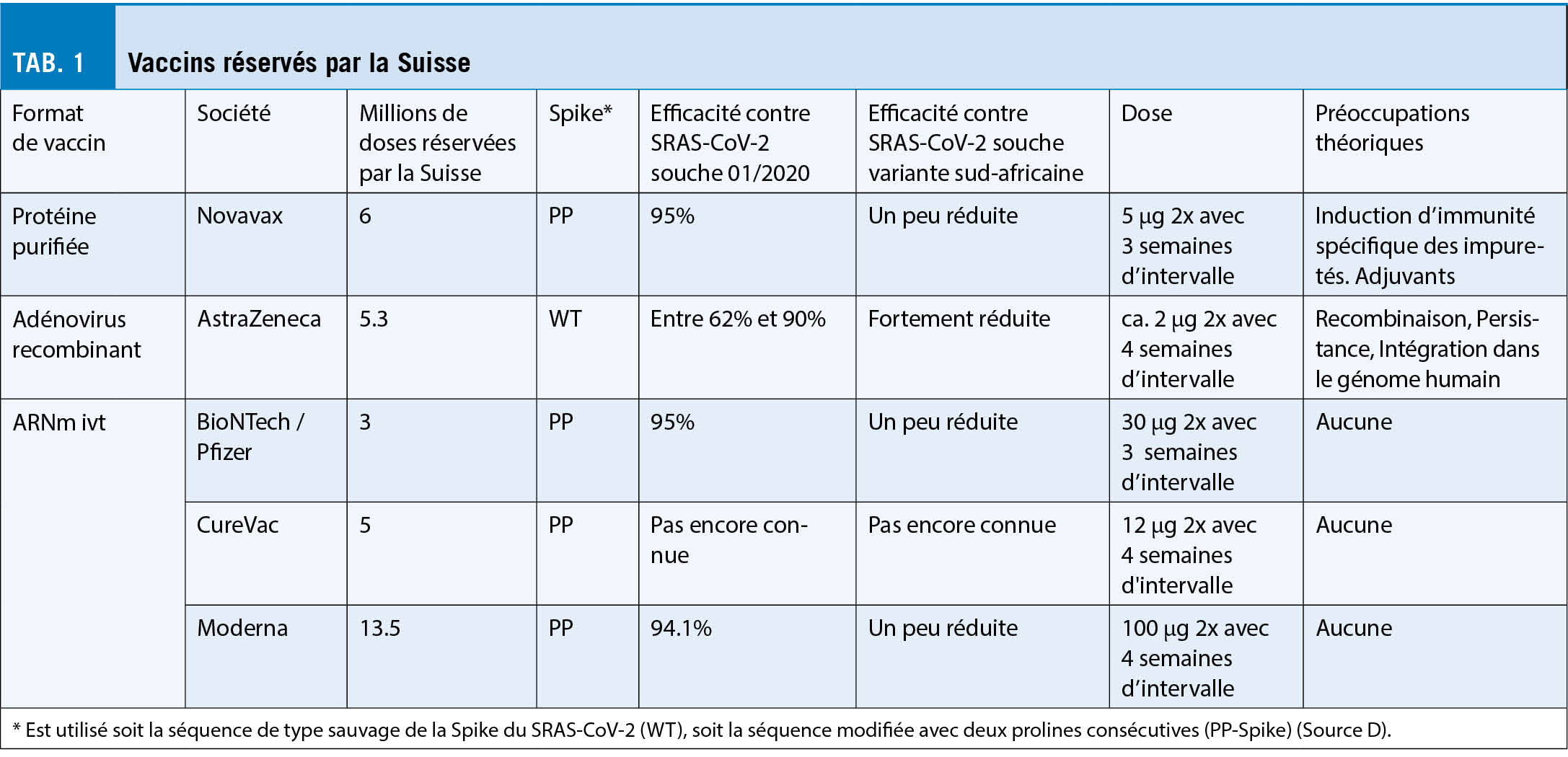
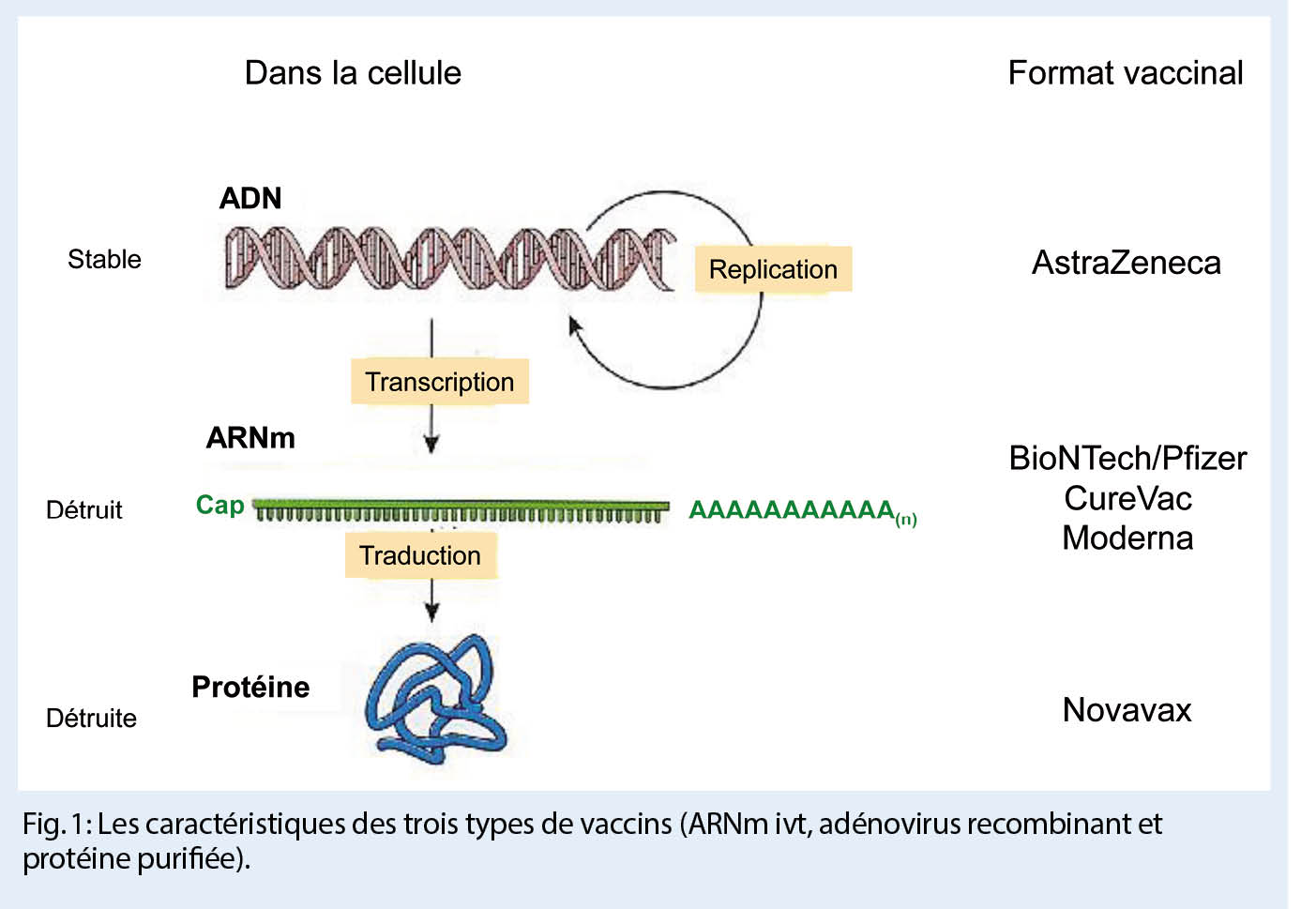
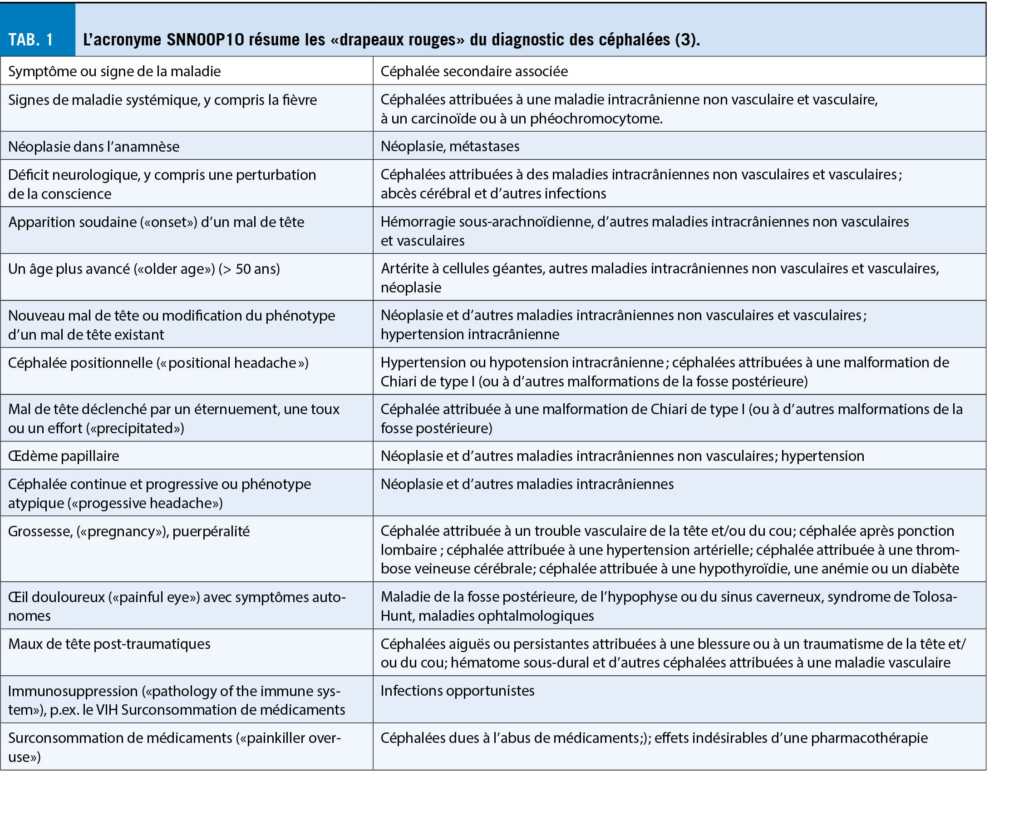
Peu d’ informations sont disponibles sur les virus inactivés du SRAS-CoV-2, et la Suisse n’ a pas réservé ces vaccins. Je présenterai donc ci-dessous les caractéristiques des trois types de vaccins (ARNm ivt, adénovirus recombinant et protéine purifiée, fig. 1) pour lesquels la Suisse a réservé des millions de doses (tab. 1).
Vaccins à base de protéines
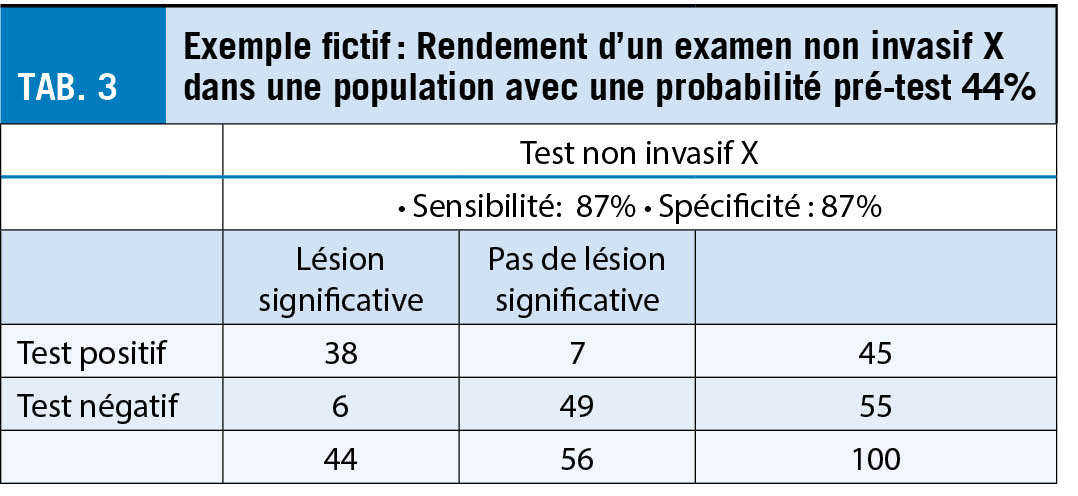
L’ un des avantages des protéines pour un produit pharmaceutique en matière de sécurité est qu’ elles sont inertes et se dégradent naturellement après leur administration. Cependant, si elles ont été produites in vitro dans des cellules, elles contiennent des impuretés provenant des cultures cellulaires. Il faut en tenir compte, en particulier lors de la vaccination de patients allergiques, car une réaction allergique est possible même en présence de très faibles quantités d’ impuretés. En outre, les vaccins à base de protéines nécessitent un adjuvant. La conception et la production d’ une protéine pour un vaccin peuvent être fastidieuses car chaque protéine est différente (hydrophile, hydrophobe, structurée, glycosylée, etc.). Par conséquent, il peut être difficile d’ obtenir et de maintenir les propriétés antigéniques appropriées de la protéine purifiée dans le vaccin. En outre, si le vaccin contient des impuretés immunogéniques (notamment des antigènes mal repliés), il pourrait induire une immunité spécifique non pertinente (reconnaissant les impuretés mais pas le pathogène ciblé). Le vaccin protéique de Novavax, réservé par la Suisse, n’ est pas encore homologué. Il contient la PP-Spike complète (en plus mutée aux positions 682 à 685 pour conférer une résistance aux protéases) produite dans des cellules d’ insecte et mélangée à Matrice-M1, un adjuvant à base de saponine. Il est stocké entre 2°C et 8°C. Les doses testées étaient de 5 et 25 microgrammes de protéine par injection, et il a été constaté qu’elles induisaient des titres élevés similaires d’ anticorps neutralisants dans la phase I (9). L’ étude de phase III a été réalisée avec deux injections de 5 μg de protéine + 50 μg d’ adjuvant Matrice-M1 à 21 jours d’ intervalle. La société a fait état d’ une efficacité de 89,3 % contre le COVID-19 en janvier 2021 (95,6 % contre la souche originale du COVID-19 et 85,6 % contre la souche variante britannique B.1.1.7). Ainsi, le vaccin Novavax semble être un produit efficace et sûr de grand intérêt.
Un autre vaccin protéique, EpiVacCorona, est disponible et a été homologué en Russie. Cependant, peu d’ informations sont disponibles (Source E). Néanmoins, il peut présenter un intérêt car il n’ est pas produit par les cellules mais est synthétisé chimiquement. Les antigènes peptidiques chimiques correspondant à la protéine Spike du SRAS-CoV-2 sont conjugués à une protéine porteuse et adsorbés à l’ hydroxyde d’ aluminium. Ce type de vaccin synthétisé chimiquement ne contiendrait pas d’ impuretés telles que des protéines provenant de la cellule productrice et pourrait donc présenter moins de risques d’ induire des allergies ou une immunité non pertinente.
Vaccins à base d’ adénovirus déficients
Les adénovirus sont des virus non enveloppés qui sont exceptionnellement stables face aux agents chimiques ou physiques. Des adénovirus déficients sont utilisés pour produire des vaccins recombinants. L’ ADN recombinant contenu dans ces virus est activement envoyé par les protéines virales dans le noyau des cellules infectées chez la personne vaccinée, où il peut être transcrit en ARNm. Habituellement, les adénovirus déficients vaccinaux ont le gène précoce E1 supprimé, de sorte qu’ ils peuvent infecter mais pas se répliquer. Leur production in vitro est possible grâce à la complémentation dans des cellules exprimant E1. Les cellules normales de mammifères, en revanche, ne contiennent pas E1, ce qui évite la réplication du virus vaccinal chez les vaccinés.
Le vaccin d’ AstraZeneca est produit dans des cellules HEK293, qui sont des cellules rénales embryonnaires humaines (prélevées sur un fœtus féminin avorté en 1973) qui ont été transformées en intégrant une partie de l’ adénovirus 5, ce qui permet également l’ expression de la protéine E1. Grâce à cette protéine, HEK293 peut produire et sécréter des adenovirus déficients en E1. Le gène codant pour l’ antigène (dans ce cas, la Spike du SRAS-CoV-2) est introduit dans ces virus déficients, ce qui les transforme en virus vaccins recombinants déficients. La production d’ adénovirus nécessite de très grandes infrastructures de cultures cellulaires et l’ optimisation du processus. Sur le plan théorique, on peut craindre que l’ adénovirus défectueux recombinant vaccinal ne se recombine/évolue au cours de la production in vitro (tous les virus prélevés dans une culture cellulaire n’ auraient pas les mêmes séquences) ou in vivo après injection (p.ex., chez une personne infectée par un adénovirus commun), ce qui pourrait entraîner la production de nouveaux adénovirus. Le processus de production compliqué implique une possible différence significative entre lots de production. Une autre préoccupation est la persistance et l‘intégration de l’ ADN chimérique dans le génome humain. On sait que les virus à ADN peuvent s’ intégrer : dans le cas des adénovirus, dans 1 cellule du foie sur 1 million in vivo chez la souris après injection intraveineuse (10). En outre, on ne sait pas comment la séquence d’ ADN de la Spike du SRAS-CoV-2 (qui n’ existe pas dans la nature, les coronavirus étant des virus à ARN) se comporte dans les cellules des personnes injectées et si elle pourrait affecter les taux de persistance et d’ intégration. Les adénovirus recombinants vaccinaux combinent des éléments de plusieurs virus qui ne se seraient pas rencontrés dans la nature, et le résultat à long terme in vivo de ces chimères reste à déterminer.
Sur les quatre vaccins à base d’ adénovirus autorisés, la Suisse a réservé celui d’ AstraZeneca. Cependant, SwissMedic n’ a pas encore approuvé ce vaccin appelé ChAdOx1 nCoV-19 (AZD1222). Il s’ agit d’ un adénovirus recombinant et déficient de chimpanzé dans lequel on a introduit un promoteur du cytomégalovirus, suivi d’ une séquence de gène de l’ activateur tissulaire du plasminogène (une séquence leader), de l’ ADNc codant pour la Spike complète de type sauvage et, à la fin, d’ une séquence de polyadénylation provenant de l’ hormone de croissance bovine (j’ appelle ce vecteur composé de multiples composants d’ ADN Vector Frankenstein car il pourrait être la créature créé par Victor Frankenstein). Le vaccin (5 x 1010 particules par injection, soit environ 1,5 microgramme d’ ADN) est administré par voie intramusculaire à intervalles de 4 à 12 semaines. Il a été rapporté qu’ il fournit des niveaux de protection variables (en fonction de la dose et du site de l’ essai clinique), mais l’ efficacité globale est généralement supérieure à 70 % (11). Bien qu’ il protège contre le variant B.1.1.7 identifié au Royaume-Uni (Source F), il ne semble pas bien protéger contre le variant B.1.351 identifié en Afrique du Sud (Source G).
Plusieurs pays (Danemark, Autriche, Estonie, Lettonie et Luxembourg) ont suspendu la vaccination avec le ChAdOx1 nCoV-19 en raison de l’ apparition de cas de thrombose après la vaccination. Le 7 avril, l’EMEA a conclu que les thromboses inhabituelles avec thrombocytopénies devaient figurer sur la liste des effets secondaires très rares du vaccin d’AstraZeneca.
Un autre adénovirus recombinant a été approuvé comme vaccin contre le SRAS-CoV-2 : Sputnik V (Gamaleya Research Institute). Il consiste en deux adénovirus recombinants (adénovirus de type 26 et adénovirus recombinant de type 5, administrés en séquence), tous deux porteurs du gène spike de type sauvage complet (rAd26 - S et rAd5-S). Spoutnik V a été développé en Russie. Le vaccin est administré à une dose de 1011 particules par voie intramusculaire à 21 jours d’ intervalle et a montré une efficacité de 91,6 % (12).
Enfin, dans l’ intervalle, le vaccin adénoviral recombinant Ad26.COV2.S de Johnson & Johnson a été récemment homologué. Cette construction fut sélectionnée parmi sept vaccins adénoviraux recombinants expérimentaux de sérotype 26 (Ad26). Il diffère notamment du vaccin d’ AstraZeneca en ce qu’ il code une Spike qui possède les deux prolines stabilisant la conformation de préfusion. Une seule injection intramusculaire de 5 x 1010 particules a conféré une protection de 66 % contre la maladie COVID-19 modérée et grave, même en Afrique du Sud, où le variant B.1.351 est largement répandu (13) (Source H).
Vaccins à ARNm « in vitro transcibed » (ivt) non-réplicatif
La principale caractéristique du vaccin à ARNm ivt non-réplicatif est la sécurité. En effet, cette molécule naturelle ne peut pas se multiplier, est active dans le cytosol (et non dans le noyau), et est rapidement et complètement dégradée par les RNases abondantes dans les tissus et les cellules. Ainsi, contrairement aux adénovirus recombinants, mais comme les protéines, ce format de vaccin ne présente aucun risque de persistance, de recombinaison ou de modification du génome humain (1-4). L’ ARNm étant facilement purifié (5), il ne code qu’un seul antigène, ce qui limite le risque d’ induire une immunité contre d’ autres antigènes non pertinents, comme c’ est le cas avec les protéines (contaminants, protéines mal repliées) ou les adénovirus (contaminants, protéines du vecteur). L’ ARNm ivt est condensé dans des liposomes, qui sont généralement composés de quatre lipides différents et sont similaires à une formulation d’ ARN liposomique déjà approuvée en 2018 : Le médicament Onpattro est basé sur une formulation liposomale d’ ARN (siRNA), non pas en tant que vaccin, mais pour le traitement d’ une maladie neurologique génétique (injection intraveineuse de 30 mg par dose toutes les 3 semaines pour le traitement de la polyneuropathie due à une amyloïdose héréditaire médiée par la transthyrétine). Bien que le format de vaccin à ARNm ivt ait été divulgué pour la première fois en 1993 (14), il n’ était pas encore très efficace lorsque j’ ai commencé à l’ évaluer en 1998. Cependant, ses propriétés de sécurité supérieures (comme mentionné ci-dessus) m’ ont encouragé à l’ optimiser davantage. Une autre caractéristique du vaccin à ARNm ivt est la rapidité et la simplicité de sa production : toute séquence d’ ADN précédée d’ un promoteur adéquat (généralement issu des bactériophages T7 ou SP6) est efficacement transcrite in vitro par une ARN polymérase recombinante (généralement T7 ou SP6) produite dans des bactéries (5). Plus de 1000 molécules d’ ARNm sont générées à partir d’ une molécule d’ ADN en quelques heures in vitro. Tous les produits de la transcription (ADN, ARN polymérase, nucléotides) sont d’ origine bactérienne ou chimique. Ainsi, le vaccin ivt mRNA est végane. En plus de permettre de surmonter les réticences d’ ordre religieux ou de convictions, cette caractéristique réduit également les risques d’ allergies ou de développement d’ une immunité non pertinente reconnaissant des contaminants issus des cultures cellulaires comme dans le cas de vaccins à base de protéines ou de virus. Bien que l’ utilisation de l’ ARNm ivt dans les vaccins soit relativement récente (décrite pour la première fois en 1993, injectée à des patients et à moi-même au milieu des années 2000 (15, 16) au travers des premiers essais cliniques que nous avons mis en place à Tübingen, et autorisée pour la première fois en 2020), l’ utilisation de l’ ARNm pour la vaccination est ancienne : les vaccins contre la fièvre jaune, les oreillons, la rougeole et la rubéole sont des virus à ARN qui sont atténués et qui fonctionnent après injection sous-cutanée en délivrant leur ARNm dans les cellules hôtes, qui produisent les protéines virales et déclenchent une réponse immunitaire. Ces anciens vaccins sont donc des vaccins à ARNm «naturels», tandis que les vaccins anti-SRAS-CoV-2 récemment approuvés sont des vaccins à ARNm «synthétiques». Cependant, tous deux reposent sur le même mécanisme de base : la production de protéines virales par des cellules humaines à l’ aide de l’ ARNm injecté. L’ optimisation des molécules d’ ARNm ivt et des formulations liposomales a fait du vaccin à ARNm ivt un format très puissant (17). Il fait l’ objet d’ essais cliniques, principalement en tant que vaccin contre les tumeurs malignes (18, 19). Au début de l’année 2020, cinq vaccins ARNm non-réplicatifs ont été testés pour la vaccination contre COVID-19 : Trois de BioNTech (BNT162a1, qui est fabriqué avec des nucléotides non modifiés et BNT162b1 et BNT162b2, qui contiennent de la pseudouridine), un de CureVac (CvNCoV, qui est fabriqué avec des nucléotides non modifiés), et un de Moderna (qui contient de la pseudouridine). La modification avec de la pseudouridine a été publiée en 2005 pour abolir la stimulation de l’ immunité innée par l’ ARN synthétique (déclenchement des récepteurs de type Toll) (20), ce qui permet d’ utiliser l’ ARNm ivt pour l’ expression de protéines thérapeutiques (non vaccinales) comme p.ex. l’ érythropoïétine. Cependant, il a été publié en 2017 que, de manière surprenante (et toujours pas expliquée), l’ ARNm ivt modifié peut également être utilisé dans les vaccins à ARNm (21). On n’ a pas encore déterminé si l’ ARNm modifié (pseudoUridine) ou non modifié est le meilleur pour un vaccin à ARNm ivt (BioNTech n’ a pas encore publié les résultats obtenus avec son vaccin à ARNm non modifié BNT162a1). Bien que les premières injections d’ un vaccin ARNm ivt anti-SRAS-CoV-2 (et la première injection au monde d’ un vaccin expérimental anti-SRAS-CoV-2 chez l’ homme) aient été réalisées chez des volontaires par Moderna le 16 mars 2020, la première approbation du vaccin ARNm fut pour BioNTech/Pfizer (Comirnaty®) et a eu lieu en décembre 2020 (le 20 décembre en Suisse). Ces deux vaccins à ARNm ivt confèrent une protection de plus de 90 % contre COVID-19 (7, 22) et protègent également contre les nouveaux variants (bien que la neutralisation du variant identifié en Afrique du Sud nécessite des dilutions de sérums plus faibles que celles utilisées pour neutraliser les autres variants) (23).
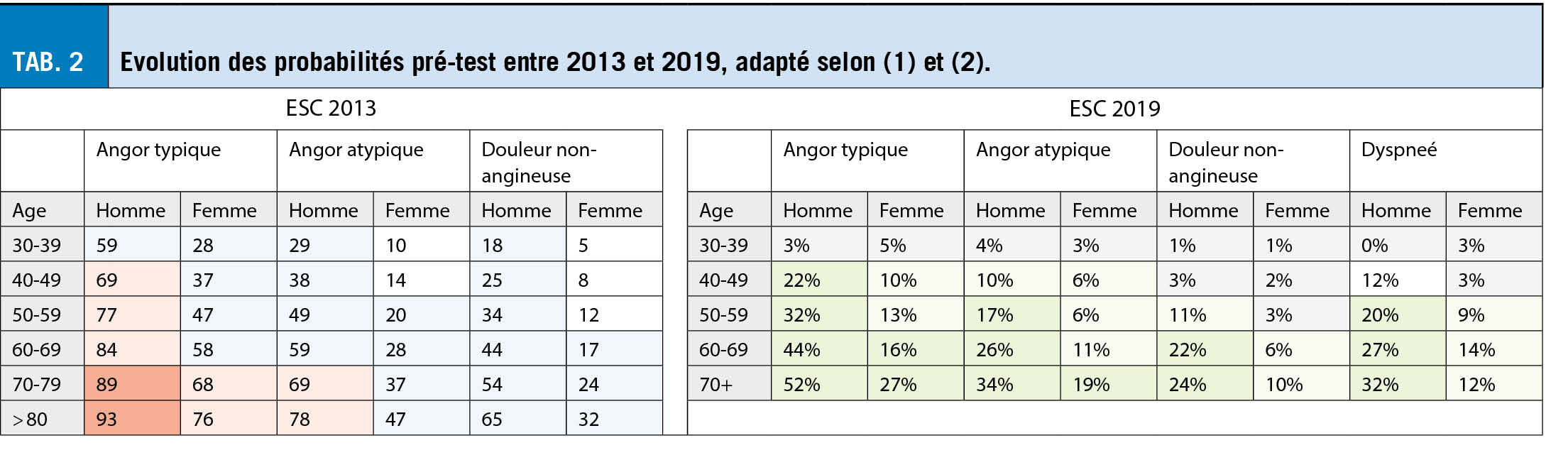
En Israël, dont la population est similaire à celle de la Suisse mais où plus de 50% des personnes ont été vaccinées avec le vaccin BioNTech/Pfizer, une étude portant sur plus d’ un million de personnes (596 618 vaccinés et 596 618 non vaccinés) montre une efficacité du vaccin de 92 % contre l’ infection, 94 % contre les COVID-19 symptomatiques, 87 % contre l’ hospitalisation et 92 % contre la maladie sévère (7 jours ou plus après la deuxième dose). Ainsi, le vaccin de BioNTech/Pfizer est très efficace non seulement pour prévenir la maladie mais aussi la transmission (24). L’ incidence des effets indésirables serait plus faible pour le vaccin Pfizer/BioNTech que pour le vaccin Moderna (25). Le troisième vaccin à ARNm réservé par la Suisse, développé par CureVac, a montré des résultats prometteurs en phase 1 (Source I) et est maintenant testé en phase 3. Les résultats sont attendus. Si l’ autorisation est accordée, la Suisse disposera en tout de 20 millions de doses de vaccin à base d’ ARNm ivt avant l’ été, ce qui sera suffisant pour vacciner entièrement la population de manière sûre et efficace.
Conclusions
Les vaccins homologués contre le SRAS-CoV-2 offrent tous une protection efficace contre le COVID-19 et sont largement administrés pour mettre fin à la pandémie. Comme on peut s’ y attendre avec les vaccins qui agissent en activant fortement le système immunitaire, les effets secondaires courants, généralement légers à modérés, comprennent la fatigue, les maux de tête et les réactions locales. Trois formats de vaccins ont été réservés par la Suisse (fig. 1 et tab. 1) et le seul format actuellement autorisé dans notre pays, la vaccination avec ARNm ivt, combine les aspects de sécurité des vaccins traditionnels à base de protéines (inertes et rapidement éliminés) avec la polyvalence des virus recombinants (faciles à concevoir et rapidement produits). Cependant, contrairement aux adénovirus recombinants, les vaccins à base d’ ARNm ivt ne présentent pas le risque d’ évoluer, de persister, de se recombiner ou de s’ intégrer dans le génome ; et contrairement aux protéines, l’ ARNm ivt présente un risque limité d’ induire une immunité contre des contaminants. Les aspects de sécurité et de flexibilité des vaccins à ARNm ivt en ont fait des gagnants dans la course au développement de vaccins contre le COVID-19. Ces propriétés rendent l’ ARNm ivt particulièrement adapté au développement et à la production de vaccins en vue d’ une éventuelle adaptation du vaccin aux nouveaux variants du SRAS-CoV-2 qui résisteraient à la réponse immunitaire actuelle induite par les vaccins disponibles. Mais heureusement, cela n’ a pas encore été le cas, même si le variant identifié en Afrique du Sud est moins bien reconnue que les autres variants par les anticorps induits par les vaccins ARNm. En outre, la production d’ un million de doses de vaccin nécessite de grandes installations pour les vaccins courants (p.ex., 6000 litres pour un virus de la grippe produit en culture cellulaire), mais seulement 6 litres pour la transcription in vitro dans le cas d’ un vaccin à ARNm. Pour toutes ces raisons (polyvalence, sécurité, facilité de production), les vaccins à ARNm et les thérapies à base d’ ARNm font l’ objet d’ un développement intensif et fondent des espoirs de créer de nouveaux médicaments contre de nombreuses maladies.
Copyright Aerzteverlag medinfo AG
Universitätsspital Zürich, Dermatologie
Gloriastrasse 31
8091 Zürich
steve.pascolo@usz.ch
L’ auteur n’ a pas de conflit d’ intérêts à rapporter à rapporter.
1. Pascolo S. Messenger RNA-based vaccines. Expert Opin Biol Ther 2004; 4(8):1285-1294.
2. Pascolo S. Vaccination with messenger RNA. Methods Mol Med 2006; 127:23-40.
3. Pascolo S. Vaccination with messenger RNA (mRNA). Handb Exp Pharmacol 2008; (183):221-235.
4. Pascolo S. The messenger’s great message for vaccination. Expert Rev Vaccines 2015; 14(2):153-156.
5. Pascolo S. Messenger RNA: The Inexpensive Biopharmaceutical. Journal of Multidisciplinary Engineering Science and Technology (JMEST) 2017; 4(3):6937-6941.
6. Pascolo S. Synthetic Messenger RNA-Based Vaccines: from Scorn to Hype. Viruses 2021; 13(2).
7. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020.
8. Pallesen J, Wang N, Corbett KS, Wrapp D, Kirchdoerfer RN, Turner HL, et al. Immunogenicity and structures of a rationally designed prefusion MERS-CoV spike antigen. Proc Natl Acad Sci U S A 2017; 114(35):E7348-E7357.
9. Keech C, Albert G, Cho I, Robertson A, Reed P, Neal S, et al. Phase 1-2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N Engl J Med 2020; 383(24):2320-2332.
10. Stephen SL, Montini E, Sivanandam VG, Al-Dhalimy M, Kestler HA, Finegold M, et al. Chromosomal integration of adenoviral vector DNA in vivo. J Virol 2010; 84(19):9987-9994.
11. Knoll MD, Wonodi C. Oxford-AstraZeneca COVID-19 vaccine efficacy. Lancet 2021; 397(10269):72-74.
12. Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021; 397(10275):671-681.
13. Sadoff J, Le Gars M, Shukarev G, Heerwegh D, Truyers C, de Groot AM, et al. Interim Results of a Phase 1-2a Trial of Ad26.COV2.S Covid-19 Vaccine. N Engl J Med 2021.
14. Martinon F, Krishnan S, Lenzen G, Magne R, Gomard E, Guillet JG, et al. Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. Eur J Immunol 1993; 23(7):1719-1722.
15. Probst J, Weide B, Scheel B, Pichler BJ, Hoerr I, Rammensee HG, et al. Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent. Gene Ther 2007; 14(15):1175-1180.
16. Weide B, Carralot JP, Reese A, Scheel B, Eigentler TK, Hoerr I, et al. Results of the first phase I/II clinical vaccination trial with direct injection of mRNA. J Immunother 2008; 31(2):180-188.
17. Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines – a new era in vaccinology. Nat Rev Drug Discov 2018; 17(4):261-279.
18. Kranz LM, Diken M, Haas H, Kreiter S, Loquai C, Reuter KC, et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature 2016; 534(7607):396-401.
19. Sahin U, Derhovanessian E, Miller M, Kloke BP, Simon P, Lower M, et al. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature 2017; 547(7662):222-226.
20. Kariko K, Buckstein M, Ni H, Weissman D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005; 23(2):165-175.
21. Pardi N, Hogan MJ, Pelc RS, Muramatsu H, Andersen H, DeMaso CR, et al. Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination. Nature 2017; 543(7644):248-251.
22. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med 2020.
23. Wang Z, Schmidt F, Weisblum Y, Muecksch F, Barnes CO, Finkin S, et al. mRNA vaccine-elicited antibodies to SARS-CoV-2 and circulating variants. Nature 2021.
24. Dagan N, Barda N, Kepten E, Miron O, Perchik S, Katz MA, et al. BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting. N Engl J Med 2021.
25. Meo SA, Bukhari IA, Akram J, Meo AS, Klonoff DC. COVID-19 vaccines: comparison of biological, pharmacological characteristics and adverse effects of Pfizer/BioNTech and Moderna Vaccines. Eur Rev Med Pharmacol Sci 2021; 25(3):1663-1669.
Source A : https://johnsonandjohnson.gcs-web.com/static-files/1c979f4f-cad3-4f8b-9a22-69aaac503570).
Source B: https://ec.europa.eu/commission/presscorner/detail/en/IP_14_229).
Source C : https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html).
Source D : https://www.bag.admin.ch/bag/en/home/krankheiten/ausbrueche-epidemien-pandemien/aktuelle-ausbrueche-epidemien/novel-cov/impfen.html
Source E : https://clinicaltrials.gov/ct2/show/NCT04527575)
Source F : https://www.aekstmk.or.at/images/content/pdfs/covid19/Impf/Lancet%202021%20AZD1222%20efficacy%20against%20B1_1_7_%20variant.pdf)
Source G : https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3777268
Source H : (https://www.fda.gov/media/146265/download).
Source I : (https://www.medrxiv.org/content/10.1101/2020.11.09.20228551v1)