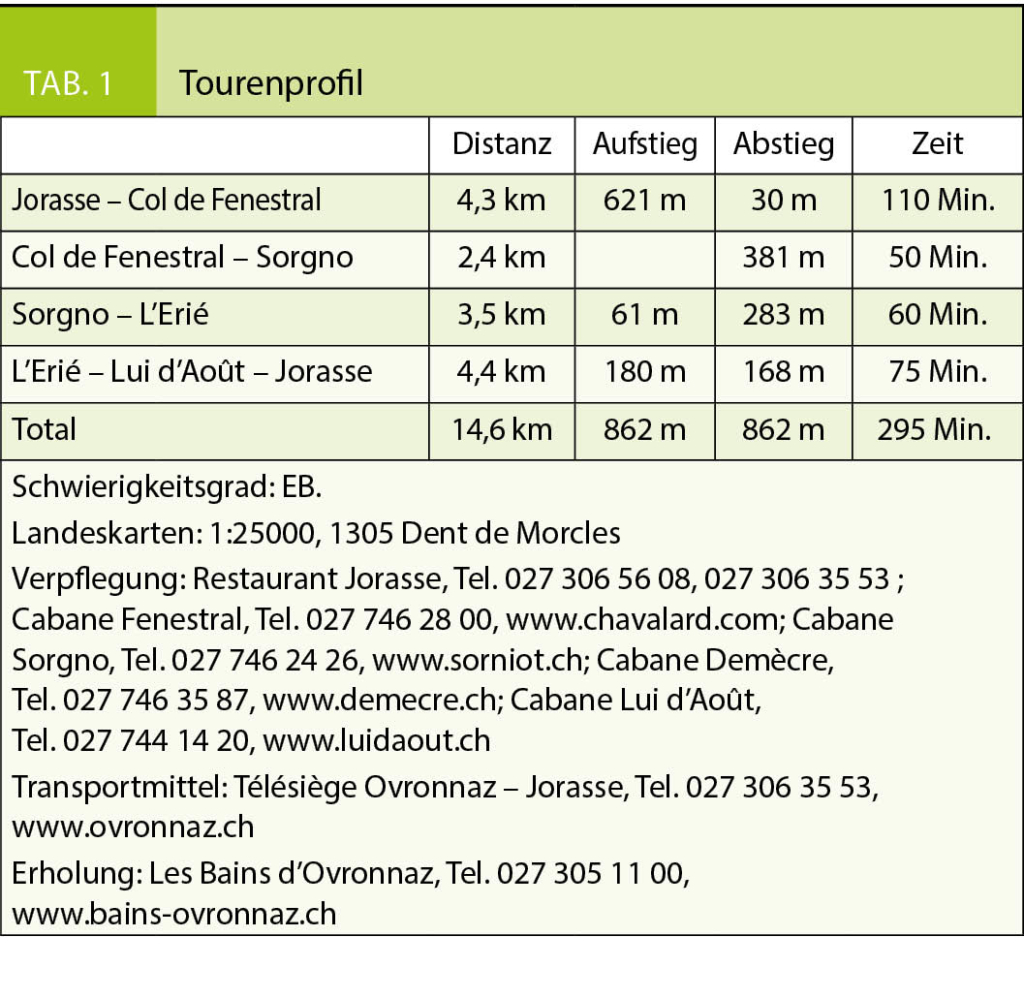
Ein Bericht von Heinz Staffelbach in der Sonntagsausgabe der Neuen Zürcher Zeitung vom 26. Mai 2019 hat uns dazu motiviert, wie empfohlen an einem drückend heissen Sommertag ein einzigartiges Naturschutzgebiet zwischen Udligenswil und Meggen bei Luzern zu entdecken. Dieses liegt mit seinen Wäldern und Moorgebieten im Bereich von auffälligen Geländerippen, die von Nordosten nach Südwesten verlaufen. Diese wurden während der alpinen Gebirgsbildung aufgeworfen. Die von Süden her dem älteren Gotthard- und Aaremassiv überschobenen Decken pflügten im Norden die im Bereich des heutigen Mittellandes liegenden Molasseschichten vor sich her. Die enormen Kräfte bewirkten, dass die mächtigen Nagelfluhbänke der Rigi nach Norden ausstreichend aufgeworfen wurden, während es westlich von Küssnacht nur noch zu kleinen Aufschiebungen reichte, die die heutige Rippenlandschaft bilden.
Ein Bericht von Heinz Staffelbach in der Sonntagsausgabe der Neuen Zürcher Zeitung vom 26. Mai 2019 hat uns dazu motiviert, wie empfohlen an einem drückend heissen Sommertag ein einzigartiges Naturschutzgebiet zwischen Udligenswil und Meggen bei Luzern zu entdecken. Dieses liegt mit seinen Wäldern und Moorgebieten im Bereich von auffälligen Geländerippen, die von Nordosten nach Südwesten verlaufen. Diese wurden während der alpinen Gebirgsbildung aufgeworfen. Die von Süden her dem älteren Gotthard- und Aaremassiv überschobenen Decken pflügten im Norden die im Bereich des heutigen Mittellandes liegenden Molasseschichten vor sich her. Die enormen Kräfte bewirkten, dass die mächtigen Nagelfluhbänke der Rigi nach Norden ausstreichend aufgeworfen wurden, während es westlich von Küssnacht nur noch zu kleinen Aufschiebungen reichte, die die heutige Rippenlandschaft bilden. Der gewaltige Druck auf die Molasse während der Bildung der Alpen wurde aber quer durch das Mittelland übertragen und führte zur Auffaltung des Juragebirges. Die aufgeschobenen Rippen zwischen Udligenswil und Meggen wurden anschliessend während den Eiszeiten rund geschliffen.
Zwischen den aus harter Nagelfluh bestehenden Rippen liegen wasserundurchlässige Mergelschichten, die zu Mulden ausgewaschen wurden und die Bildung von Mooren ermöglichten.
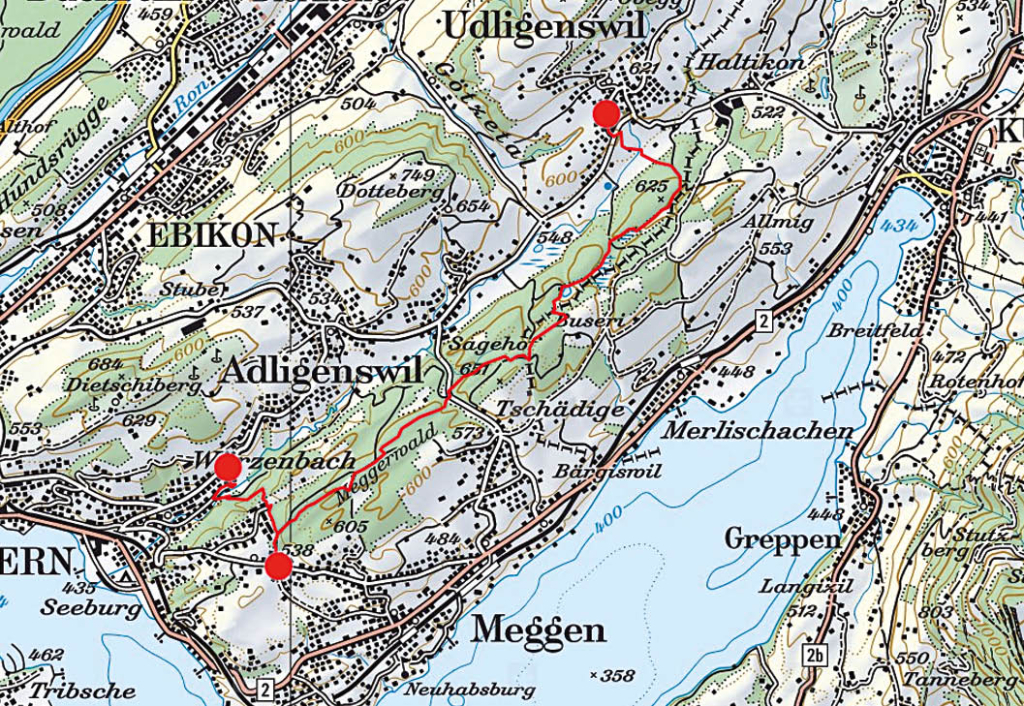
Wir starten beim Restaurant Frohsinn in Udligenswil, das auch zur Einkehr vor oder nach der Wanderung bestens empfohlen werden kann. Wir wenden uns gegen Süden, queren die Landstrasse und das Tälchen des Würzebachs zum Waldrand hinüber. Von ferne leuchten die Berner Alpen mit Eiger, Mönch und Jungfrau herüber. Im Wald stossen wir auf einen breiten Weg, der noch Reste einer Pflästerung aufweist. Dieser führt uns auf die Ostseite der Rippe, auf der der Undere Wald liegt. Bei der fünften Wegverzweigung wählen wir den nach Südwesten abbiegenden Weg zum Teuffe- und Haseried. Hier wurde noch bis Ende des 2. Weltkrieges Torf gestochen, zur Befeuerung der Eisenwerke in Emmen. Immer in gleicher Richtung, eingeklemmt zwischen zwei Geländerippen erreichen wir durch Wald zuerst das Weiherried und später den Moorsee bei den Häusern von Wagemoos. Hier erwartet uns das muntere Quaken von Fröschen und der herrliche Duft der an besonnter Hauswand hochrankenden Rosen. Bänke laden an diesem wunderbaren Ort zum Rasten ein.
Südwestlich des Sees schwingen wir uns auf die Geländeerhebung im Osten, bevor wir zum Gränzetürli absteigen. Hier erfahren wir auf einer Informationstafel, dass im 18. Jahrhundert die Oberen durch Zollerhebungen an jedem erdenkbaren Ort ihre Einnahmen zu erhöhen versuchten, während die Handeltreibenden und Reisenden dies verständlicherweise zunehmend als eine unerträgliche Schikane empfanden. Entsprechend begannen sie die Zollstationen wo nur immer möglich zu umgehen, so auch zwischen Meggen und Udligenswil. Über das Gränzetürli bestand damals eine solche Route, um schadlos in den Kanton Schwyz oder in umgekehrter Richtung auf Luzerner Gebiet zu gelangen. Gegen Westen erreichen wir leicht ansteigend eine dreifache Wegverzweigung. Wir wählen jene nach rechts, überqueren nach wenigen Metern einen breiten Weg und steigen anschliessend wieder in südwestlicher Richtung ins Tälchen des Foremooses ab.
Nach der Überschreitung der Autostrasse in einer leider unübersichtlichen Kurve finden wir im Süden die Fortsetzung unseres Weges. Dieser erklimmt die Rippe, die das Foremoos nach Süden begrenzt und folgt dieser bis zu einem breiten Waldweg, über den wir die letzte Moorlichtung vor Meggen, das Bächtelemoos erreichen. Entlang des abfliessenden Baches gelangen wir schliesslich zum Waldrand bei der Buchmatt von Meggen, wo sich beim Englischen Friedhof eine Bushaltestelle der Linie 25 Richtung Luzern anbietet. Wer noch etwas weiter gehen und für die Rückfahrt nach
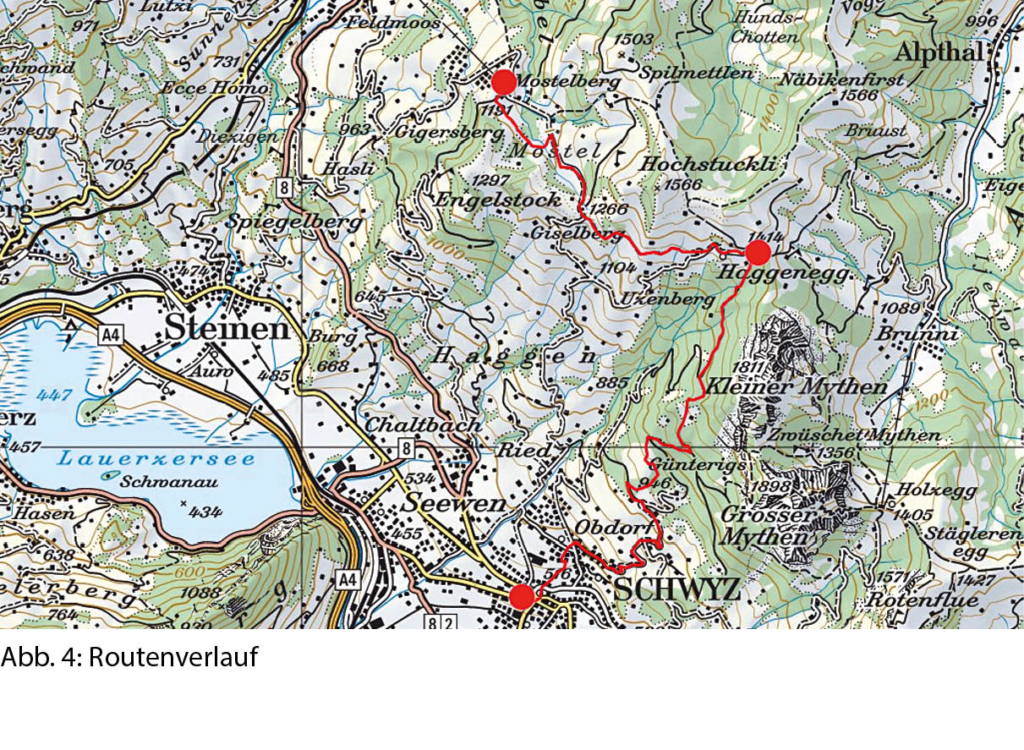
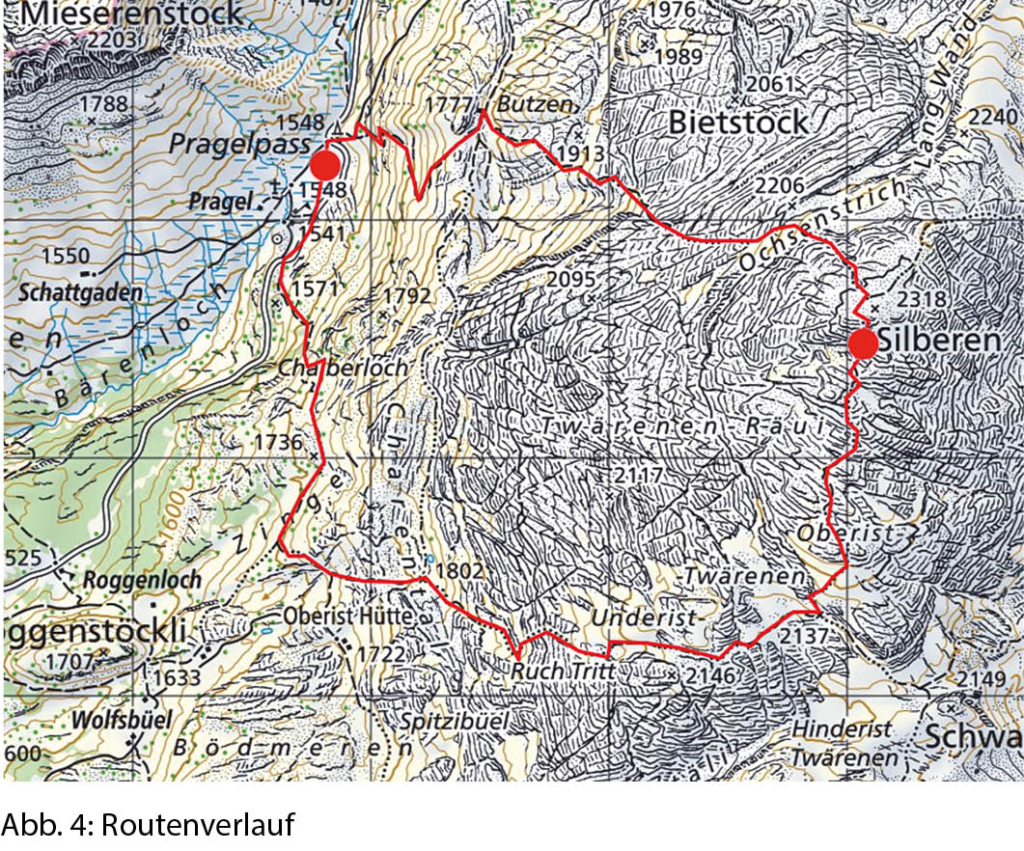
Udligenswil nicht umsteigen möchte, der wendet sich bei den roten Häusern am Waldrand gegen Norden und findet so den Weg zum Würzebach hinunter. Wir entscheiden uns für die Quartierstrasse, die jenseits des Baches in einem Schlag Richtung Osten zur Strasse nach Adligenswil hinauf führt. Dort treffen wir auf die Haltestelle Schädrütihalde der Buslinie 73, die uns nach Udligenswil zurückbringt (Abb. 4). Auf der Rückfahrt und im Trubel der Luzerner Agglomeration erscheint uns die Stille des soeben durchwanderten Naturschutzgebietes wie eine Fata morgana.
Aufgepasst
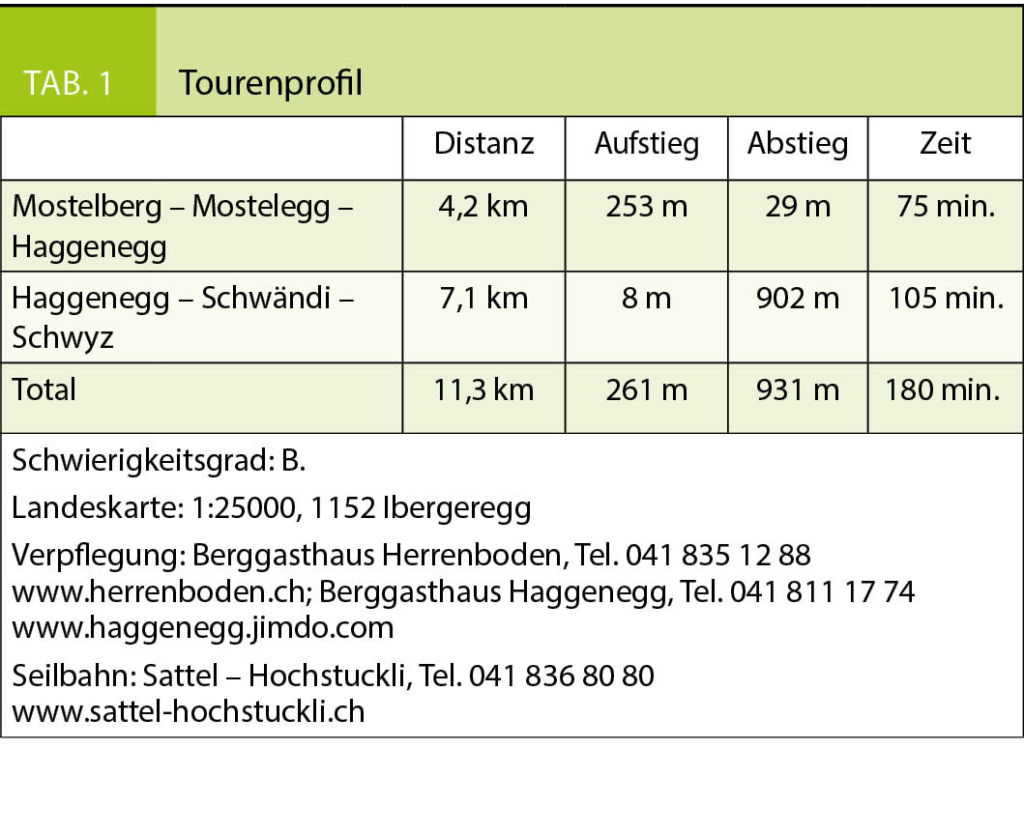
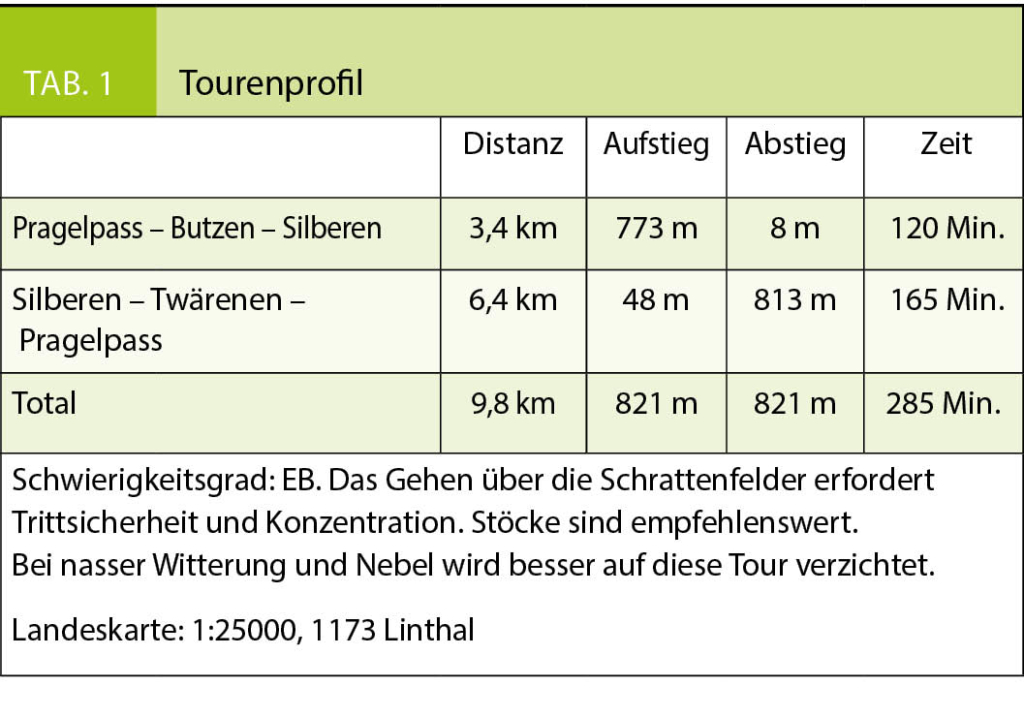
In dieser Rubrik werden Berg- und Schneeschuhwanderungen vorgestellt, die in der Regel wenig bekannt sind, zu aussergewöhnlichen Orten führen und die Genugtuung einer besonderen persönlichen Leistung bieten, sei es, dass man sich am Abend nach der Arbeit noch zu einer kleinen körperlichen Anstrengung überwindet, bzw. sich in ein oder zwei Tagen abseits breit getretener Wege unvergessliche Naturerlebnisse erschliesst. Zur besseren Beurteilbarkeit des Schwierigkeitsgrades der Tourenvorschläge wird jeweils eine Einschätzung anhand der SAC-Skala für Berg- (B, EB, BG) und für Schneeschuhwanderungen (WT 1–6) gegeben. Die schwierigste Wegstelle, unabhängig von ihrer Länge, bestimmt jeweils die Gesamtbewertung der Route. Letztendlich bleibt aber jeder selbst für die Beurteilung seiner Fähigkeiten und Eignung für die vorgestellte Wanderung verantwortlich. Die Gehzeiten sind Richtwerte und gelten für normal trainierte Wanderer. Sie müssen nicht zwingend mit den Angaben auf Wegweisern übereinstimmen.
Riedstrasse 9
6430 Schwyz
christian.besimo@bluewin.ch