Einleitung
Die chronische Nierenkrankheit (CKD) ist eine bedeutende gesundheitliche Herausforderung. Die WHO hat im Mai 2025 eine Resolution verabschiedet, um die chronische Nierenkrankheit als globale Gesundheitspriorität anzuerkennen und zu bekämpfen. Sie will die Länder zur stärkeren Integration der Nierenversorgung in nationale Gesundheitsstrategien sowie zur besseren Prävention, Früherkennung und Behandlung der CKD auffordern und die primären Gesundheitsdienste stärken (1).
Aktuell sind weltweit und in der Schweiz circa 10 % der erwachsenen Bevölkerung von einer CKD betroffen, wobei über zwei Drittel undiagnostiziert bleiben (2–4). CKD-Patientinnen und -Patienten haben ein höheres Risiko, frühzeitig zu versterben als eine terminale Niereninsuffizienz zu entwickeln (5). Prognosen zufolge wird die CKD bis zum Jahr 2040 weltweit die fünfthäufigste Todesursache darstellen (6). CKD-Betroffene, die das Endstadium – eine terminale Niereninsuffizienz – erreichen und ein Nierenersatzverfahren wie Dialyse oder Nierentransplantation benötigen, leiden unter einer reduzierten Lebensqualität und verursachen erhebliche Gesundheitskosten. In den Industrieländern entfallen derzeit schätzungsweise zwei bis drei Prozent des jährlichen Gesundheitsbudgets auf Nierenersatzverfahren wie Nierentransplantation und Dialyse (7). Mit einer wachsenden Prävalenz und steigenden Kosten stellt die CKD eine erhebliche Belastung für das öffentliche Gesundheitssystem dar. In der Schweiz wird bis 2032 ein Anstieg auf 1.03 Millionen Betroffene erwartet, was mit geschätzten Kosten von 4.2 Milliarden Franken verbunden ist (8, 9).
Diese Zahlen verdeutlichen die Notwendigkeit einer effektiven Früherkennung bei Risikogruppen sowie eines optimalen Krankheitsmanagements in der Grundversorgung, um die Mortalität und den Bedarf an Nierenersatzverfahren so weit wie möglich zu reduzieren und die Lebensqualität der Patientinnen und Patienten zu verbessern.
In diesem Zusammenhang hat die Schweizerische Gesellschaft für Nephrologie (SGN) einfache Empfehlungen für Fachpersonen der Allgemeinen Inneren Medizin / Hausarztmedizin zur Früherkennung einer CKD bei Risikogruppen publiziert, welche sich auf die internationalen Empfehlungen von Kidney Disease: Improving Global Outcomes (KDIGO) stützen (10, 11). Kernpunkt in den Empfehlungen ist ein regelmässiges Screening bei Risikopatientinnen und -patienten mit Diabetes mellitus, arterieller Hypertonie und Herz-Kreislauf-Erkrankungen mittels eGFR und Albumin-Kreatinin-Ratio im Urin (UACR), um eine CKD früh zu erkennen und eine Progression der Erkrankung rechtzeitig zu detektieren sowie adäquat zu behandeln.
Nach den aktuellen Empfehlungen wird eine chronische Nierenkrankheit (CKD) definiert als das Vorliegen einer strukturellen oder funktionellen Störung der Nieren, die über mehr als drei Monate besteht und Auswirkungen auf die Gesundheit hat. Die Diagnose CKD kann gestellt werden, wenn mindestens eines der folgenden Kriterien für mehr als drei Monate persistiert (10, 11):
1. geschätzte glomeruläre Filtrationsrate (eGFR) < 60 ml/min/1.73 m2 und/oder
2. Albumin-/Kreatinin-Quotient (ACR) ≥ 30 mg/g und oder
3. morphologische Indikatoren für Nierenschäden, wie z. B. Veränderung des Urinsediments, histologische Veränderungen oder strukturelle Nierenschäden
Anhand dieser Parameter wird die CKD in fünf eGFR-Kategorien (G1 bis G5) und drei Stadien der Albuminurie (A1 bis A3) eingeteilt (Abb. 1).
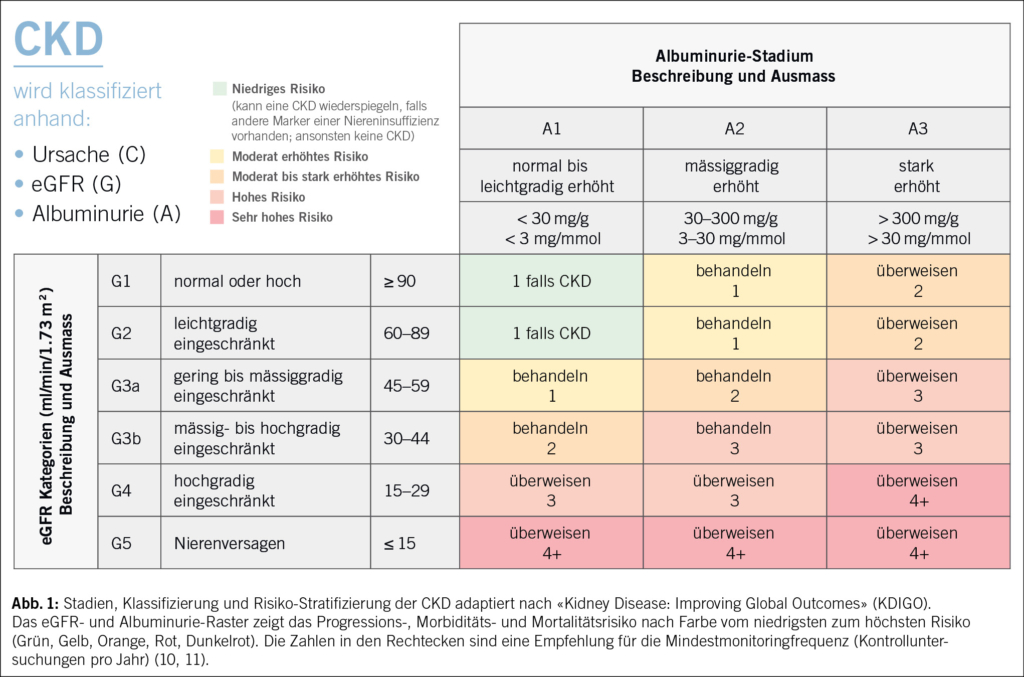
Eine Analyse zur Versorgungsqualität von CKD-Patientinnen und -Patienten in der Grundversorgung im Rahmen des FIRE-CKD-Projekts hat jedoch deutliches Verbesserungspotenzial in Bezug auf die Umsetzung der bestehenden Empfehlungen aufgezeigt: Hierzu wurde die Erfüllung von 14 evidenzbasierten Qualitätsindikatoren zum CKD-Management über einen gewissen Zeitraum in den an das FIRE-Projekt angeschlossenen Hausarztpraxen erhoben. Auffällig war dabei der geringe Anteil an CKD-Patientinnen und -Patienten, die innerhalb von 18 Monaten Follow-up eine UACR-Messung erhielten: Dieser lag bei nur 18.1 %. Diese Erkenntnisse weisen auf Defizite in der aktuellen Praxis in der Grundversorgung hin, die adressiert werden sollten (12). Die Umsetzung der SGN-Empfehlungen in der Praxis bleibt für viele Hausärztinnen und Hausärzte eine Herausforderung, die eine systematische Hilfestellung in der Implementierung der Guidelines erfordert.
Ein vielversprechender Ansatz zur Unterstützung des Chronic-Care-Managements ist die Implementierung von Qualitätsindikatoren und Adhärenz-Scores, die helfen, evidenzbasierte Behandlungsstrategien zu quantifizieren. Qualitätsindikatoren sowie Adhärenz-Scores ermöglichen es, auf einfache und effiziente Weise die Qualität der medizinischen Versorgung zu messen, und fördern das Bewusstsein für Behandlungslücken und Optimierungspotenziale.
Der SGED-Score, der in der Schweiz als erstes Instrument zur Messung der Versorgungsqualität bei Diabetes vorgeschlagen wurde, basiert auf internationalen Standards wie dem «Diabetes Recognition Program» des National Committee for Quality Assurance (NCQA) und der American Diabetes Association (ADA) und wurde von der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie (SGED) für die Schweizer Versorgungslandschaft angepasst (13, 14). Zur Messung der Versorgungsqualität von Patientinnen und Patienten mit einem kardiovaskulären Risiko wurde der CARE-Score entwickelt, welcher zuverlässig und reproduzierbar die Performance eines Hausarztkollektivs oder individueller Hausärztinnen und Hausärzte abbilden kann (15).
Die Beispiele des SGED-Scores und CARE-Scores zeigen den Erfolg der interdisziplinären Zusammenarbeit zwischen Fachärztinnen/Fachärzten, Fachgesellschaften und der Versorgungsforschung in der Schweiz. Diese Zusammenarbeit ist entscheidend, um Daten zur Evaluation der gegenwärtigen Praxis zu generieren, Barrieren bei der Umsetzung neuer Empfehlungen und Strategien zu überwinden sowie die Qualität der Versorgung kontinuierlich zu verbessern.
Die Autoren haben sich als Experten der Versorgungsforschung, Hausarztmedizin und Allgemeinen Inneren Medizin sowie Nephrologie in einer Arbeitsgruppe zum Ziel gesetzt, ein Set von Indikatoren zur Unterstützung der Nierenversorgung in der Schweiz anhand der Beispiele des SGED- und CARE-Scores zusammenzustellen, um die systematische Früherkennung der CKD in der Grundversorgung zu unterstützen und das Management von CKD- Patientinnen und -Patienten zu erleichtern.
Das so entstandene Kidney Care Indikatorenset wurde anschliessend genutzt, um anhand der FIRE-Datenbank deren Erfüllungsgrad für das Jahr 2024 zu berechnen und den gegenwärtigen Stand der Nierenversorgung von Risikogruppen und CKD-Betroffenen durch ein breites Hausarztkollektiv abzubilden. Das Kidney Care Indikatorenset kann als Basis für einen Adhärenz-Score zur Messung der Versorgungsqualität von Nierenpatienten dienen.
Methodik: Das Kidney Care Indikatorenset
Beginnend im Juli 2024, haben die Autoren sich in einer interdisziplinären Projektgruppe aus Experten der Versorgungsforschung, Allgemeinen Inneren Medizin und Nephrologie formiert, um anhand der Erfahrungen aus dem SGED-Score und CARE-Score ein Instrument für die Qualität der Nierenversorgung in der Schweiz zu entwickeln.
Das Ziel war es, ein pragmatisches, evidenzbasiertes Set an Qualitätsindikatoren auf akademischer Basis zusammenzutragen, das die Qualität der Versorgung von Risikogruppen und CKD-Betroffenen im Hinblick auf Prozesse und Zielwerterreichung rund um die «Nierengesundheit» aufzeigt und die Bestrebungen zur Reduktion einer CKD- Progression beschreibt. Grundlage für die einzelnen Indikatoren waren die Empfehlungen der Schweizerischen Gesellschaft für Nephrologie (SGN) und KDIGO.
Die Indikatoren sollten aus den üblichen hausärztlichen Routinedaten errechenbar sein, die im Rahmen der Betreuung von Risikopatientinnen und -patienten gemäss Leitlinien zu dokumentieren sind. Ziel des Indikatorensets ist es, dem einzelnen Arzt / der einzelnen Ärztin langfristig in einem Dashboard einen einfachen und pragmatischen Überblick über die «Performance» im Sinne einer Guideline-Adhärenz der eigenen Versorgung zu bieten. Die Ergebnisse der Kidney Care Qualitätsindikatoren können auch in Qualitätszirkeln oder in Netzwerken zu Qualitätsmassnahmen genutzt werden. Langfristig ist erstrebenswert, ein Dashboard zu haben, welches auf einfache Weise den Istzustand beschreibt, zu mehr Visibilität für die bislang vernachlässigte chronische Nierenkrankheit führt und eine Verbesserung der Nierenversorgung in der Schweiz über die nächsten Jahre unterstützt.
Eine Stärke des SGED- und des CARE-Scores besteht darin, nicht nur Prozesse, sondern auch klinische Outcomes wie das HbA1c oder den Blutdruck abzubilden. Es wurde daher auch Wert darauf gelegt, im Kidney Care Indikatorenset nicht nur Prozessindikatoren zu inkludieren, sondern auch mindestens einen klinisch relevanten Outcome-Parameter anzugeben.
Die Expertengruppe hat sich nach eingehender Literaturrecherche, Prüfung der bestehenden Empfehlungen und Diskussion auf nachfolgende Indikatoren geeinigt (Tab. 1). Wichtig ist anhand des Konsensus der Expertengruppe, dass das ausgewählte Set an Kidney Care Indikatoren die Versorgungsqualität für 2 Populationen abbildet, um eine aussagekräftige Orientierung zur Nierenversorgung in der Hausarztpraxis zu erhalten: Zum einen wird das regelmässige Screening zur CKD-Früherkennung für die Risikopopulationen mit Diabetes mellitus, arterieller Hypertonie und etablierten kardiovaskulären Erkrankungen gemessen, zum anderen wird das CKD-Management für Patientinnen und Patienten mit einer diagnostizierten CKD dargestellt. Die Empfehlung der Experten ist, das Assessment der Nierenwerte bei Diabetes mellitus analog zum SGED-Score einmal jährlich durchzuführen. Das Assessment der Nierenwerte bei arterieller Hypertonie und etablierter kardiovaskulärer Erkrankung sollte laut Expertenempfehlung individuell am jeweiligen Risikoprofil orientiert sein und mindestens alle 3–5 Jahre durchgeführt werden (16–18). Bei etablierter CKD-Diagnose wird eine mindestens einmal jährliche Messung respektive Kontrolle der einzelnen Parameter empfohlen.
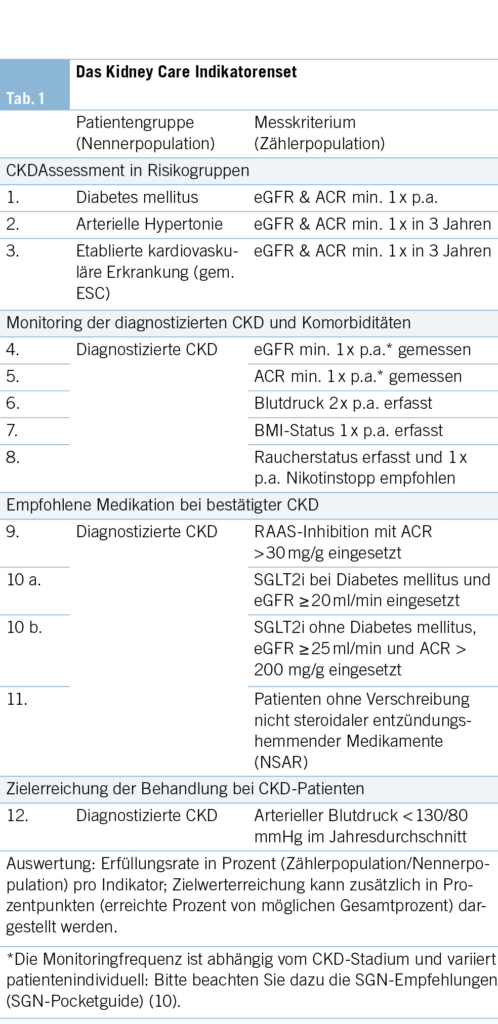
Proof of Concept: Erste Ergebnisse des Kidney Care Indikatorensets im FIRE-Kollektiv
Eine erste Evaluation des Kidney Care Indikatorensets wurde mit Daten aus dem FIRE-Projekt des Instituts für Hausarztmedizin der Universität Zürich durchgeführt (www.fireproject.ch) (19). Die FIRE-Datenbank besteht seit 2009 und sammelt verschiedene Komponenten der elektronischen Krankengeschichte von über 400 Deutschschweizer Hausärztinnen und Hausärzten. Insbesondere können in der FIRE-Datenbank Patientinnen und Patienten mit chronischer Nierenerkrankung anhand von Kreatinin- und Albuminurie-Messungen sowie Einträgen in den Diagnoselisten identifiziert werden. Für die vorliegende Auswertung wurden alle Mitglieder des FIRE-Projekts berücksichtigt, die im Jahr 2024 über einen Zeitraum von mindestens 10 Monaten Konsultationen bei mindestens 100 Patientinnen und Patienten aufwiesen. Für jedes dieser FIRE-Mitglieder wurde für jeden Indikator die Nennerpopulation extrahiert, die aus allen Patientinnen und Patienten bestand, welche für den jeweiligen Indikator infrage kamen. Innerhalb dieser Nennerpopulation wurde das Kollektiv bestimmt, welches das Messkriterium des jeweiligen Indikators erfüllte und somit die Zählerpopulation bildete. Anschliessend wurde eine rohe Erfüllungsrate als prozentualer Anteil der Zählerpopulation an der Nennerpopulation berechnet. Da Unterschiede in der demografischen Zusammensetzung der Patientenkollektive verschiedener Hausärztinnen und Hausärzte zu unterschiedlichen Voraussetzungen für die Erfüllung von Indikatoren führen können, haben wir diese rohen Erfüllungsraten nach Alters- und Geschlechtsverteilung standardisiert, um eine bessere Vergleichbarkeit zu ermöglichen.
Zusätzlich zu den Erfüllungsraten in den einzelnen Indikatoren wurde das Ziel verfolgt, diese zu einer Gesamterfüllungsrate zu aggregieren. Ziel ist es, mit einer einzigen Performance-Zahl einen Gesamtüberblick über die Qualität der Versorgung der chronischen Nierenkrankheit durch die einzelnen Hausärztinnen und Hausärzte geben zu können. In der Literatur finden sich verschiedene Möglichkeiten, die Erfüllungsraten von Einzelindikatoren zu Gesamtscores zu aggregieren, wobei am häufigsten die mit der Grösse der jeweiligen Nennerpopulation gewichteten Mittelwerte der Erfüllungsraten der Einzelindikatoren anzutreffen sind (20). Somit erhält jeder Indikator eine Gewichtung, die proportional zur Anzahl der interessierenden Patientinnen und Patienten ist.
Auf diese Weise haben wir eine erste Version einer aggregierten Erfüllungsrate als gewichtetes Kidney Care Indikatorenset berechnet. Obwohl diese Art der Aggregation intuitiv verständlich ist, ist sie mit einigen Nachteilen verbunden. Einerseits unterliegt die Schätzung der Versorgungsqualität bei Hausärztinnen und Hausärzten mit kleinen Patientenkollektiven starken Schwankungen, was die Genauigkeit des Scores beeinträchtigt. Andererseits wird bei dieser Art der Aggregation nicht berücksichtigt, dass ein Grossteil der Indikatoren in einem gemeinsamen Patientenkollektiv erfasst wird und Mehrfachbeobachtungen einzelner Patienten in mehreren Indikatoren möglich sind, sodass die individuellen Erfüllungsraten korreliert sein sollten. Um diese Limitationen zu umgehen, haben wir eine zweite Methode angewandt, die auf einem modellbasierten Ansatz beruht. Zu diesem Zweck haben wir ein gemischtes logistisches Regressionsmodell über den gesamten Datensatz verwendet, das neben einer Adjustierung für Alter und Geschlecht auch die Berücksichtigung von Mehrfachbeobachtungen einzelner Patienten in mehreren Indikatoren erlaubt. Auf Basis dieses Modells wurde die durchschnittliche Performance der Hausärztinnen und Hausärzte in einer Standardpopulation berechnet, die in ihrer demografischen Zusammensetzung der in der Auswertung berücksichtigten Gesamtpopulation entspricht. Diese Performance haben wir als modellbasiertes Kidney Care Indikatorenset definiert (technische Details zur Berechnung im Anhang).
Für die Auswertung wurden die Daten von 290 Teilnehmenden des FIRE-Projekts analysiert. Die Auswertung der Indikatoren 1–3 (Assessment bei Risikogruppen) beruhte auf 95 786 Patientinnen und Patienten mit Diabetes, Hypertonie oder etablierter kardiovaskulärer Erkrankung (mittleres Alter 66.8 ± 15.7 Jahre [SD]; 48.6 % weiblich), während die Auswertung der Indikatoren 4–12 auf 23 992 Patientinnen und Patienten mit zu Beginn des Jahres 2024 vorbestehender CKD beruhte (mittleres Alter 74.3 ± 15.6 Jahre [SD]; 50.9 % weiblich; häufigste Stadien G2 zu 29.5 % und G3a zu 24.8 %).
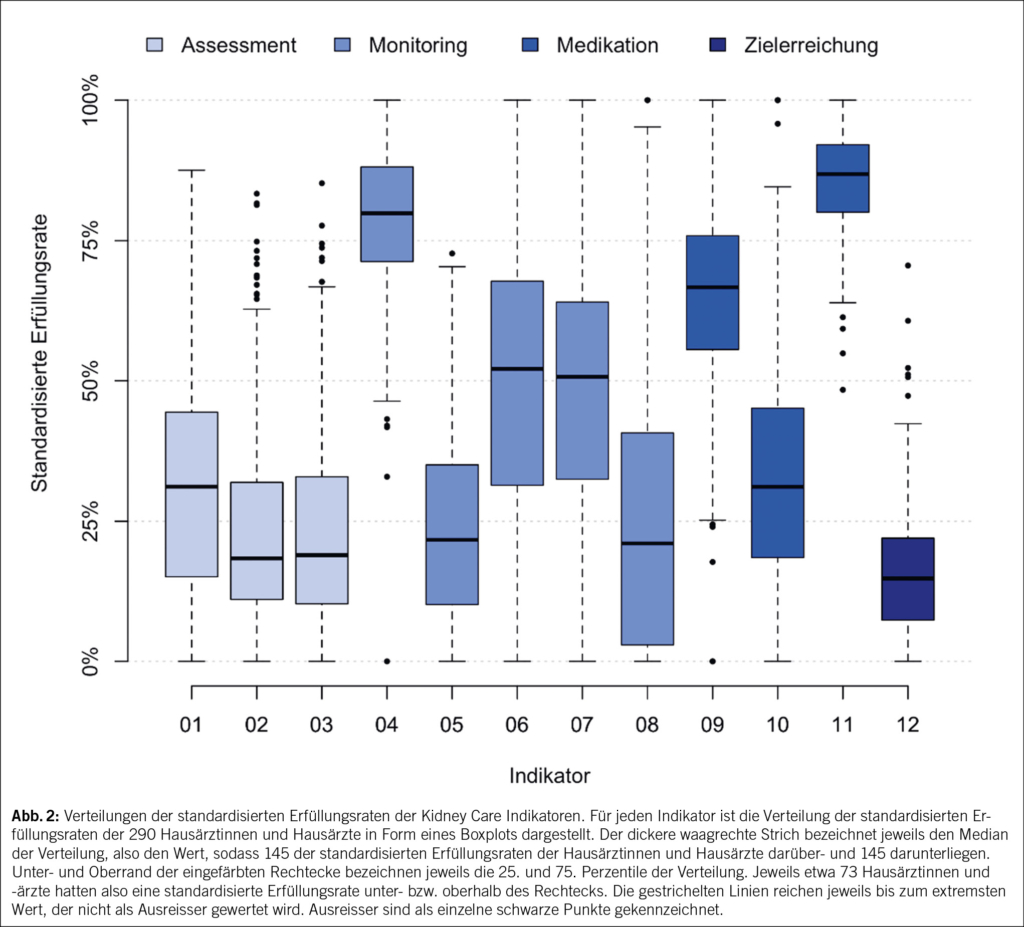
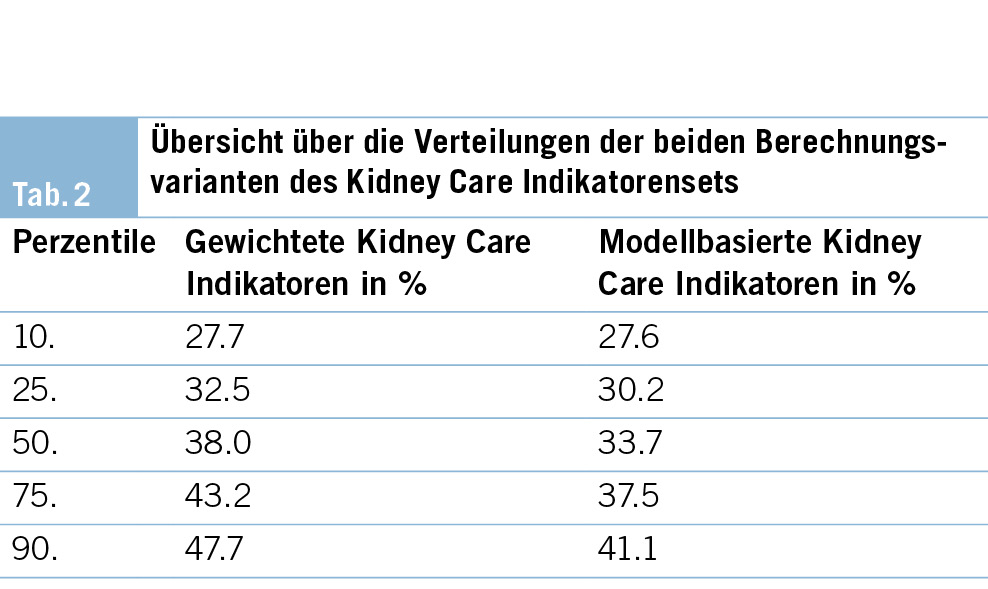
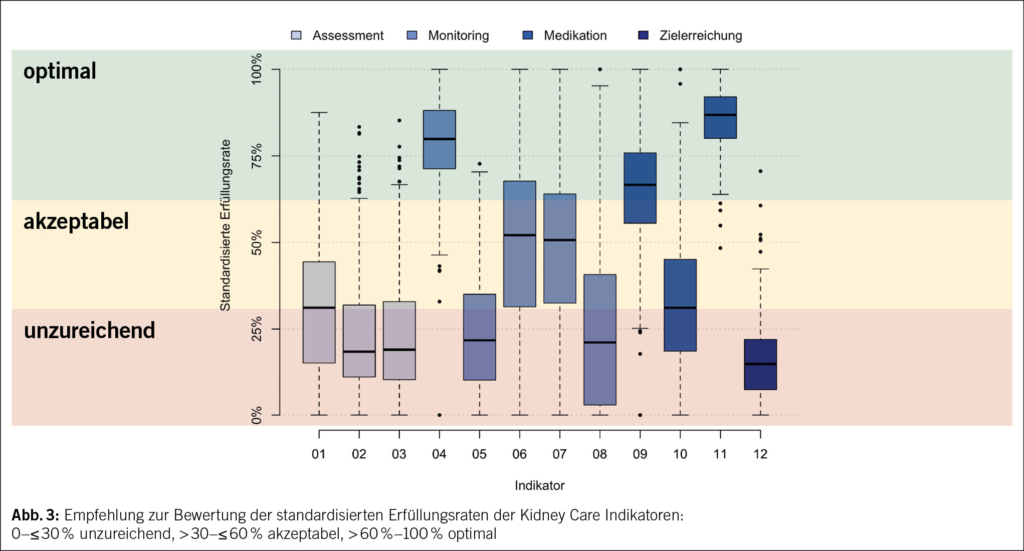
Die Verteilungen der individuellen standardisierten Erfüllungsraten sind in (Abb. 2) zusammengefasst. Die höchsten Erfüllungsraten wurden bei Indikatoren 11 (Verzicht auf Verschreibung von nicht steroidalen entzündungshemmenden Medikamenten) und 4 (eGFR-Monitoring bei bekannter CKD) beobachtet, mit Medianen bei 86.8 % bzw. 79.9 %. Die tiefsten Erfüllungsraten wurden bei Indikatoren 2 (eGFR- und Albuminurie-Assessment bei arterieller Hypertonie) und 3 (eGFR- und Albuminurie-Assessment bei etablierter kardiovaskulärer Erkrankung) sowie beim Outcome-Indikator 12 (arterieller Blutdruck < 130/80 mmHg im Jahresdurchschnitt) ermittelt: 18.3 % und 18.9 % bzw. 14.7 %. Tab. 2 gibt eine Übersicht über die Verteilungen der beiden aggregierten Kidney Care Indikatorensets.
Diskussion
Die Entwicklung des Kidney Care Indikatorensets stellt einen pragmatischen Ansatz zur strukturierten Beschreibung der Versorgungsqualität bei chronischer Nierenerkrankung (CKD) dar und soll den Istzustand einer Erkrankung, welche bislang aufgrund von fehlenden therapeutischen Konsequenzen nicht im Fokus war, darstellen. Die Kidney Care Indikatoren visualisieren die bedeutende Herausforderung des Managements von Risikogruppen sowie CKD-Patientinnen und -Patienten in der Grundversorgung. Die Ergebnisse der ersten Erhebung, basierend auf der umfangreichen Datenbank des FIRE-Projekts, zeigen Diskrepanzen zwischen den Leitlinien-empfehlungen und der realen Praxis. Bemerkenswert sind die stark variierenden Erfüllungsraten der 12 Indikatoren, die von einem Median von 86.8 % bei der Nichtverschreibung von NSAR bis zu 18.3 % bei dem eGFR- und Albuminurie-Assessment bei Patienten mit arterieller Hypertonie und 18.9 % bei dem eGFR- und Albuminurie-Assessment bei Patienten mit kardiovaskulären Erkrankungen innerhalb eines Zeitraums von 3 Jahren reichen.
Die UACR-Messraten bleiben selbst über einen ausgedehnten Zeitraum von 3 Jahren bei Risikogruppen in einem niedrigen Bereich. Genauso ist auch die jährliche UACR-Messrate bei diagnostizierter CKD niedrig und liegt nur bei 21.6 %. Die UACR-Messung scheint somit ein «Flaschenhals» für eine gute Nierenversorgung in der Praxis zu sein. Da inzwischen wirksame Therapiemöglichkeiten zur Verbesserung des Outcomes bei CKD existieren, empfiehlt es sich, bei Risikopatienten regelmässig die UACR zu bestimmen. Das Kidney Care Indikatorenset kann als Hilfestellung dienen, um an die zentralen Aspekte der Früherkennung und des Managements der CKD zu erinnern und den Verlauf zu visualisieren.
Das Kidney Care Indikatorenset bietet nicht nur eine strukturierte Bewertung der Versorgungsqualität bei CKD, sondern lässt auch Raum für individuelle Bedürfnisse und flexible Anwendung im Praxisalltag. Die Möglichkeit, Qualitätsindikatoren an patientenspezifische Profile und unterschiedliche Praxisstrukturen anzupassen, macht es zu einem vielseitigen Instrument. So können Hausärztinnen und Hausärzte gezielt auf die Besonderheiten ihres Patientinnen- und Patientenkollektivs eingehen und das Management an die jeweiligen klinischen Situationen anpassen. Dies erlaubt zum Beispiel, Patientengruppen aktiv abhängig von Alter, Gesundheitszustand (Frailty, aktives Malignom, Pflegeheimpatienten) und Compliance zur Berechnung des Indikatorensets auszuschliessen. Diese Anpassungsfähigkeit fördert eine personalisierte und bedarfsgerechte Nierenversorgung, ohne die Vorteile einer standardisierten Qualitätsmessung zu verlieren.
Eine Einschränkung auf die Patientenpopulation der unter 75-Jährigen wurde eingehend diskutiert. Eine Analyse der Kidney Care Indikatoren mit Einschluss der unter 75-Jährigen zeigt jedoch keine grossen Abweichungen in den Erfüllungsraten (Supplement). Vor diesem Hintergrund ist daher eine altersunabhängige Implementierung der Kidney Care Indikatoren zu befürworten, um ein einfaches und konsistentes Management gemäss den aktuellen Empfehlungen zu ermöglichen.
In den Diskussionen der Expertenrunde wurde auch deutlich, dass starre Zielwertvorgaben für Erfüllungsraten aktuell nicht sinnvoll sind, um die Akzeptanz und Umsetzung der Kidney Care Indikatoren in der Hausarztpraxis zu unterstützen. Eine einfachere Darstellung, beispielsweise durch Boxplot-Diagramme, ist hingegen wertvoll und sinnvoll, um eine individualisierte Orientierung für Hausärzte zu bieten, Vergleiche mit der Peergroup zu ziehen und die kritische Reflexion der eigenen Versorgungsleistung zu fördern. Daher wurde bewusst auf Zielwertvorgaben verzichtet. Die Experten empfehlen generell das Anstreben akzeptabler oder optimaler Werte (Abb. 3), um die laut Empfehlungen notwendigen medizinischen Massnahmen für eine adäquate Nierenversorgung umzusetzen. Ziel ist es, die Anschaulichkeit der Kidney Care Indikatoren in den Fokus zu stellen, um durch die Visualisierung eine langfristige Verbesserung der Nierenversorgung zu fördern.
Längerfristig soll die praktische Anwendung der Kidney Care Indikatoren durch Integration in bestehende Dashboards unterstützt werden, die Ärztinnen und Ärzten eine benutzerfreundliche Visualisierung der Indikatoren bieten und den Bedarf für gezielte Interventionen bei einzelnen Patientinnen und Patienten oder ganzen Patientengruppen klar erkennbar machen.
Limitierungen
Der gegenwärtige Ansatz weist Limitationen auf, die berücksichtigt werden müssen, um die Validität und Akzeptanz zu erhöhen. Beispielsweise basiert der Ansatz auf der Annahme, dass die Erfüllung von Prozessindikatoren automatisch zu verbesserten klinischen Outcomes führt, was noch durch langfristige empirische Studien zu validieren wäre. Ausserdem bestehen derzeit Herausforderungen in der Konsistenz der Erfüllungsraten, insbesondere in kleineren Praxen, die zu signifikanten Schwankungen führen können. Zukünftige Optimierungen sollten auf die Weiterentwicklung der dokumentationsbezogenen Strukturprozesse sowie Darstellung über Dashboards und die Anpassung an patientenspezifische Bedürfnisse abzielen, um die langfristige Implementierung und Effektivität der Indikatoren zu sichern.
Schlussfolgerungen
Das Kidney Care Indikatorenset kann die Versorgungsqualität von Patienten mit CKD in hausärztlichen Praxen darstellen. Die Auswertung anhand der FIRE-Datenbank verdeutlicht bestehende Versorgungslücken, insbesondere bei der Erfüllung wichtiger Indikatoren wie der UACR-Messung. Diese Defizite spiegeln wider, dass die CKD bislang aufgrund begrenzter therapeutischer Optionen wenig Beachtung fand. Durch neue Therapien und gesundheitspolitische Impulse – etwa durch die WHO-Resolution – rückt die leitliniengerechte Nierenversorgung nun stärker in den Fokus.
Die Implementierung der Kidney Care Indikatoren in benutzerfreundliche Dashboards und Praxismanagement-Softwares ist nun wünschenswert, um die praktische Anwendung zu fördern und damit zur Unterstützung der leitliniengerechten Nierenversorgung in der Schweiz beizutragen. Das Indikatorenset bietet eine solide Grundlage, um die Qualität der Nierenversorgung langfristig systematisch und Schritt für Schritt zu verbessern.
Levy Jäger 1, Leander Muheim 2, Christian Häuptle 3, Michael Brändle 4, Harald Seeger 5, Thomas Rosemann 1
1 Institut für Hausarztmedizin, Universität Zürich, Zürich
2 mediX Zürich AG, Zürich
3 WHM/FMF Stiftung zur Förderung der Weiterbildung in Hausarztmedizin
4 HOCH Health Ostschweiz, St.Gallen
5 Institut für Nephrologie und Dialyse, Kantonsspital Baden AG, Baden
Abkürzungen
BMI Body-Mass-Index
CKD Chronische Nierenkrankheit, engl. Chronic Kidney Disease
eGFR geschätzte glomeruläre Filtrationsrate
KDIGO Kidney Disease: Improving Global Outcomes
RAASi Inhibition des Renin-Angiotensin-Aldosteron-Systems
SGED Schweizerische Gesellschaft für Endokrinologie und Diabetologie
SGLT2i Natrium-Glucose-Cotransporter-2-Inhibitoren
SGN Schweizerische Gesellschaft für Nephrologie
UACR Albumin-Kreatinin-Ratio im Urin
Historie
Manuskript eingegangen: 09.07.2025
Angenommen nach Revision: 22.10.2025










