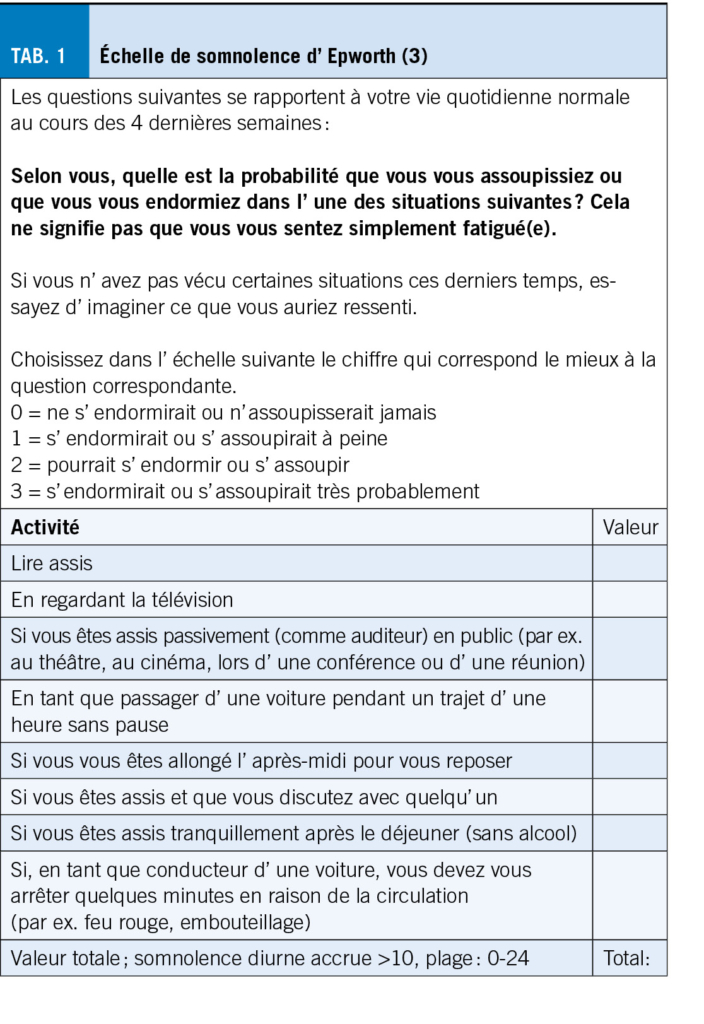
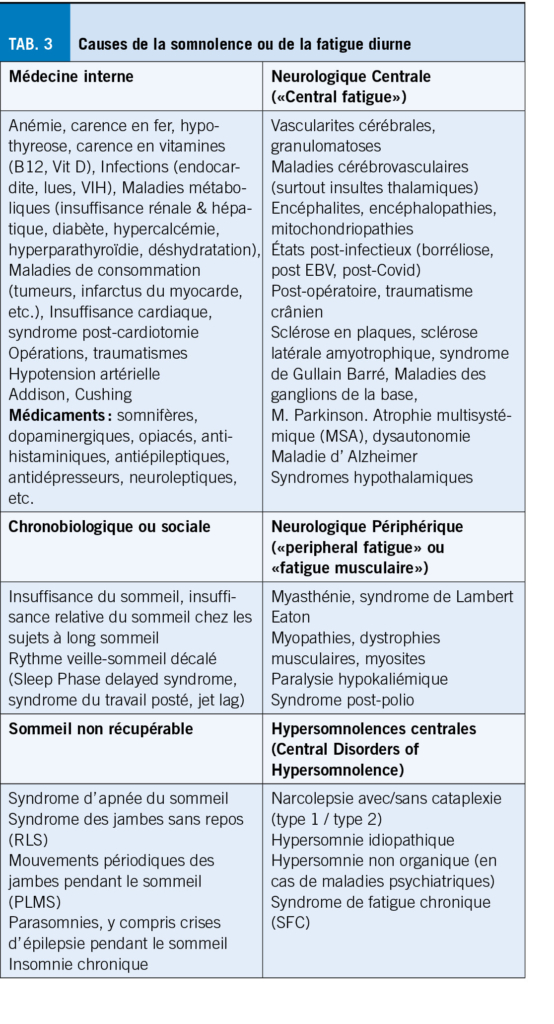
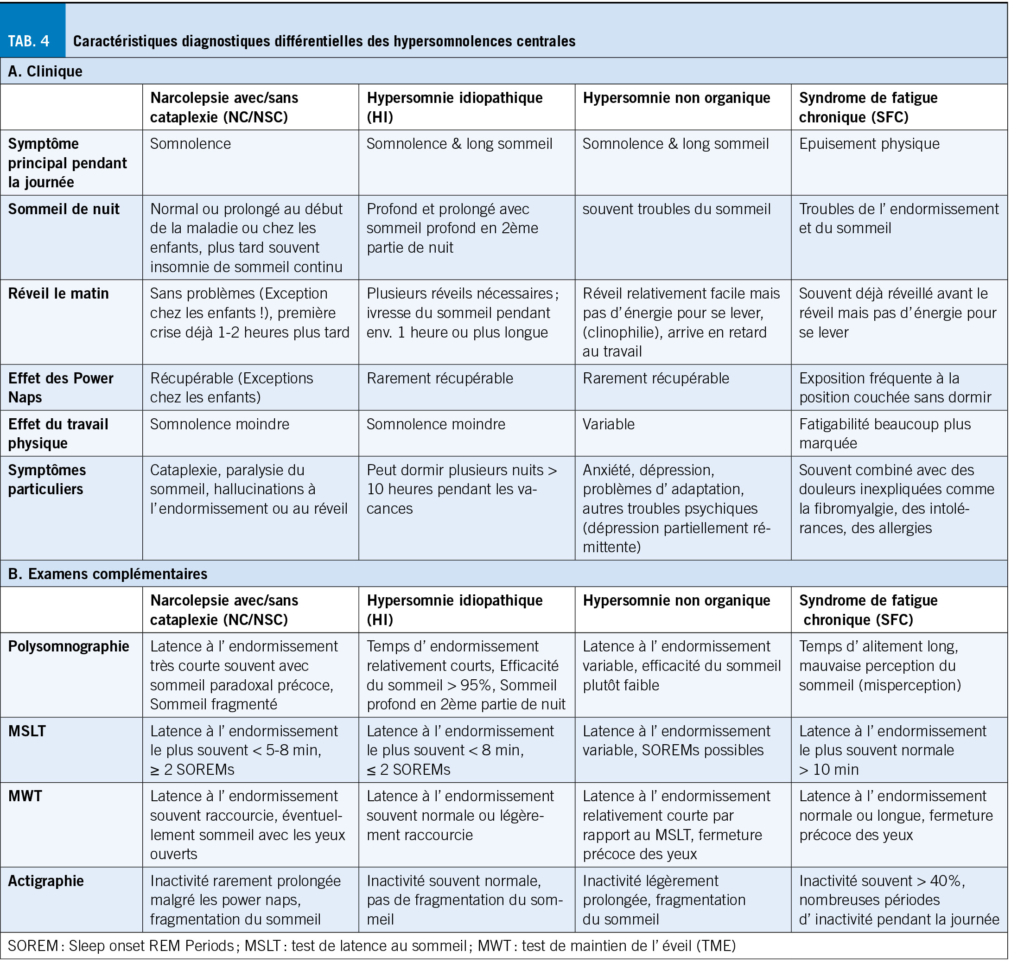
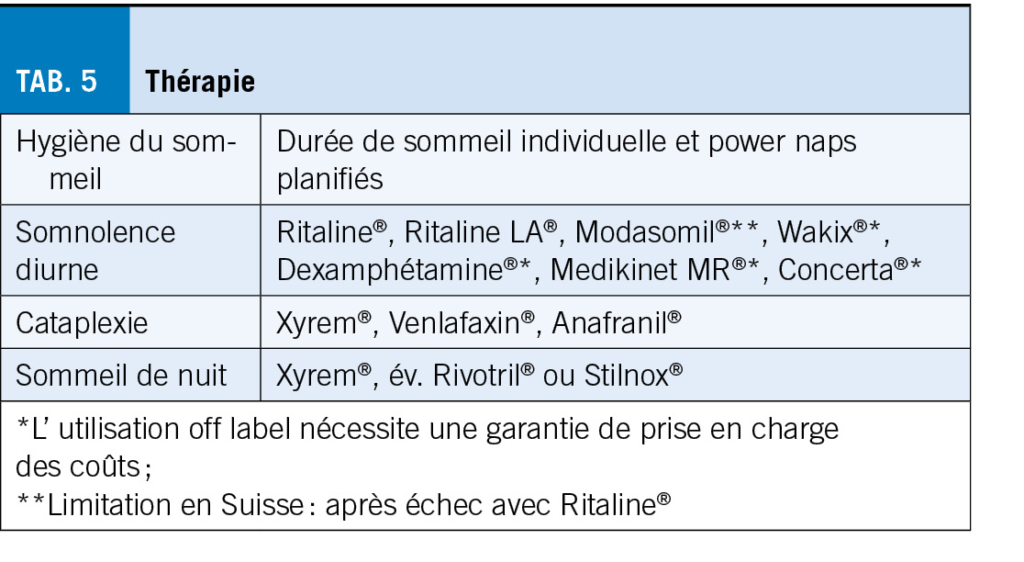
L’ arthrose entraîne des douleurs sévères, affectant la mobilité et la qualité de vie, surtout chez les plus de 55 ans, en particulier les femmes. La physiothérapie, axée sur le développement et la préservation des capacités fonctionnelles, est cruciale pour la gestion de la douleur arthrosique. Cet article explore les interventions physiques proposées en physiothérapie dans le cadre des douleurs liées à l’arthrose, mettant en évidence leur efficacité. La douleur est complexe et nécessite une approche individualisée. L’ exercice, incluant renforcement musculaire, endurance, souplesse et équilibre, offre des bénéfices certains. Un programme structuré adapté à l’ individu peut maximiser ces effets. A l’inverse, massages et électrostimulation ne sont pas recommandés. En conclusion, un mode de vie actif et des exercices adaptés jouent un rôle crucial dans la gestion de la douleur et l’ amélioration de la qualité de vie des personnes atteintes d’ arthrose.
Osteoarthritis causes severe pain, impacting mobility and quality of life, especially in those over 55, particularly women. Physiotherapy, focused on developing and preserving functional capacities, is crucial for managing arthritic pain. This article explores physical interventions, highlighting their effectiveness. The complex nature of pain requires an individualized approach. Exercise, including muscle strengthening, endurance, flexibility, and balance, provides benefits. A structured program tailored to the individual can maximize these effects. However, massages and electrostimulation are not recommended. In conclusion, an active lifestyle and tailored exercises play a crucial role in managing pain and improving the quality of life for people with osteoarthritis.
Introduction
L’ arthrose est une affection dégénérative des articulations. Elle touche l’ ensemble des articulations, y compris les tissus qui l’ entourent. Elle apparaît le plus souvent aux genoux (85%), aux hanches, à la colonne vertébrale et aux mains (1). Prévalente chez les personnes de plus de 55 ans (73%), elle touche davantage les femmes (60%) (1). L’ incidence de l’ arthrose du genou et de la hanche augmente constamment avec l’ âge pour les deux sexes, tandis que le risque d’ arthrose des mains atteint son pic autour de la ménopause chez les femmes (1).
Cette condition engendre des douleurs, des gonflements et des raideurs, entraînant une altération de la capacité d’ une personne à se déplacer librement (1). Parmi les symptômes, la douleur est souvent perçue comme le plus handicapant par les patients (2). L’ arthrose est invalidante et constitue une charge de santé considérable et croissante, avec des répercussions significatives sur les individus concernés en termes de handicap et de qualité de vie (2). En raison des effets cumulés du vieillissement de la population mondiale, de l’ augmentation de l’ obésité, de la multiplication des blessures articulaires et de l’ inactivité, ce syndrome déjà lourd prend une ampleur croissante (2).
La physiothérapie est une thérapie délivrée par des physiothérapeutes à des personnes et à des populations pour développer, préserver et restaurer un maximum de mouvements et de capacités fonctionnelles tout au long de la vie. La physiothérapie est indiquée lorsque le mouvement et la fonction sont menacés, par exemple par le vieillissement, une ou plusieurs blessures, ou encore des douleurs et diverses pathologies. (3).
Si la physiothérapie est traditionnellement prescrite dans le cadre de l’ arthrose et de ses douleurs, les patients se voient régulièrement proposer des traitements à l’ efficacité discutable. Cet article abordera les différentes mesures physiques pratiquées dans ce cadre, et leur efficacité.
La douleur
La douleur liée à l’ arthrose présente une importante hétérogénéité, variant d’ un individu à l’ autre et à différentes phases de la maladie. Cette complexité rend l’ évaluation de cette douleur particulièrement délicate. Traditionnellement, la douleur est considérée comme nociceptive, résultant d’ une charge anormale sur une articulation endommagée (4). Cependant, certains patients présentent un composant inflammatoire dans leur expérience douloureuse. Des recherches récentes indiquent également une prévalence significative de la douleur neuropathique chez les personnes souffrant d’ arthrose du genou ou de la hanche, atteignant 23% (4). Contrairement à la douleur nociceptive, déclenchée par des dommages réels aux tissus ou des stimuli potentiellement dommageables pour les tissus, la douleur neuropathique découle des lésions du système nerveux lui-même. Une meilleure compréhension de ces composants multifactoriels de la douleur liée à l’ arthrose est essentielle pour une meilleure prise en charge (4).
La douleur liée à l’ arthrose du genou est généralement intermittente et principalement liée au poids (mécanique) (2). Souvent, la douleur intermittente est prévisible, mais lorsqu’ elle devient plus intense, plus fréquente ou imprévisible, les patients la catégorisent plus souvent comme inacceptable. Le concept et la compréhension des crises, appelées “flare-ups”, évoluent et sont désormais considérés comme plus larges qu’ une simple exacerbation de la douleur (2). Contrairement aux idées reçues, les images traditionnelles par rayons X et IRM montrent seulement des associations modérées entre l’ arthrose structurelle et la présence de douleur chez les individus affectés (2).
Bien que l’ arthrose soit un défi médical important, un traitement modifiant la maladie n’ est pas encore disponible. Le traitement antalgique médicamenteux (paracétamol et AINS) reste le traitement de prédilection de la douleur (2). Les infiltrations restent réservées aux échecs médicamenteux par voie orale (2). Il convient de noter que la chirurgie est envisagée en dernier recours, soulignant ainsi l’ importance d’ explorer des options moins invasives avant de recourir à des interventions plus lourdes.
La Physiothérapie
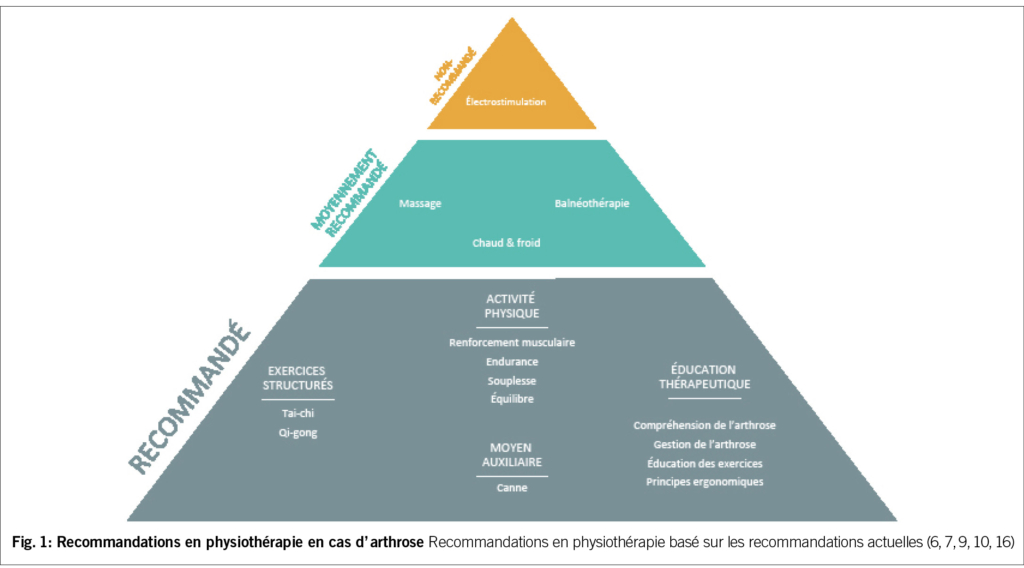
Le physiothérapeute dans la mise en place des mesures physiques doit absolument encourager le patient à ne pas souffrir. Une évaluation initiale complète permettra au thérapeute d’ établir un programme pertinent et efficace (5). Ci-dessous, nous identifions les interventions qui sont fortement recommandées, celles qui sont considérées comme moyennement efficaces, ainsi que celles qui ne sont pas recommandées (Fig. 1). Cette classification se base sur les résultats d’ études cliniques et les avancées scientifiques dans la prise en charge de l’ arthrose.
Les massages
La faible quantité de recherches menées sur la thérapie par massage pour l’ arthrose du genou suggère qu’ elle pourrait avoir des bienfaits à court terme pour soulager la douleur du genou. Mais d’une façon générale, ce type de traitement n’ est pas recommandé (6).
Le chaud et le froid
Ces interventions incluent les sources de chaleur et de froid directes et les sources de chaleur indirectes comme la diathermie ou encore les ultrasons. La variation des méthodes de mise en œuvre de ces interventions dans les études publiées, et la courte durée des bienfaits ont conduit à une recommandation conditionnelle (6).
La balnéothérapie
La balnéothérapie a été le nom donné à la technique de baignade dans de l’ eau minérale à des fins de santé ; elle incluait également des pratiques connexes telles que les enveloppements de boue. Bien que certaines études aient signalé que ce type de balnéothérapie pouvait réduire la douleur dans l’ arthrose, Le nombre des études de bonne qualité est trop limité pour parvenir à des conclusions définitives (7).
Toutefois, l’ exercice aquatique, qui implique la réalisation d’ exercices de renforcement musculaire et d’ endurance dans une piscine, a fait état d’ avantages significatifs en termes de réduction de la douleur et d’ amélioration de la fonction (8). Il est à noter que les exercices aquatiques présentent moins d’ effets indésirables, tels que l’ inconfort, en comparaison avec le groupe d’ exercices effectués sur terre (9). Cependant les améliorations de la douleur elle-même semblent comparables entre les deux groupes (9).
Aide de marche / moyens auxiliaires
L’ utilisation de cannes est fortement recommandée pour les patients atteints d’ arthrose du genou et/ou de la hanche chez qui la maladie affecte suffisamment la démarche, la stabilité articulaire, ou provoque suffisamment de douleur pour justifier l’ utilisation d’ un dispositif d’ assistance (6). L’utilisation de genouillères et/ou de talonnettes quant à elle reste controversée (10).
L’ Activité Physique (AP)
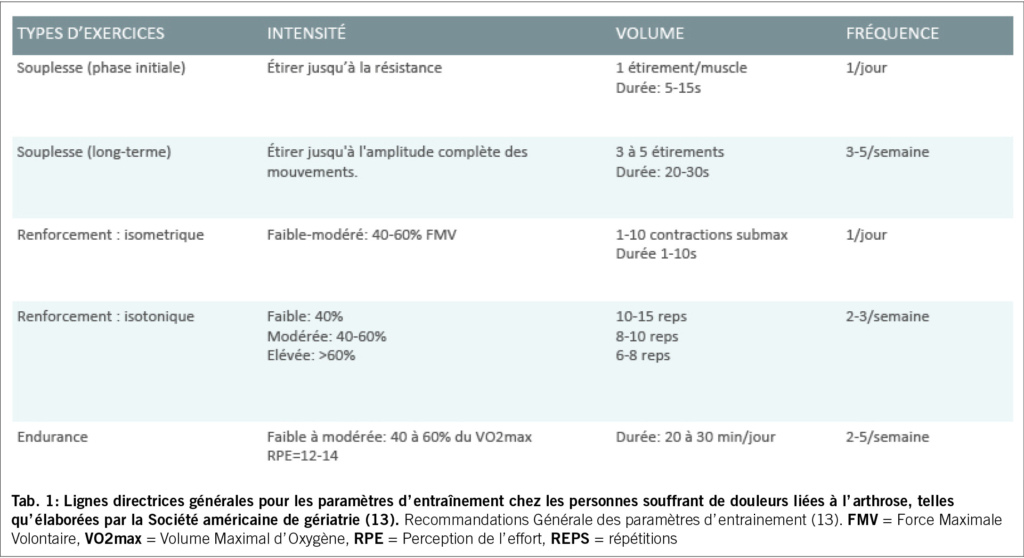
L’ exercice en général a démontré son efficacité sur la douleur (10). Il pourrait avoir différents mécanismes d’ action, outre l’ effet sur la douleur elle-même, comme l’ amélioration de la fonction en général, de la confiance, la diminution de la dépression et de l’ anxiété (11), l’ augmentation de l’ interaction sociale, l’ amélioration de la composition corporelle, ou encore l’ amélioration de la récupération du cartilage endommagé (12). Les composantes essentielles de tout programme d’ activité physique comprennent des exercices visant à améliorer la souplesse, la force et l’ endurance. Le tableau 1 présente des recommandations de base selon la Société Américaine de Gériatrie (13).
Souplesse
Bien que les étirements (stretching) ne s’ attaquent pas directement aux causes sous-jacentes de l’ arthrose, ils peuvent procurer un certain soulagement de la douleur et de l’ inconfort associés à la condition arthrosique. Des étirements doux peuvent aider à soulager la tension musculaire et favoriser la détente (10).
Renforcement musculaire
Les muscles jouent un rôle important dans la biomécanique articulaire car ils produisent le mouvement, absorbent les charges et assurent une stabilité articulaire dynamique. Cette implication dans le processus d’ adaptation et de dégénérescence articulaire lié à l’ arthrose met en évidence l’ importance de la fonction musculaire dans la prise en charge de cette pathologie (14).
Une approche ciblée est nécessaire dans l’ entraînement en force pour optimiser à la fois la protection articulaire et la fonction musculaire dans le contexte de l’ arthrose. Il a été montré que l’ entraînement en force facilite le soulagement de la douleur et renforce la capacité d’ absorption des chocs des muscles des membres inférieurs lors de la marche (11). Ces muscles, lorsqu’ ils sont utilisés en chaîne et exercés de manière statique, peuvent agir globalement comme des “amortisseurs” pour protéger une articulation lésée. À titre d’ exemple, les triceps, les quadriceps, les ischio-jambiers, les fessiers, les abdominaux et les dorsaux contribuent à la protection de la hanche. D’ autre part ces muscles sont importants pour la fonction et devraient être ciblés de manière particulière (15).
Endurance
L’ entraînement en endurance peut favoriser le métabolisme des tissus adipeux, prévenir l’ atrophie musculaire, accélérer la récupération du cartilage endommagé et réduire la douleur (12). Le type d’ exercice en endurance peut être varié et outre le renforcement spécifique, peut inclure des activités plus globales telles que la marche, le vélo (intérêt du travail sans la contrainte du poids corporel pour le genou et la hanche) ou l’ utilisation d’ un stepper assis, en fonction de ce qui est le plus confortable et réalisable pour le patient (15). Selon plusieurs essais cliniques, l’ entraînement en force et en endurance est également recommandé pour les patients atteints d’ arthrose du genou (9).
Equilibre
L’ entraînement à l’ équilibre s’ est avéré efficace pour l’ arthrose du genou en améliorant la mobilité et en réduisant la douleur ainsi que le risque de chutes. Généralement ce travail est intégré à un programme d’ entrainement structuré ; le lien direct entre ce travail et la douleur n’ est pas encore clairement établi (6).
Exercices physiques structurés
Des programmes globaux ont montré des résultats positifs dans le soulagement des symptômes de l’ arthrose, dont la douleur. Un exemple notable est le programme GLA:D® (Good Life with osteoArthritis in Denmark), lancé au Danemark en 2013 et en Suisse en 2019, et spécialement conçu pour les personnes souffrant d’ arthrose au niveau des genoux ou des hanches (16). L’ objectif du programme GLA:D® Suisse est de mettre en œuvre les recommandations internationales de bonnes pratiques, tout en assurant un contrôle qualité rigoureux (17). Le programme combine sur plusieurs semaines des conseils, des instructions, et des exercices neuromusculaires.
D’ autre part, des séances de marche, trois fois par semaine pendant 3 mois, accompagnées d’ un suivi d’ un programme de marche à domicile sur une période de 15 mois, ont également présenté des avantages significatifs en termes de soulagement de la douleur et d’ amélioration de la fonction (9).
La participation à des activités telles que le tai-chi, comparativement à d’ autres exercices mixtes, semble offrir des améliorations plus significatives en matière de douleur liée à l’ arthrose du genou. En effet, le tai-chi démontre la capacité d’ améliorer non seulement la douleur mais aussi la raideur, le renforcement musculaire et la fonction articulaire chez les individus souffrant d’ arthrose du genou (8). Bien que le qi gong et le yoga puissent présenter des avantages similaires, des recherches plus approfondies sont nécessaires pour explorer spécifiquement les bienfaits en termes de soulagement de la douleur (8, 15).
Pour obtenir des améliorations optimales des symptômes et de la fonction, l’ utilisation d’ un programme de séances de traitement par l’ exercice, à la fois individualisées et en groupe, supervisées par un praticien spécialisé comme un physiothérapeute, suivies d’ un programme à domicile, s’ avère essentielle (15). Les programmes qui incluent aussi de l’ éducation thérapeutique, et/ou de l’ aide à la perte de poids semblent également efficaces dans la diminution de la douleur ainsi que l’ augmentation de la fonction pour l’ arthrose du genou et de la hanche (12, 18, 19).
Il n’ est pas rare que les patients ressentent une certaine gêne au niveau de l’ articulation affectée pendant l’ exercice; c’ est normal et ça ne signifie pas une détérioration de leur maladie arthrosique. Le port de chaussures appropriées, un échauffement et un arrêt progressif de l’activité adéquats, une technique d’ exercice correcte et des augmentations progressives de la dose peuvent éviter ou limiter ces symptômes (15). Des augmentations substantielles de la douleur et/ou du gonflement pendant ou après l’ exercice et qui persistent pendant plusieurs heures, peuvent suggérer que des modifications du programme d’ exercices sont nécessaires.
L’ exercice est sûr et bien toléré par la plupart des personnes atteintes d’ arthrose des membres inférieurs, même à un stade avancé, et il y a peu de contre-indications à l’ exercice résultant de l’ arthrose en soi, bien que les comorbidités doivent être prises en compte (15).
Copyright Aerzteverlag medinfo AG
Centre hospitalier universitaire vaudois (CHUV)
Av. de Beaumont 21 bis
1011 Lausanne
debora.verbelen@chuv.ch
Centre hospitalier universitaire vaudois (CHUV)
Av. de Beaumont 21 bis
1011 Lausanne
michelle.lovell-rod@chuv.ch
Centre hospitalier universitaire vaudois (CHUV)
Av. de Beaumont 21bis
1011 Lausanne
laurence.vignaux@chuv.ch
Les auteurs n’ ont pas déclaré de conflits d’ intérêts en rapport avec cet article.
1. Organization WH. Arthrose2023 5.1.2024 29.1.2024]. Available from: https://www.who.int/fr/news-room/fact-sheets/detail/osteoarthritis.
2. Hunter DJ, Bierma-Zeinstra S. Osteoarthritis. Lancet. 2019;393(10182):1745-59.
3. Therapy WCfP. Description of physical therapy: Policy statement2019 [cited 2019. Available from: https://world.physio/sites/default/files/2020-07/PS-2019-Description-of-physical-therapy.pdf.
4. Fu K, Robbins SR, McDougall JJ. Osteoarthritis: the genesis of pain. Rheumatology (Oxford). 2018;57(suppl_4):iv43-iv50.
5. van Baar ME, Dekker J, Oostendorp RA, Bijl D, Voorn TB, Bijlsma JW. Effectiveness of exercise in patients with osteoarthritis of hip or knee: nine months’ follow up. Ann Rheum Dis. 2001;60(12):1123-30.
6. Kolasinski SL, Neogi T, Hochberg MC, Oatis C, Guyatt G, Block J, et al. 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee. Arthritis Care Res (Hoboken). 2020;72(2):149-62.
7. Protano C, Fontana M, De Giorgi A, Marotta D, Cocomello N, Crucianelli S, et al. Balneotherapy for osteoarthritis: a systematic review. Rheumatol Int. 2023;43(9):1597-610.
8. Bannuru RR, Osani MC, Vaysbrot EE, Arden NK, Bennell K, Bierma-Zeinstra SMA, et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthritis Cartilage. 2019;27(11):1578-89.
9. Golightly YM, Allen KD, Caine DJ. A comprehensive review of the effectiveness of different exercise programs for patients with osteoarthritis. Phys Sportsmed. 2012;40(4):52-65.
10. Hurley M, Dickson K, Hallett R, Grant R, Hauari H, Walsh N, et al. Exercise interventions and patient beliefs for people with hip, knee or hip and knee osteoarthritis: a mixed methods review. Cochrane Database Syst Rev. 2018;4(4):Cd010842.
11. Tarantino D, Theysmans T, Mottola R, Verbrugghe J. High-Intensity Training for Knee Osteoarthritis: A Narrative Review. Sports (Basel). 2023;11(4).
12. Zeng CY, Zhang ZR, Tang ZM, Hua FZ. Benefits and Mechanisms of Exercise Training for Knee Osteoarthritis. Front Physiol. 2021;12:794062.
13. Exercise prescription for older adults with osteoarthritis pain: consensus practice recommendations. A supplement to the AGS Clinical Practice Guidelines on the management of chronic pain in older adults. J Am Geriatr Soc. 2001;49(6):808-23.
14. Valderrabano V, Steiger C. Treatment and Prevention of Osteoarthritis through Exercise and Sports. J Aging Res. 2010;2011:374653.
15. Bennell KL, Hinman RS. A review of the clinical evidence for exercise in osteoarthritis of the hip and knee. J Sci Med Sport. 2011;14(1):4-9.
16. Available from: www.glaid.dk.
17. [30.1.2024]. Available from: https://gladsuisse.ch/arthrose/.
18. Sinatti P, Sánchez Romero EA, Martínez-Pozas O, Villafañe JH. Effects of Patient Education on Pain and Function and Its Impact on Conservative Treatment in Elderly Patients with Pain Related to Hip and Knee Osteoarthritis: A Systematic Review. Int J Environ Res Public Health. 2022;19(10).
19. Robson EK, Hodder RK, Kamper SJ, O’ Brien KM, Williams A, Lee H, et al. Effectiveness of Weight-Loss Interventions for Reducing Pain and Disability in People With Common Musculoskeletal Disorders: A Systematic Review With Meta-Analysis. wJ Orthop Sports Phys Ther. 2020;50(6):319-33.