Der noch junge Bereich der Kardio-Onkologie hat über die letzten Jahre enorme Fortschritte gemacht. Die Verbesserung onkologischer und hämatoonkologischer Therapien mit einer grösser werdenden Anzahl von Langzeitüberlebenden und das wachsende Bewusstsein für Krebstherapiebedingte kardiovaskuläre Nebenwirkungen mit kurz- und langfristig überhöhter kardiovaskulärer Morbidität und Mortalität waren Basis für die ersten Leitlinien der Europäischen Gesellschaft für Kardiologie (European Society of Cardiology; ESC) zum Thema Kardio-Onkologie 2022 (1). Mehr als ein Jahr nach der Veröffentlichung möchten wir einen Überblick geben über die ersten Erfahrungen mit den Leitlinien im klinischen Alltag sowie einen Ausblick für die zukünftige Kardio-Onkologie.
During the past years, the still young field of Cardio-Oncology has made enormous progress. The increasing number of long-term cancer survivors due to improved oncological therapies as well as the growing awareness of cancer-therapy-related cardiovascular side effects and the excess cardiovascular morbidity and mortality in this patient segment formed the basis for the first international guidelines on Cardio-Oncology from the European Society of Cardiology (ESC) (1). More than a year after publication of these guidelines in 2022 we would like to reflect on the first experiences in everyday clinical practice and provide an outlook into the future of Cardio-Oncology.
Key Words: cardio-oncology, ESC Guideline, adverse cardiovascular events, risk assessment, primary and secondary prevention
Einführung
Krebserkrankte weisen eine erhöhte kardiovaskuläre Morbidität und Mortalität auf. Gemeinsame Risikofaktoren sowie Folgen potentiell kardiotoxischer Therapien gehören dabei zu den Hauptursachen. Die modernen und verbesserten Behandlungsoptionen auf dem Gebiet der Onkologie mit zunehmender Überlebenszeit nach der Krebsdiagnose rücken die kardiale Sicherheit für diese Patienten immer mehr in den Vordergrund. Umgekehrt zeigen Patienten mit kardiovaskulären Erkrankungen wie z.B. Herzinsuffizienz (2), Myokardinfarkt (3) oder reduzierter kardiovaskulärer Fitness (4) ein erhöhtes Risiko für die Entwicklung eines Krebsleidens. Die Schnittstellen sind multipel und vielfach nicht komplett verstanden.
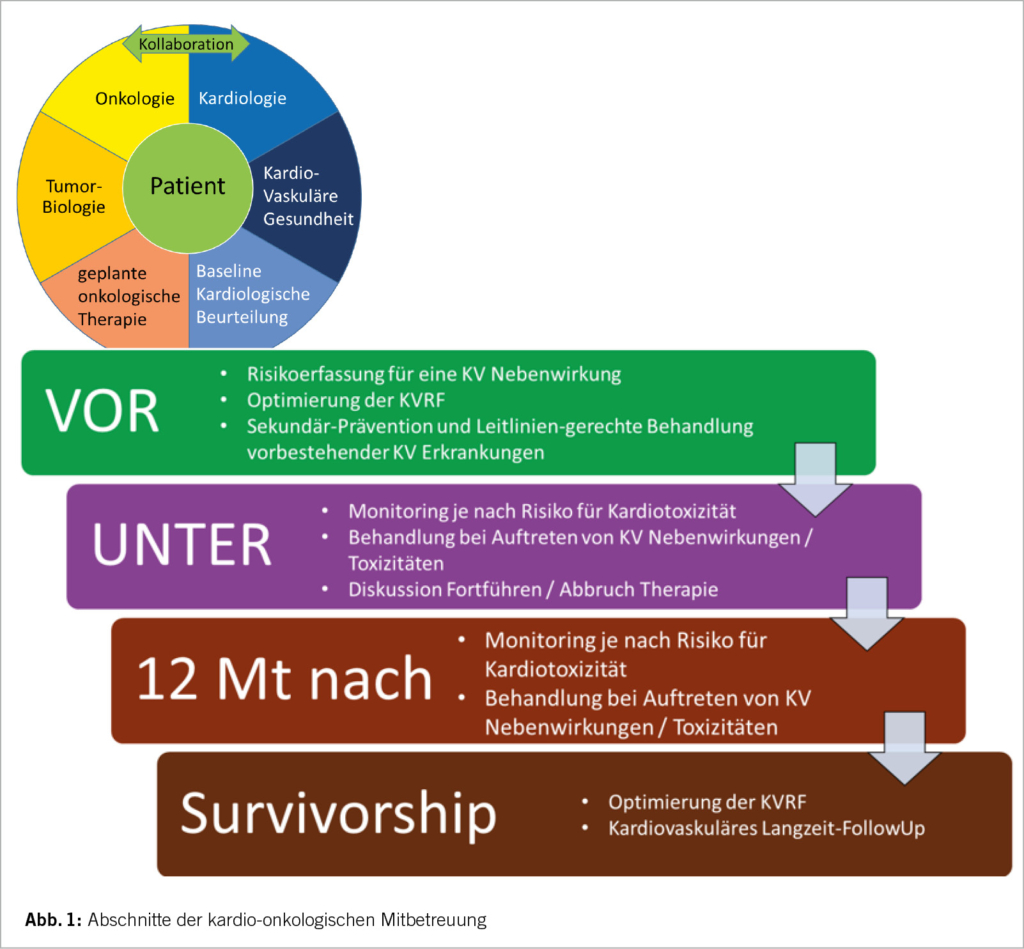
Diese Beobachtungen bildeten die Basis für eine allgemeingültige, frühe und aggressive kardiovaskuläre Risikostratifizierung und Versorgung von Krebspatienten. Am ESC-Kongress in Barcelona 2022 wurden die neuen und ersten internationalen Guidelines für Kardio-Onkologie vorgestellt. Ein wichtiger und grundlegender Gedankenansatz dieser Leitlinien ist, dass es sich beim kardiovaskulären Risiko onkologischer Patienten um eine kontinuierliche Variable handelt, die sich über den gesamten onkologischen Behandlungsverlauf und darüber hinaus verändern kann. Ziel der Leitlinien ist es im Sinne eines proaktiven Ansatzes, das medizinisch-behandelnde Team von onkologischen Patienten vor, während und nach der Krebsbehandlung zu unterstützen, um kardiovaskuläre Nebenwirkungen optimalerweise zu verhindern oder zu minimieren (Abb. 1). Über 272 Empfehlungen sowie zahlreiche Strategien zur frühzeitigen Detektion und kardioprotektiven Behandlung werden uns an die Hand gegeben, fast 60% davon sind sogar als Klasse I-Empfehlungen formuliert. Allerdings gilt zu beachten, dass gross angelegte, randomisierte klinische Studien für das kardio-onkologische Patientenkollektiv weitgehend fehlen. Somit sind nur 3% der Empfehlungen mit dem Evidenzgrad (LOE) A versehen, und die meisten Empfehlungen basieren auf einem Experten-Konsensus oder kleineren Studien (LOE C: 76%). Nichtsdestotrotz liefern die Leitlinien mit Schaubildern und Algorithmen ein wertvolles, sehr ausführliches Nachschlagewerk. Über ein Jahr nach der Veröffentlichung dieser Guidelines ziehen wir eine kurze Bilanz bezüglich deren Anwendbarkeit im klinischen Alltag.
Wichtigste Punkte der Guidelines
Harmonisierung des Begriffs Kardiotoxizität
In der Vergangenheit bezog sich der Begriff «Kardiotoxizität» (Cancer Therapy-Related Cardiovascular Toxicity, CTR-CVT) vorwiegend auf eine myokardiale Dysfunktion und Herzinsuffizienz. In der ESC-Leitlinie wird – auf Grundlage der Definitionen der International Cardio-Oncology Society (IC-OS) (5) – betont, dass die CTR-CVT ein sehr breites Spektrum an kardiovaskulären Störungen umfasst, einschliesslich der koronaren Herzkrankheit, Herzklappenerkrankungen, Herzrhythmusstörungen, Perikarderkrankungen, autonomer Dysfunktion sowie systemischer und pulmonaler Hypertonie. Neu definiert, mit klaren Kriterien, wurde die myokardiale Dysfunktion basierend auf der Abnahme der linksventrikulären Ejektionsfraktion (LVEF) und dem globalen longitudinalen Strain (GLS) sowie des Anstiegs kardialer Biomarker. Diese universelle Definition der Kardiotoxizität sowie deren Schweregrades ist grundlegend, um im klinischen Alltag im gesamten Behandlungsteam von Krebspatienten eine gemeinsame Sprache zu sprechen. Schliesslich ist nicht selten die zentrale Frage bezüglich der onkologischen Therapie hiermit verknüpft: Abbrechen, unterbrechen oder weitermachen?
In der Onkologie wird aktuell die 6. Version der Common Terminology Criteria of Adverse Events (CTCAE) erwartet. Die Übernahme der Kardiotoxizitäts-Kriterien aus der ESC-Leitlinie ist zu erhoffen, da mit den Definitionen der CTCAE ebenfalls erhebliche praktische Auswirkungen für den Praxis- und Klinikalltag verbunden sind. Auch die Vergleichbarkeit in Studien- und Register-Daten wird erst durch eine breite Vereinheitlichung der Definitionen ermöglicht, was die Evidenzlage für zukünftige Empfehlungen in der Kardio-Onkologie qualitativ stark verbessern würde.
Baseline-Risk-Assessment vor Therapiebeginn
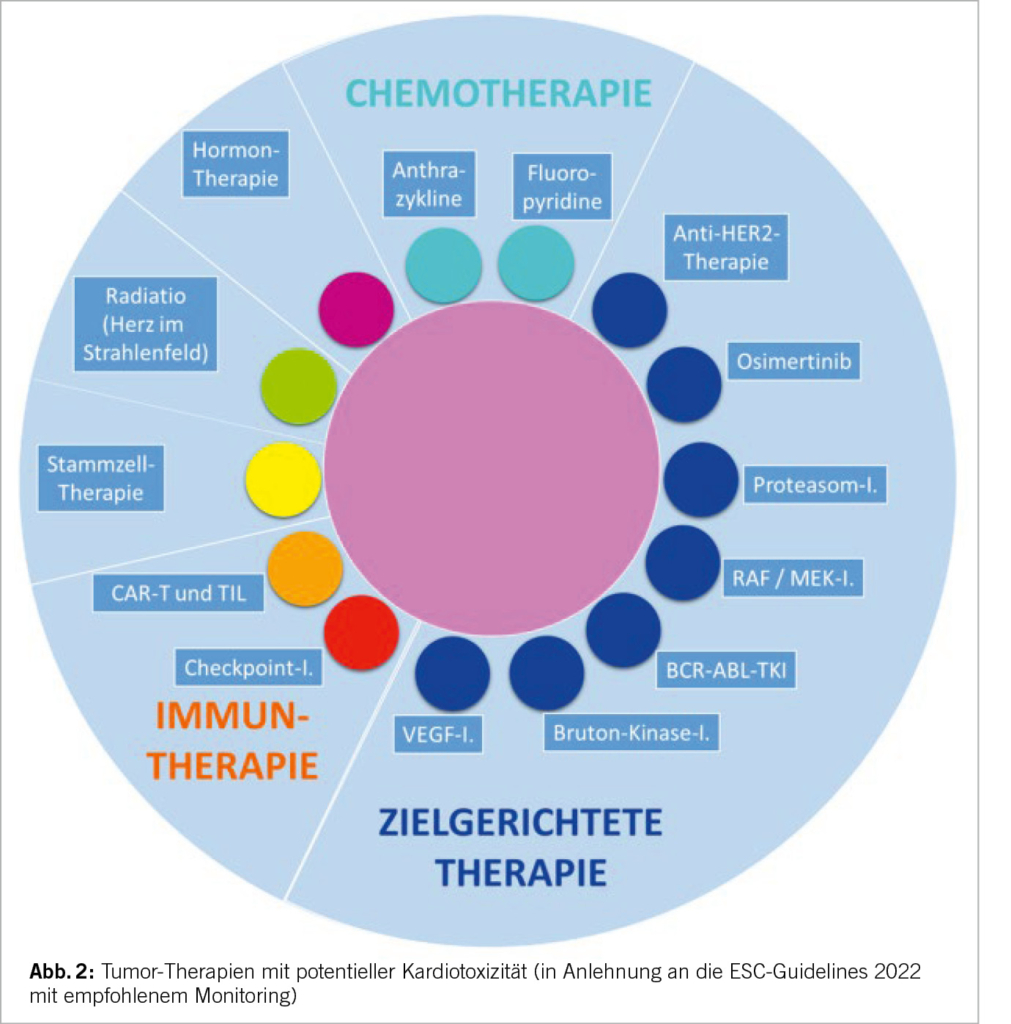
Ein wichtiger Input der Leitlinie ist die standardisierte Risikostratifizierung onkologischer Patienten noch vor Beginn der onkologischen Therapie. Denn erhält ein Patient die Diagnose «Krebs» ist eine Schlüsselfrage, wie ein Patient mit einem erhöhten Risiko für kardiovaskuläre Toxizität identifiziert werden kann. Hier empfehlen die neuen Kardio-Onkologie-Leitlinien für 13 verschiedene Krebs
behandlungen (hierunter Chemotherapien, molekulare Therapien, Immuntherapien, hämatopoetische Stammzelltransplantation, Strahlentherapie u.a.) sowie im Fall einer Hormontherapie ein Baseline Risiko-Assessment als Basis für das weitere Monitoring und präventive Massnahmen (Abb. 2).
Einige Prädiktoren für kardiale Toxizität sind bekannt, wie z.B. Alter, Bluthochdruck, Diabetes, eine vorbestehend reduzierte systolische linksventrikuläre Funktion oder auch eine zurückliegende Anthrazyklin-haltige Therapie. Die Autoren der Guidelines verweisen zur einheitlichen Risikobewertung auf den Risiko-Kalkulator der Heart Failure Association (HFA) der ESC und der IC-OS (6). Dieser berücksichtigt Patienten-bedingte Faktoren wie kardiovaskuläre Risikofaktoren (KVRF), kardiovaskuläre Vorerkrankungen, EKG, Bildgebung, kardiale Biomarker sowie die onkologische Therapie. Je nach Resultat (niedriges, mittleres oder hohes/sehr hohes Risiko) werden in Folge Art und Umfang verschiedener Präventions- und Überwachungsstrategien empfohlen. Die ESC-Online-App ist mit dem interaktiven Risiko-Assessment Tool ein sehr geeignetes Hilfsmittel für die Risikostratifizierung im klinischen Alltag (https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/Guidelines-derivative-products/ESC-Mobile-Pocket-Guidelines).
Allerdings birgt das Baseline-Risiko-Assessment mehrere Hürden. Das vorgeschlagene Risiko-Assessment ist nie für diesen Zweck vollumfänglich validiert worden. Die tatsächliche Leistung und klinische Anwendbarkeit im Alltag sind jedoch zumindest für einige Patienten-Subgruppen gezeigt worden, so z.B. für Patienten mit geplanter Anthrazyklin-basierter Therapie (7) oder mit chronisch myeloischer Leukämie (CML) vor Tyrosin-Kinase-Inhibitor Therapie (8). Auch die Implementierung des Baseline Risk-Assessment in den Praxisalltag scheint erschwert. Denn es stellt sich in erster Linie die Frage, wer eigentlich für diese Risiko-Bewertung zuständig ist. Der kardiologische Fachkollege eher nicht; diese(r) wird in der Regel erst beigezogen, wenn bei einem Patienten bereits ein erhöhtes Risiko identifiziert worden ist. Im Gegenzug hat das onkologische Behandlungsteam kaum detaillierte Kenntnisse der Kardio-Onkologischen Guidelines der ESC und auch der Hausarzt rückt in der Phase einer neu diagnostizierten Tumorerkrankung zumindest passager in den Hintergrund. Ein weiteres Problem stellt der Zeitfaktor dar. Auch mit der besten Triage im kardiologischen Praxisalltag kommt es zu Wartezeiten und es ist kaum sinnvoll, auf die komplettierte Risikostratifizierung zu warten, bevor grünes Licht für den Therapiestart gegeben wird.
Primär-Prävention
Die Primär-Prävention beschäftigt sich mit der Frage, ob und wie Kardiotoxizität verhindert oder minimiert werden kann. Frühe Studien auf diesem Gebiet liessen einen Nutzen für die Herzfunktion durch den Einsatz von ACE-Hemmern (ACEI) und Betablockern (BB) erahnen. Neuere randomisierte Studien konnten jedoch nur eine geringe oder gar keine Wirkung neurohormonaler Inhibitoren in der Primär-Prävention zeigen. So fiel auch eine grosse Metaanalyse von 17 Studien wenig überwältigend aus (9). Zwar war die LVEF leicht höher unter der kardioprotektiven Therapie, die Resultate aber waren sehr heterogen, mit wenig absolutem Unterschied der LVEF. Ähnlich fiel das Ergebnis der Themen-gleichen Metaanalyse in der grossen Gruppe der Patientinnen mit Brustkrebs aus (10). Einschränkend muss bei der Interpretation dieser Studien jedoch berücksichtigt werden, dass die häufig kleine Patientenzahl und vor allem die sehr heterogene, meist jüngere und somit potentiell gesündere Studienpopulation als im real-world Setting möglicherweise zu falsch negativen oder unterschätzten Resultaten führen.
Somit müssen wir noch besser verstehen, welche Patienten von einer primär-präventiven Therapie profitieren. Dies gilt nicht nur für den Einsatz neurohormonaler Inhibitoren wie ACEI oder Angiotensin Rezeptor Blocker (ARB) und BB. Es existieren auch primär-präventive Studien mit Statinen. Während die PREVENT-Studie (11) bei vorwiegend Brustkrebspatientinnen keinen Schutzeffekt ergab, zeigte sich in der STOP-CA-Studie (12) für die prophylaktische Statin-Behandlung ein signifikanter Benefit mit einem deutlich niedrigeren Risiko für das Auftreten einer LV-Dysfunktion bei LymphomPatienten. Diese diskrepanten Resultate der beiden Studien implizieren, dass eine solche Strategie möglicherweise nur bei Hoch-Risiko-Patienten sinnvoll ist und veranschaulichen, dass künftige Studien mit gut durchdachtem Design in möglichst homogenen Patientenpopulationen für die Gewinnung weiterer Erkenntnisse notwendig sind.
Aktuell erlauben die existierenden klinischen Studien keine allgemeingültige Empfehlung einer breiten Verabreichung einer primär-präventiven kardioprotektiven Pharmakotherapie. Vielmehr sollte diese auf der Risikobewertung des einzelnen Patienten basieren und v.a. bei Hoch-Risiko-Patienten eingesetzt werden. Konsens besteht darin: um eine wirksame Krebsbehandlung mit wenig unnötigen Unterbrüchen zu ermöglichen, sollten bereits bestehende kardiovaskuläre Herz-Kreislauf-Probleme unbedingt angemessen behandelt sein. Aus dem Praxisalltag wissen wir um die hohe Prävalenz kardiovaskulärer Erkrankungen und Risikofaktoren. Wenn man genauer hinschaut, bestehen auch häufig entsprechende medikamentöse Therapien bei Patienten mit onkologischer Erkrankung, allerdings sind KVRF in dieser Patientenpopulation grossteils nicht suffizient kontrolliert (13).
Monitoring während der Therapie
Zur Vermeidung von kardiovaskulären Problemen, bzw. Kardiotoxizität bei Patienten unter onkologischer Therapie wird in der ESC-Leitlinie eine Überwachung generell empfohlen. Wie zu vielen anderen fachspezifischen Risiko-Fragen wird zur Diagnostik subklinischer Auffälligkeiten der multimodale Ansatz verfolgt, also die Kombination aus Kontrolle der Vitalparameter, EKG, Echo oder MRT und kardialen Biomarkern. So finden sich zu 13 verschiedenen potentiell kardiotoxischen Therapien in den Guidelines übersichtliche Surveillance-Pläne. Je nach Ausgangsrisiko der Kardiotoxizität sind die Empfehlungen häufiger oder eben weniger häufiger Kontrollen aufgeführt. Diese Surveillance-Protokolle klingen zwar plausibel, sind im klinischen Alltag jedoch nicht einfach umzusetzen, wenn man der Ressourcen-Knappheit und Kosteneffizienz Rechnung tragen soll (14,15). Eine jeweilige Priorisierung scheint im Gesamtkontext unumgänglich.
Jede Methode zur Überwachung der Herzgesundheit hat ihre Stärken und Limitationen. Dies ist auch bei der Echokardiographie der Fall. Von der Arbeitsgruppe um P. Thavendiranathan (16) wurde gezeigt, dass die biplane LVEF-Bestimmung nach Simpson – wenn es um die frühe Detektion einer LV-Dysfunktion geht – ungenügend ist, weil sie erst grössere LVEF-Abnahmen valide feststellen kann und eine erhebliche Variabilität aufweist. Im Methodenvergleich hat die 3D-Methode am besten abgeschnitten, mit der kleinsten Variabilität von 6% gegenüber >10% der 2D-Analyse. Seit längerem wissen wir, dass bei der Überwachung der kardialen Funktion die Bestimmung des globalen longitudinalen Strain (GLS) helfen kann. Eine Veränderung des GLS kann der Abnahme der LVEF vorausgehen. Der Rückgang um 15% vom Ausgangswert wird als signifikant angesehen und deshalb wurde dieser Parameter in die ESC-Leitlinien aufgenommen. Aber wie steht es eigentlich um die Verfügbarkeit der empfohlenen Untersuchungen wie 3D Echo und Strain-Analyse? Nicht überall gehören sie in kleineren Spitälern oder kardiologischen Praxen zur Routine-Diagnostik.
Viele Fragen aus dem praktischen Alltag sind hier nicht geklärt und neue Fragen kommen auf. Für eine Brustkrebspatientin unter Her2-gerichteter Therapie gilt es z.B. 6 Echokardiographien zu planen, dies sogar unabhängig des Kardiotoxizitäts-Risikos (Klasse I). Mit der Einführung von Trastuzumab 2005 (erst bei metastasierten, dann auch im adjuvanten Setting) sah man zum Teil schwere Formen von kardialer Dysfunktion, wie man sie bis anhin nur von Anthrazyklinen kannte; und zwar in hohem Masse von fast 20% (17) bei gleichzeitiger Gabe von Anthrazyklinen und ca. 4-12% bei sequenzieller Gabe mit Anthrazyklinen (18). Mittlerweile kommen bei den Her2-positiven Mamma-Karzinom-Patientinnen mehr und mehr Anthrayzyklin-freie Therapie-Schemata zum Einsatz. Für die neueren Anti-Her2-Therapien (Antikörper-Wirkstoff-Konjugate, bzw. Tyrosinkinase-Hemmer gegen Her2) zeigte sich in den Studien ein deutlich geringeres Kardiotoxizitätsrisiko mit <1% (z.B. DESTINY-Studien, u.a. nachzulesen in (19)). Für solche und andere Fragen wird das wachsende Interesse an neuen Parametern zur Identifizierung von Patienten mit erhöhtem Risiko einer «cancer therapy-related cardiac dysfunction» (CTRCD) klar.
Management im Fall einer Kardiotoxizität und Permissive Kardiotoxizität
Der «gesunde Menschenverstand» sagt, dass es eine gute Idee ist, die Patientengruppe mit onkologischer Erkrankung speziell zu überwachen. Über die frühe Detektion eines kardialen Problems hinaus stellt sich dann aber die Frage nach der «korrekten» Therapie. Wie sollen wir mit subklinischen Befunden und «geringeren Auffälligkeiten» wie z.B. einem asymptomatischen leichtgradigen Troponin-Anstieg umgehen? Sorge muss hier getragen werden, dass sich daraus nicht eine Über-Diagnostik oder Behandlungsodyssee ergeben. Denn es ist unklar, ob niederschwellig zu diagnostizieren und kardioprotektiv zu behandeln das Outcome tatsächlich verbessern. Aktuell fehlen hierzu die wissenschaftlich fundierten Daten. Und zu berücksichtigen gilt auch: nicht jedes Herzproblem, das unter Krebstherapie auftritt, ist der Behandlung oder der Tumor-erkrankung geschuldet.
Allerdings wissen wir, dass, wenn es Hinweise auf eine Kardiotoxiztiät oder LV-Dysfunktion unter Anthrazyklin-Therapie gibt, es Sinn macht, zeitnah zu handeln, um einen grösseren Myokardschaden zu verhindern und die Responder-Rate möglichst hochzuhalten (20, 21). Nachdem der 2D-GLS des linken Ventrikels mit robusten Daten bereits subklinische Myokardschäden entdecken und eine zukünftige CTRCD vorhersagen kann (22, 23), wurden die Ergebnisse des Succour-Trial gespannt erwartet (24). In dieser prospektiven randomisiert-kontrollierten Studie gab es 2 Studien-Arme zur Einleitung einer kardioprotektiven Therapie bei Patienten unter Anthrazyklin-haltiger Therapie. Es wurde ein GLS-basiertes Patienten-Management verglichen mit dem herkömmlichen LVEF-basierten Vorgehen. Je nach Resultaten im Echo-Monitoring erhielten die Patienten einen ACEI und BB. Man erhoffte sich, dass der früh-präventive Einsatz einer neurohumoralen Blockade ein besseres Outcome zeigt. Fast enttäuschend war jedoch das Resultat. Es ergab sich kein signifikanter Unterschied in den Patienten-Gruppen bezüglich LVEF-Veränderung und / oder Auftreten einer CTRCD. Bei der Nachbeobachtung kam es leider im Rahmen der Covid-Pandemie zu erheblichen Verlusten von Studienteilnehmern. Arco Teske, ein Kardiologe aus Utrecht, brachte die Resultate folgendermassen auf den Punkt: «Global longitudinal strain in cardio-oncology: worth our trouble or more trouble than it’s worth?» (25), unterstreicht jedoch in seinem Statement, dass der GLS unbedingt auch zukünftig als ein solider Parameter für die Risikostratifizierung Bedeutung hat. Inwieweit der GLS zur Steuerung einer kardioprotektiven Therapie hilft, muss jedoch weiter untersucht werden.
In Anlehnung an die jeweiligen ESC-Guidelines offerieren die Cardio-Oncology Guidelines im Falle einer Kardiotoxizät kompakt aufgeführte Behandlungsvorschläge. Obwohl für all diese Krankheits-Entitäten bereits Guidelines bestehen, die zwar nicht für kardio-onkologische Patienten validiert sind, macht dieser fokussierte Blick durch die kardio-onkologische Brille dennoch Sinn. So wird z.B. für einen Patienten, der unter Ibrutinib ein symptomatisches Vorhofflimmern entwickelt, aufgrund der hohen Vorhofflimmer-Rezidiv-Rate und möglicher medikamentöser Interaktionen eher ein primär Herzfrequenz-kontrollierender Ansatz in Betracht gezogen und die Form der Antikoagulation muss aufgrund des erhöhten Blutungsrisikos Patienten-individuell geprüft werden. Die in den Guidelines aufgeführten Algorithmen und decision trees können im klinischen Alltag helfen. Die Leitlinien beschäftigen sich auch mit der Frage, bei welchem Patienten die Tumortherapie fortgeführt werden kann und bei wem diese pausiert oder gar komplett gestoppt werden muss. In enger Kooperation von Onkologen, Kardiologen und Hausärzten soll dies jeweils interdisziplinär diskutiert und entschieden werden.
Neu ist in diesem Zusammenhang das Konzept der «Permissiven Kardiotoxizität» 2022 formuliert worden (26). Es steht für eine Strategie, unter der es möglich ist, eine optimale lebensrettende Krebstherapie trotz auftretender Kardiotoxizität fortzusetzen. Beispiele hierfür kommen aus der grossen Patientinnengruppe mit Her2-positivem Mamma-Karzinom (SCHOLAR (27) und SAFE-HeaRT (28) Studie). Wir wissen, dass jeder Unterbruch der 12-monatigen Anti-Her2-gerichteten Therapie das Outcome für die Patientinnen verschlechtern kann (29). Das Konzept der permissiven Kardiotoxizität ist bereits in die Guidelines von 2022 aufgenommen worden: solange die LVEF nur leicht oder mässig beeinträchtigt ist und die Patientinnen keine relevanten kardialen (Herzinsuffizienz-)Symptome aufweisen, soll die anti-Her2-gerichtete Therapie unter Etablierung einer kardioprotektiven Therapie möglichst fortgeführt werden. Eine enge Kooperation der verschiedenen Fachteams (Kardiologie, Onkologie) ist bei solch schwierigen Fragen wichtig. Kürzlich sind die 3 Jahres-Daten aus der Arbeitsgruppe D.P. Leong aus Kanada zu diesem Thema veröffentlicht worden (30). Unter der kardioprotektiven Therapie konnten 92% der Patientinnen die onkologische Therapie komplett beenden. In den überwiegenden Fällen normalisierte sich die LVEF, in 14% blieb die LV-Dysfunktion bestehen. Ähnlich erfolgreiche Therapie-Fortsetzungen mit geeigneten protektiven Massnahmen sind auch für andere toxische Therapien gezeigt worden, wie z.B. für Vasospasmen unter 5-Fluoro-Uracil (31). Was es zukünftig und langfristig heisst, mit permissiver Kardiotoxizität zu arbeiten, bleibt offen.
Evidenz-Lücken und Ausblick
Das Bewusstsein für krebstherapiebedingte kardiovaskuläre Nebenwirkungen ist über die letzten Jahre gewachsen. Die ESC Guidelines
Kardio-Onkologie haben sich als praktischer Leitfaden mit einer umfangreichen Vollständigkeit der dringlichen Notwendigkeit zum strukturierten Vorgehen in der standardisierten Versorgung kardio-onkologischer Patienten angenommen. Sie sind somit ein wichtiger Meilenstein in der Kardio-Onkologie. Eine standardisierte Risiko-stratifizierung, Überwachung und Behandlungsstrategien im Falle von aufgetretener Kardiotoxizität sollen zur Verbesserung der Versorgung und des Outcomes in dieser Patientengruppe beitragen. Das ist die hervorragende Leistung des Autoren-Teams. Nun heisst es, die Guidelines zu leben, üben, überprüfen und lernen und die aufgezeigten Lücken in der Evidenz mit geeigneten, gut angelegten klinischen Studien zu adressieren. Sowohl die Forschung als auch die multidisziplinäre Zusammenarbeit und der enge direkte Austausch im Alltag nehmen hierbei eine zentrale Rolle ein und bilden eine wichtige Voraussetzung für die künftige Weiterentwicklung der Guidelines und der Kardio-Onkologie im Allgemeinen. Dies wird schliesslich helfen, die Langzeitprognose von Krebspatienten in Zukunft weiter zu verbessern.
Copyright Aerzteverlag medinfo AG
Oberärztin mbF
Kantonsspital St.Gallen, Klinik für Kardiologie
Rorschacher Strasse 95
9007 St. Gallen
Leiterin Kardio-Onkologie
Klinik für Kardiologie, Universitäres Herzzentrum
Universitätsspital Basel
Petersgraben 4
4031 Basel
gabriela.kuster@usb.ch
Die Autorinnen haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Lyon AR, López-Fernández T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, u. a. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J – Cardiovasc Imaging. 10. September 2022;23(10):e333–465.
2. Hasin T, Gerber Y, McNallan SM, Weston SA, Kushwaha SS, Nelson TJ, u. a. Patients with heart failure have an increased risk of incident cancer. J Am Coll Cardiol. 3. September 2013;62(10):881–6.
3. Li N, Huang Z, Zhang Y, Sun H, Wang J, Zhao J. Increased cancer risk after myocardial infarction: fact or fiction? A systemic review and meta-analysis. Cancer Manag Res. März 2019;Volume 11:1959–68.
4. Ekblom-Bak E, Bojsen-Møller E, Wallin P, Paulsson S, Lindwall M, Rundqvist H, u. a. Association Between Cardiorespiratory Fitness and Cancer Incidence and Cancer-Specific Mortality of Colon, Lung, and Prostate Cancer Among Swedish Men. JAMA Netw Open. 29. Juni 2023;6(6):e2321102.
5. Herrmann J, Lenihan D, Armenian S, Barac A, Blaes A, Cardinale D, u. a. Defining cardiovascular toxicities of cancer therapies: an International Cardio-Oncology Society (IC-OS) consensus statement. Eur Heart J. 31. Januar 2022;43(4):280–99.
6. Lyon AR, Dent S, Stanway S, Earl H, Brezden-Masley C, Cohen-Solal A, u. a. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society of Cardiology in collaboration with the International Cardio-Oncology Society. Eur J Heart Fail. November 2020;22(11):1945–60.
7. Rivero Santana B, Caro Codon J, Juarez Olmos V, Martinez Monzonis A, Zatarain-Nicolas E, Moliner P, u. a. HFA-ICOS cardiovascular toxicity risk score validation in CARDIOTOX registry. Eur Heart J. 3. Oktober 2022;43(Supplement_2):ehac544.2591.
8. Di Lisi D, Madaudo C, Alagna G, Santoro M, Rossetto L, Siragusa S, u. a. The new HFA/ICOS risk assessment tool to identify patients with chronic myeloid leukaemia at high risk of cardiotoxicity. ESC Heart Fail. Juni 2022;9(3):1914–9.
9. Vaduganathan M, Hirji SA, Qamar A, Bajaj N, Gupta A, Zaha V, u. a. Efficacy of Neurohormonal Therapies in Preventing Cardiotoxicity in Patients with Cancer Undergoing Chemotherapy. JACC CardioOncology. September 2019;1(1):54–65.
10. Lewinter C, Nielsen TH, Edfors LR, Linde C, Bland JM, LeWinter M, u. a. A systematic review and meta-analysis of beta-blockers and renin-angiotensin system inhibitors for preventing left ventricular dysfunction due to anthracyclines or trastuzumab in patients with breast cancer. Eur Heart J. 14. Juli 2022;43(27):2562–9.
11. Hundley WG, D’Agostino R, Crotts T, Craver K, Hackney MH, Jordan JH, u. a. Statins and Left Ventricular Ejection Fraction Following Doxorubicin Treatment. NEJM Evid. September 2022;1(9).
12. Neilan TG, Quinaglia T, Onoue T, Mahmood SS, Drobni ZD, Gilman HK, u. a. Atorvastatin for Anthracycline-Associated Cardiac Dysfunction: The STOP-CA Randomized Clinical Trial. JAMA. 8. August 2023;330(6):528–36.
13. Klimis H, Pinthus JH, Aghel N, Duceppe E, Fradet V, Brown I, u. a. The Burden of Uncontrolled Cardiovascular Risk Factors in Men With Prostate Cancer: A RADICAL-PC Analysis. JACC CardioOncology. Februar 2023;5(1):70–81.
14. Leong DP, Mukherjee SD. The European Society of Cardiology Cardio-Oncology Guidelines: Evidence Base, Actionability, and Relevance to Clinical Practice. JACC CardioOncology. Februar 2023;5(1):137–40.
15. Witteles RM, Reddy SA. ESC Cardio-Oncology Guidelines: A Triumph-But Are We Overscreening? JACC CardioOncology. Februar 2023;5(1):133–6.
16. Thavendiranathan P, Grant AD, Negishi T, Plana JC, Popović ZB, Marwick TH. Reproducibility of echocardiographic techniques for sequential assessment of left ventricular ejection fraction and volumes: application to patients undergoing cancer chemotherapy. J Am Coll Cardiol. 8. Januar 2013;61(1):77–84.
17. Slamon D, Eiermann W, Robert N, Pienkowski T, Martin M, Press M, u. a. Adjuvant Trastuzumab in HER2-Positive Breast Cancer. N Engl J Med. 6. Oktober 2011;365(14):1273–83.
18. Onitilo AA, Engel JM, Stankowski RV. Cardiovascular toxicity associated with adjuvant trastuzumab therapy: prevalence, patient characteristics, and risk factors. Ther Adv Drug Saf. August 2014;5(4):154–66.
19. Dent SF, Moore H, Raval P, Alder L, Guha A. How to Manage and Monitor Cardiac Dysfunction in Patients With Metastatic HER2-Positive Breast Cancer. JACC CardioOncology. September 2022;4(3):404–8.
20. Cardinale D, Colombo A, Lamantia G, Colombo N, Civelli M, De Giacomi G, u. a. Anthracycline-induced cardiomyopathy: clinical relevance and response to pharmacologic therapy. J Am Coll Cardiol. 19. Januar 2010;55(3):213–20.
21. Cardinale D, Colombo A, Bacchiani G, Tedeschi I, Meroni CA, Veglia F, u. a. Early detection of anthracycline cardiotoxicity and improvement with heart failure therapy. Circulation. 2. Juni 2015;131(22):1981–8.
22. Esmaeilzadeh M, Urzua Fresno CM, Somerset E, Shalmon T, Amir E, Fan CPS, u. a. A Combined Echocardiography Approach for the Diagnosis of Cancer Therapy-Related Cardiac Dysfunction in Women With Early-Stage Breast Cancer. JAMA Cardiol. 1. März 2022;7(3):330–40.
23. Plana JC, Thavendiranathan P, Bucciarelli-Ducci C, Lancellotti P. Multi-Modality Imaging in the Assessment of Cardiovascular Toxicity in the Cancer Patient. JACC Cardiovasc Imaging. August 2018;11(8):1173–86.
24. Negishi T, Thavendiranathan P, Penicka M, Lemieux J, Murbraech K, Miyazaki S, u. a. Cardioprotection Using Strain-Guided Management of Potentially Cardiotoxic Cancer Therapy: 3-Year Results of the SUCCOUR Trial. JACC Cardiovasc Imaging. März 2023;16(3):269–78.
25. Teske AJ. Global longitudinal strain in cardio-oncology: worth our trouble or more trouble than it’s worth? Neth Heart J. 1. März 2023;31(3):101–2.
26. Porter C, Azam TU, Mohananey D, Kumar R, Chu J, Lenihan D, u. a. Permissive Cardiotoxicity: The Clinical Crucible of Cardio-Oncology. JACC CardioOncology. September 2022;4(3):302–12.
27. Leong DP, Cosman T, Alhussein MM, Kumar Tyagi N, Karampatos S, Barron CC, u. a. Safety of Continuing Trastuzumab Despite Mild Cardiotoxicity: A Phase I Trial. JACC CardioOncology. September 2019;1(1):1–10.
28. Lynce F, Barac A, Geng X, Dang C, Yu AF, Smith KL, u. a. Prospective evaluation of the cardiac safety of HER2-targeted therapies in patients with HER2-positive breast cancer and compromised heart function: the SAFE-HEaRt study. Breast Cancer Res Treat. Juni 2019;175(3):595–603.
29. Sardesai S, Sukumar J, Kassem M, Palettas M, Stephens J, Morgan E, u. a. Clinical impact of interruption in adjuvant Trastuzumab therapy in patients with operable HER-2 positive breast cancer. Cardio-Oncol Lond Engl. 5. November 2020;6(1):26.
30. Zhou S, Cirne F, Chow J, Zereshkian A, Bordeleau L, Dhesy-Thind S, u. a. Three-Year Outcomes Following Permissive Cardiotoxicity in Patients on Trastuzumab. The Oncologist. 7. September 2023;28(9):e712–22.
31. Zafar A, Drobni ZD, Lei M, Gongora CA, Quinaglia T, Lou UY, u. a. The efficacy and safety of cardio-protective therapy in patients with 5-FU (Fluorouracil)-associated coronary vasospasm. PloS One. 2022;17(4):e0265767.