Chronische Schmerzen bei Menschen mit M. Parkinson sollten der Erkrankung zugeordnet werden, da ein Grossteil dieser Schmerzen durch eine besser eingestellte dopaminerge Therapie behandelt werden kann. Diese stellt eine kausale Therapie dar und ein Ausweichen auf andere nebenwirkungsreichere Medikamente kann vermieden werden. Aufgrund der erstaunlichen Effekte, auch auf chronische Schmerzen, wird eine regelmässige intensive körperliche Aktivität empfohlen. Nicht zur Parkinson-Erkrankung zuordnungsbare Schmerzen sollen entsprechend «normaler» Schmerzen diagnostiziert und behandelt werden.
It is recommended that chronic pain in Parkinson’ s disease be attributed to the disease itself, as the majority of this pain can be effectively treated with improved dopaminergic therapy. This represents a causal therapy and a switch to other drugs with more side effects can be avoided. Due to the remarkable effects, including on chronic pain, regular intensive exercise is recommended. Pain that cannot be classified as associated with Parkinson’ s disease should be diagnosed and treated as «normal» pain.
Key words: Morbus Parkinson – chronischer Schmerz – Diagnostik – Behandlung
M. Parkinson (MP) ist mit einer Prävalenz von 2 % bei den über 65-Jährigen eine sehr häufige Erkrankung, die mit dem Alter weiter zunimmt (1). Bei Auftreten der Erkrankung unter 40 (young- oder early-onset Parkinson-Syndrom) oder unter 20 Jahren (juveniles Parkinson-Syndrom) besteht oft eine genetische Disposition. Bei etwa 75 % der Patienten mit einem Parkinson-Syndrom liegt der M. Parkinson (oder idiopathisches Parkinson-Syndrom) vor. Weiterhin können symptomatische Parkinson-Syndrome (z. B. lower body Parkinsonism bei vaskulärer Leukenzephalopathie) und atypische Parkinson-Syndrome im Rahmen von neurodegenerativen Erkrankungen (z. B. Multisystematrophie) unterschieden werden.
Obwohl MP eine progredient verlaufende Erkrankung ist, zeichnet er sich im Gegensatz zu anderen Parkinson-Syndromen, meist durch ein gutes Ansprechen auf eine dopaminerge Medikation aus. Neben den bekannten motorischen Symptomen können beim MP auch vielfältige nicht-motorische Symptome vorliegen (2). Diese können in sensorische (Riechstörungen, Visusstörungen und Schmerzen), neuropsychiatrische (Schlafstörungen, Fatigue, Depression, Demenz, Psychose) und autonome (Obstipation, Inkontinenz, orthostatische Hypotonie, nächtliche Hypertonie) Symptome unterschieden werden, wobei der Zusammenhang mit der Erkrankung oft weder für den Patienten noch für die Behandelnden immer offensichtlich ist. Zuletzt wurden mit einer gutartigen primär motorischen, einer intermediären mit nicht-motorischen Symptomen und einer progredienten seltenen Verlaufsform, drei verschiedene klinische Verläufe unterschieden (3).
Ein wichtiges nicht-motorisches Symptom, das die Lebensqualität erheblich beeinträchtigt, sind chronische Schmerzen (d. h. > 3 Monate Dauer). Sie sind mit bis zu 80 % sehr häufig und oft schwierig zu diagnostizieren, da sie nicht leicht von Parkinson-unabhängigen Schmerzen abgegrenzt werden können (4). Im Laufe der Erkrankung kommt es durch postsynaptische Degeneration zu sogenannten Fluktuationen (Phasen mit verminderter Beweglichkeit oder mit Überbeweglichkeit), da keine stabilen Dopaminspiegel mehr erreicht werden können (5). Diese beinhalten ebenfalls das vermehrte Auftreten nicht motorischer Symptome wie beispielsweise chronischer Schmerzen (6).
Chronische Schmerzen unterscheiden
Durch MP verursachte chronische Schmerzen können diagnostiziert werden, indem v.a. eine Assoziation anhand von verstärkten Parkinson-Symptomen und dem Ansprechen auf eine dopaminerge Medikation erfragt wird (4). Wenn keine Assoziation besteht, wird eine weitere Diagnostik empfohlen. Bisherige Studien zeigten eine ähnliche Häufigkeit nicht Parkinson-assoziierter Schmerzen, wie in der Normalbevölkerung (20–30 %), aber auch höhere Prävalenzen (60 %) (4, 7), die beispielsweise durch Haltungsstörungen mit vermehrter Arthrose und indirekt durch Frailty erklärt werden können. Wenn Schmerzen durch MP verursacht werden, kann dies oft durch eine Anpassung der dopaminergen Therapie behandelt werden (8).
Parkinson-assoziierte chronische Schmerzen feststellen
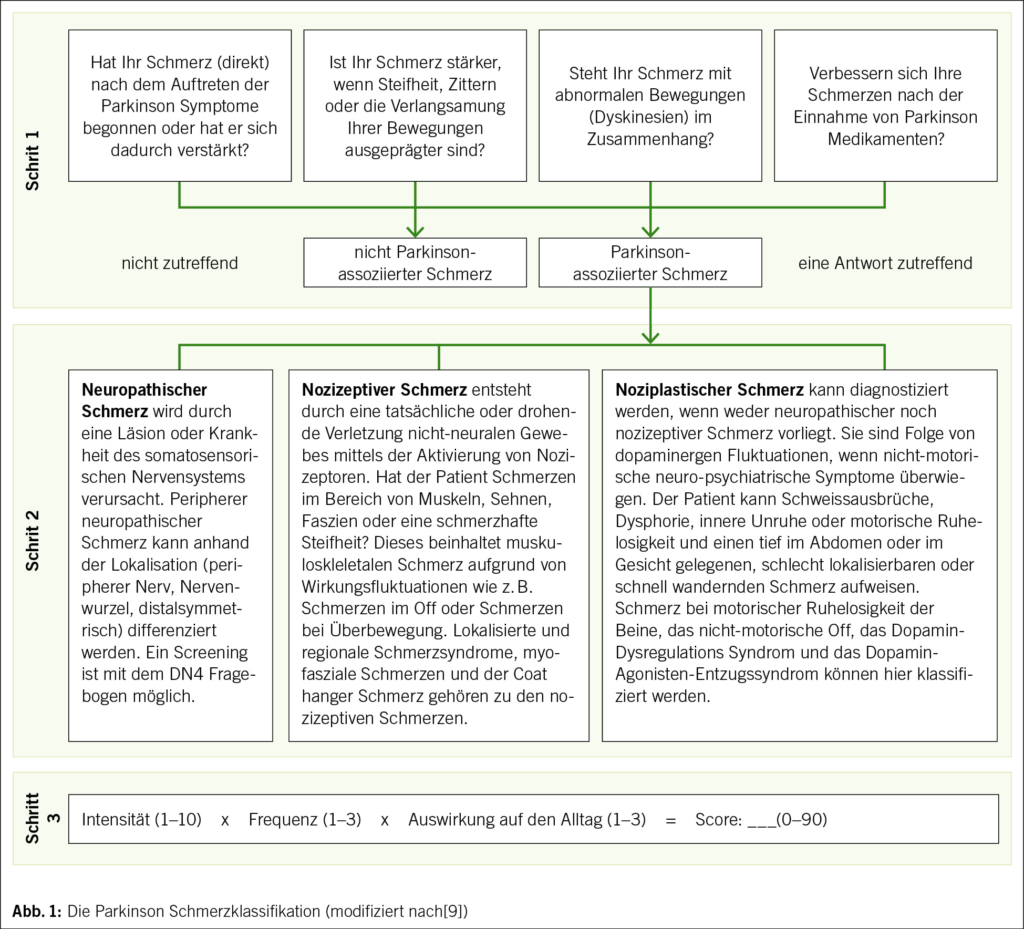
Um einen ursächlichen Zusammenhang von chronischen Schmerzen mit der Parkinson-Erkrankung festzustellen, können mit dem PD-PCS Fragebogen (Parkinson disease pain classification system) fünf Faktoren erfragt werden (4, 9) (Abb. 1). Diese Kriterien wurden nach Expertenkonsens für chronisch sekundäre muskuloskeletale Schmerzen assoziiert mit MP ergänzt und ins ICD-11 übernommen (10).
• Schmerzen werden durch den Beginn der Erkrankung ausgelöst
• Schmerzen werden durch die Erkrankung verstärkt
• Schmerzen treten in Phasen von stärkerer motorischer oder nicht-motorischer Beeinträchtigung (Off-Phasen, niedriger Dopaminspiegel) auf
• Schmerzen treten bei Überbewegungen auf (On-Dyskinesien, hoher Dopaminspiegel)
• Schmerzen verbessern sich durch die Gabe von dopaminerger Medikation (> 30 % auf der Numerischen Ratingskala).
Wenn einer der Faktoren zutrifft, sollte ein Zusammenhang mit Wirkungsfluktuationen erfragt werden. Wir empfehlen einen Bewegungsbogen, der die Beweglichkeit über den Tagesverlauf (Off-Phasen, normale Beweglichkeit, Überbewegung) erfasst. Dies erlaubt dann eine bessere Einstellung der Parkinson-Medikation.
Unseren Daten zufolge beschreibt eine Besserung durch dopaminerge Medikation diesen Zusammenhang am häufigsten (75 %). Darauf folgen Schmerzen in Off-Phasen (69 %), Schmerzen zu Beginn der Erkrankung oder durch die Erkrankung verstärkt (33 %) und Schmerzen bei choreatischen Dyskinesien (8 %) (bisher unveröffentlichte Daten aus (4)).
Mechanismen chronischer Schmerzen
Nach der Zuordnung des Schmerzsyndroms zur Parkinson-Erkrankung oder zu Parkinson unabhängigen Schmerzen können Schmerzmechanismen unterschieden werden (11), um eine Mechanismen-basierte Therapie zu ermöglichen. Im PD-PCS Fragebogen schlagen wir einen hierarchischen Algorithmus vor, um zuerst neuropathische, dann nozizeptive und anschliessend noziplastische Schmerzsyndrome zu differenzieren (4, 9). Alle wichtigen, durch die Parkinson-Erkrankung verursachten Schmerzsyndrome können so einem Mechanismus zugeordnet werden (Abb. 2).
Neuropathische Schmerzen werden als «Schmerzen, die durch eine Läsion oder Erkrankung des somatosensorischen Nervensystems verursacht werden» definiert. Sie können mittels eines Gradings definiert werden, wobei eine zugrundeliegende Krankheit und ein neurologisch plausibles Verteilungsmuster (möglich) und typische neuropathische Schmerzcharakteristika (wahrscheinlich) und der Nachweis einer Schädigung des somatosensorischen Systems gefordert werden (definitiv) (12) (z. B. Bandscheibenvorfall mit Wurzelkompression). Im PD-PCS werden neuropathische Schmerzen anhand eines Screening-Fragebogens (Douleur Neuropathique-4 Fragebogens (DN-4)) erfasst (13). Dieser Fragebogen definiert neuropathische Schmerzen, wenn mindestens 4 von 10 Fragen zu neuropathischen Charakteristika und der neurologischen Untersuchung mit «ja» beantwortet werden.
Bei MP liegen wahrscheinlich nur periphere neuropathische Schmerzsyndrome vor. Diese treten oft auch zusammen mit nozizeptivem Schmerz auf (Mixed-Pain, z. B. bei Zervikobrachialgie). Der Schmerz ist im Ausbreitungsgebiet eines peripheren Nervens, einer Nervenwurzel oder distal symmetrisch lokalisiert. Beispiele dafür sind Wurzelkompressionssyndrome, die Polyneuropathie (z. B. bei durch hohe L-dopa Gaben verursachtem Vitamin-B12-Mangel) oder eine periphere Nervenläsion.
Nozizeptiver Schmerz «entsteht durch eine tatsächliche oder drohende Schädigung von nicht-neuralem Gewebe und ist auf die Aktivierung von Nozizeptoren zurückzuführen». Diese sind definiert als schmerzhafte Muskeln, Gelenke oder Bänder oder muskuläre Steifheit. Hierunter werden lokale oder regionale Schmerzsyndrome, das myofasziale Schmerzsyndrom (Schmerzen in zusammenhängenden Regionen mit Triggerpunkten, z. B. Schulter- oder Beckengürtel) und der Coat hanger Schmerz (Nackenschmerzen bei Hypotonie) zusammengefasst.
Bei noziplastischen Schmerzen liegt eine veränderte Schmerzverarbeitung vor und es bestehen keine Hinweise für neuropathische und nozizeptive Schmerzen: «Schmerzen, die durch eine veränderte Nozizeption entstehen, obwohl es keine eindeutigen Hinweise auf eine tatsächliche oder drohende Gewebeschädigung gibt oder Hinweise auf eine Erkrankung oder Läsion des somatosensorischen Systems, die den Schmerz verursacht». Darunter haben wir die nichtmotorische Off-Phase, die motorische Unruhe der Beine (die Kriterien für ein Restless-Leg-Syndrom werden oft nicht vollständig erfüllt), das dopaminerge Dysregulationssyndrom (Unruhe u. a. bei dopaminerger Überstimulation) und das Dopamin-Agonisten-Entzugssyndrom (zu schneller Entzug von Dopamin-Agonisten) definiert. Seltene zentrale Schmerzen können auch hier subsummiert werden, wenn keine neuropathische Komponente besteht und kein anderes nociplastisches Syndrom vorliegt.
Der PD-PCS Fragebogen beinhaltet auch eine Bewertung der Schmerzen (Produkt aus Intensität (0–10), Frequenz (1–3) und Auswirkung auf den Alltag (1–3)). Er liegt bisher auf Deutsch und Englisch vor, weitere Übersetzungen werden derzeit validiert (4, 9). Eine Kurzversion kann auch Online abgerufen werden (siehe QR code in Abb.2).
Nach Zuordnung der Schmerzen zum MP kann alternativ auch die King’ s Parkinson disease pain scale (KPPS) verwendet werden. Sie unterscheidet 7 verschiedenen Schmerzkategorien (14).
Pathophysiologie von Parkinson-assoziierten Schmerzen
Pathophysiologisch sind vor allem Schwankungen des Dopaminspiegels für Parkinson-assoziierte Schmerzen ursächlich. Diese wirken sich im Stammganglien-Bereich auf die weitere kortikale Verarbeitung und durch deszendierende dopaminerge Hemmsysteme auf die spinale Schmerzweiterleitung aus. Im Positronen-Emissions-Tomografie (PET) zeigte sich in der Off-Phase (reduzierte dopaminerge Stimulation) eine vermehrte Aktivierung im medialen schmerzverarbeitenden System, welche sich in der On-Phase zurückbildete (15). In der Off-Phase zeigte sich auch eine erhöhte experimentelle Schmerzempfindung, die schon auf spinaler Ebene nachweisbar war. Im Laufe der Erkrankung nimmt diese weiter zu (16, 17). Bei Patienten mit Schmerzen konnte in einigen Studien eine stärkere Schmerzwahrnehmung gezeigt werden. Eine reduzierte dopaminerge deszendierende Schmerzhemmung wird dafür ursächlich vermutet (18), wobei L-dopa Gabe und tiefe Hirnstimulation diese normalisieren konnte (19, 20).
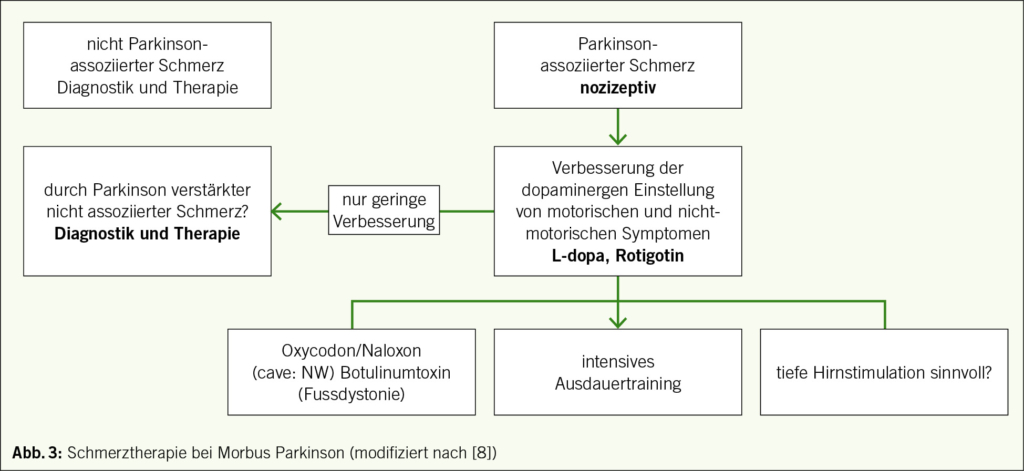
Therapie von Parkinson-assoziierten Schmerzen (Abb. 3)
Wenn die Parkinson-Erkrankung ursächlich für die Schmerzen ist, kann das Auftreten der Schmerzen im Zusammenhang mit anderen motorischen und nicht-motorischen Symptomen sowie der Medikation Hinweise für die Therapie geben (8). Beispielsweise kann bei dopaminerger Unterdosierung morgens, nachts oder beim wearing-off (kurze Wirkdauer von Dopamin) die Medikation entsprechend angepasst werden. Bei seltenen choreatischen Dyskinesien (Überbewegung) in der On-Phase kann versucht werden, den dopaminergen Peak abzuflachen. Mit einem Bewegungsbogen können diese Fluktuationen oft gut erfasst werden. Wenn Schmerzen nicht oder nur wenig auf eine Anpassung der dopaminergen Medikation reagieren (< 30 % auf der Numerischen Ratingskala) sollten andere Ursachen erwogen werden. Anschliessend kommen nicht dopaminerge Medikamente in Abhängigkeit vom Schmerzmechanismus zum Einsatz. Nicht-medikamentöse Verfahren sollten immer in Betracht gezogen werden, da die Effekte – beispielsweise von regelmässiger intensiver körperlicher Aktivität – erstaunlich gut sind. Bei schlecht behandelbaren Fluktuationen werden invasive Verfahren angeboten.
Im bio-psycho-sozialen Krankheitsmodell von chronischen Schmerzen sind neben der Ursache weitere Faktoren wichtig. Neben dem zeitlichen Verlauf und der Schmerzstärke sollten daher die Beeinträchtigung im Alltag, psychosoziale Faktoren und der Leidensdruck berücksichtigt werden.
Dopaminerge Therapie bei M. Parkinson
Der gleichmässige Ersatz des fehlenden Dopamins über den gesamten aktiven Tag ist zu Beginn der Erkrankung durch drei gleichmässig verteilte Dosen eines nicht retardierten L-dopa-Präparates möglich. Um eine gute Wirkung zu erreichen, sollte dieses mindestens 30 Minuten vor oder 60 Minuten nach dem Essen und nicht gleichzeitig mit Milchprodukten eingenommen werden. Wenn sich im Laufe der Erkrankung die Umwandlungskapazität von L-dopa in Dopamin postsynaptisch weiter erschöpft, verkürzt sich die Wirkdauer und das wearing-off (oder end-of-dose Akinesie) tritt auf. Hier kann es notwendig werden, zusätzliche Dosisintervalle einzufügen und die Medikation beispielsweise alle 3 oder 4 Stunden zu verabreichen. Ein retardiertes L-dopa-Präparat kann im Fall von störenden nächtlichen oder morgendlichen Off-Phasen zur Nacht ergänzt werden. Schnell wirksame Präparate (beispielsweise Madopar Liquid), wie auch die Inhalation von L-dopa (bisher in der Schweiz nicht erhältlich), können bei nichtvorhersagbaren Akinesien oder morgens hilfreich sein. Eine Alternative dazu kann auch der Apomorphin-Pen sein.
Der zusätzliche Einsatz von MAO-B- oder COMT-Hemmern kann die Wirkdauer von Dopamin verlängern, damit gleichmässige Plasmaspiegel erreichen. MAO-B-Hemmer können auch schon zu Beginn der Erkrankung gegeben werden. Der COMT-Hemmer Opicapon kann als Einmalgabe abends angewendet werden, während Entacapon mit jeder L-dopa-Dosis kombiniert werden muss. Da diese zusätzliche Medikation die Plasmaspiegel von Dopamin um 30–50 % erhöht, sollte eine entsprechende Dosisreduktion erfolgen, um Überbewegungen zu vermeiden (21).
Durch zusätzliche Gabe von Dopaminagonisten im Frühstadium der Erkrankung und bei jüngeren Patienten erhoffte man sich, L-dopa einzusparen. Aktuell werden Agonisten, wegen möglichen Nebenwirkungen, etwas kritischer betrachtet. Ausserdem konnte gezeigt werden, dass eine späte Dopamintherapie nicht weniger Überbewegungen bewirkt. Das Ziel der dopaminergen Therapie sollte daher eine optimale Kontrolle der motorischen und nicht-motorischen Symptome unter Beachtung von Nebenwirkungen (wie Halluzinationen und orthostatische Dysregulation) sein. Dopaminagonisten haben, wenn der Einsatz unter Beachtung möglicher Nebenwirkungen vorsichtig erfolgt, v. a. in den retardierten Formen immer noch ihre Berechtigung. Mit Rotigotin besteht die Möglichkeit einer einmal täglichen Applikation als Pflaster.
Dopaminerge Therapie chronischer Schmerzen
Im Hinblick auf eine wirksame Schmerztherapie durch dopaminerge Medikation liegen nur wenige Studien zu nozizeptivem Schmerz vor, so dass wir zunächst eine Therapie von Wirkungsfluktuationen empfehlen, z. B. bei morgendlichen oder nächtlichen Off-Phasen oder beim wearing-off (siehe oben).
Der Agonist Rotigotin und der MAO-B-Hemmer Safinamid wurden je in 2 RCTs untersucht. Zur Wirkung von L-dopa auf Schmerzen liegen bisher nur Beobachtungsstudien vor. Die post-hoc Untersuchung der RECOVER-Studie zeigte eine Verbesserung des morgendlichen sowie des nächtlichen Off-assoziierten Schmerzes durch das Rotigotin-Pflaster nach 4 Wochen Erhaltungstherapie, wobei die Betroffenen mit Schlafstörungen besonders von der Therapie profitierten (22). Ähnliche Effekte auf den sekundären Endpunkt von Fluktuationen-bedingten Schmerzen zeigte eine weitere Studie (23). Safinamid konnte die On-Zeit signifikant erhöhen und zeigte in einem RCT einen Effekt auf Schmerzen (24), was im 2. RCT mit Schmerz als primäre Zielgrösse nicht reproduziert werden konnte (clinicaltrials.gov NCT03841604). L-dopa-Beobachtungsstudien konnten eine Verbesserung nozizeptiver Schmerzen um 51 % in der On- im Vergleich zur Off-Phase bei Korrelation mit motorischen Funktionen zeigen (25). Muskuloskeletaler Schmerz konnte in einer weiteren Beobachtungsstudie bei 83 % der Patienten um mindestens 30 % reduziert werden (26).
Zusammenfassend liegen bisher nur wenige Studien vor, die dopaminerge Medikation bei Schmerzen bei Parkinson-Betroffenen untersucht haben. Klinische Erfahrungen unterstützen die vorliegenden Daten zur Behandlung von motorischen und nicht-motorischen Fluktuationen (d. h. insbesondere durch Behandlung von Off-Phasen). Beim Erhöhen dopaminerger Medikation sollten jeweils auch mögliche Nebenwirkungen beobachtet werden (z.B. Halluzinationen). Bei den selten schmerzhaften choreatischen Dyskinesien (selten auch dyston) vorwiegend in der On-Phase, sollte versucht werden, die dopaminergen Peaks durch retardierte Präparate zu reduzieren und ggf. Amantadin vorsichtig einzusetzen.
Ergebnisse laufender Studien zu Opicapon und zur Erhöhung von L-dopa werden demnächst erwartet. Zuletzt ist eine Studie zu noziplastischem (zentralem) Schmerz erschienen, die keinen Effekt einer L-dopa Erhöhung zeigen konnte. Daher wird bei noziplastischen Schmerzen empfohlen, das jeweilige Schmerzsyndrom entsprechend zu behandeln (siehe Empfehlungen zu Dopamindysregulationssyndrom, Dopaminagonisten Entzugssyndrom, motorische Unruhe der Beine und nicht-motorischem Off). Zu neuropathischen Schmerzen liegen bisher keine Studien mit dopaminerger Medikation vor.
Nicht-dopaminerge Therapie chronischer Schmerzen
Nicht-dopaminerge Medikation in der Schmerztherapie bei Parkinson-Betroffenen wurde bisher ebenfalls nur in wenigen randomisierten und kontrollierten Studien (RCT) untersucht. RCTs liegen nur für retardiertes Oxycodon, die fixe Kombination von Ocycodon und Naloxon, Cannadibiol (CBD), Botulinum-Toxin und Duloxetin vor. Die meisten Studien wurden bei nozizeptivem Schmerz durchgeführt (Oxycodon und Duloxetin: noziplastischer Schmerz). Laut einer Beobachtungsstudie wurden in Deutschland Schmerzen oft mit nichtsteroidalen Antirheumatika (NSAIDs) (55 %), Paracetamol (22 %), Metamizol (16 %) und Opioiden (9 %) mit guten therapeutischen Effekten von bis zu 78 % Schmerzreduktion behandelt (27).
Ein RCT zur fixen Kombination von retardiertem Ocycodon und Naloxon von 2 x 5/2.5–2 x 20/10 erreichte bei starken Schmerzen (Schmerzskala NRS ≥ 6) nicht den primären Endpunkt nach 16 Wochen, zeigte aber signifikante Effekte nach 4, 8 und 12 Wochen (28). Die Ansprechrate (> 30 % Besserung) war mit 48 vs. 34 % höher, jedoch auch die Abbruchrate durch Übelkeit und Obstipation (17 vs. 9 bzw. 6 %). Beobachtungsstudien zu Cannabinoiden haben nur Kurzzeiteffekte gezeigt. Grosse randomisierte Studien konnten diese Effekte nicht zeigen. Eine kleine randomisierte Studie zeigte einen positiven Effekt von 300 mg CBD auf die Lebensqualität, ohne dass Effekte auf Schmerzen nachgewiesen werden konnten (29). In einer Umfrage gaben in Deutschland 8 % der Patienten an, regelmässig medizinischen Cannabis zu nutzen, wobei 40 % der Patienten eine Besserung von Schmerzen und Muskelkrämpfen angab. Tapentadol wurde nur retro-spektiv bei 21 Patienten mit meist nozizeptivem Schmerz mit Dosen bis zu 200 mg über 6 Monate untersucht (30). Dabei fand sich eine Schmerzreduktion um 50 %, ohne dass wesentliche Nebenwirkungen auftraten. Die Stimmungslage der Probanden war besser und die Lebensqualität wurde gesteigert.
Zum Botulinumtoxin liegen zwei randomisierte kontrollierte Studien vor. Eine Studie konnte einen guten Effekt bei Schmerzen durch Grosszehendystonie (Verkrampfung meist in der Off-Phase) und Injektion in den Musculus flexor digitorum longus zeigen, der dem Effekt durch die Injektion in den Musculus flexor digitorum brevis überlegen war (31). Bei nicht L-dopa-responsiven Schmerzen konnte eine weitere Studie keinen Effekt auf Beinschmerzen zeigen, wobei die injizierten Muskeln nicht angegeben wurden.
Duloxetin als dualer selektiver Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI) kann bei der diabetischen Polyneuropathie oder bei chronischen muskuloskeletalen Schmerzen eingesetzt werden. Eine open-label Studie bei 20 Parkinson-Erkrankten mit vermuteten, starken, zentralen Schmerzen (noziplastisch) zeigte gute Effekte über 6 Wochen bei einer Dosis von 30–60 mg bei jedoch hoher Abbruchrate (32). Eine RCT mit 40 mg konnte diese Ergebnisse bei weniger starken Schmerzen nicht reproduzieren (33).
Die zuletzt erschienene OXYDOPA-Studie konnte, bei schlechter Verträglichkeit, keinen Effekt von retardiertem Ocycodon bei noziplastischem (zentralem) Schmerz zeigen (34).
Zusammenfassend liegen wenige kontrollierte Studien zu nicht-dopaminerger Schmerztherapie bei Parkinson-Betroffenen vor, so dass nur retardiertes Ocycodon und Naloxon mit Vorsicht versucht werden kann (nur die sekundären Endpunkte konnten eine Überlegenheit zeigen). Zudem wird Botulinumtoxin bei Fuss- oder Grosszehendystonie empfohlen. Die Daten zu Duloxetin waren widersprüchlich und zeigten nur einen Effekt bei zentralen starken Schmerzen. Die Studienlage zu diversen Cannabispräparaten ist negativ.
Nicht-medikamentöse Verfahren
Bei den nichtmedikamentösen Verfahren kann eine Studie herausgehoben werden, in der ein bemerkenswerter Effekt von intensivem Ausdauertraining auf chronische Schmerzen gezeigt werden konnte. Durch endogene Opioid-Analgesie wurden nicht nur Symptome der Parkinson-Erkrankung verbessert, sondern auch Schmerzen gelindert. Nordic Walking oder Walking als Ausdauertherapie mit hoher Intensität für 70 Minuten 3 x Woche für 6 Monate konnte verschiedene Schmerzen mehr als halbieren, was in der Kontrollgruppe mit Flexibilitätstraining nicht in diesem Ausmass gezeigt werden konnte (35). Zur Beurteilung alternativer Therapieverfahren bei MP und Schmerz verweisen wir auf entsprechende Reviews (36).
Invasive Verfahren
Als invasive Verfahren bei fortgeschrittener Erkrankung mit nicht mehr gut behandelbaren motorischen Fluktuationen kommen die tiefe Hirnstimulation (THS), die jejunale Duodopa-Applikation und die subkutane Apomorphin-Applikation in Frage. Dabei können 5 Einnahmezeiten oder 2 Stunden täglich in der Off-Phase oder 1 Stunde mit störenden choreatischen Dyskinesien (Überbewegungen) einen Hinweis für ein Fortschreiten der Erkrankung mit Fluktuationen sein (5-2-1-Regel). In Studien konnte dabei besonders die THS des Nucleus subthalamicus einen guten Effekt auf chronische Schmerzen zeigen (Schmerzreduktion bis zu 80 %) (37).
Copyright
Aerzteverlag medinfo AG
Klinik für Neurorehabilitation
Kliniken Valens
Taminaplatz 1
7317 Valens
V. Mylius erklärt, dass Verbindungen zu den Firmen BIAL, AbbVie und Zambon durch Sponsoring von Vorträgen und Forschungsaktivitäten u. ä. bestehen. Die Studie zum Schmerzfragebogen wurde von Parkinson Schweiz unterstützt.
1. Hoglinger G, Trenkwalder C. Parkinson-Krankheit, S2k-Leitlinie, 2023. Deutsche Gesellschaft für Neurologie (Hrsg), Leitlinien für Diagnostik und Therapie in der Neurologie. 2023.
2. Schapira AHV, Chaudhuri KR, Jenner P. Non-motor features of Parkinson disease. Nat Rev Neurosci. 2017 Aug;18(8):509.
3. Fereshtehnejad SM, Zeighami Y, Dagher A, Postuma RB. Clinical criteria for subtyping Parkinson’ s disease: biomarkers and longitudinal progression. Brain. 2017 Jul 1;140(7):1959-76.
4. Mylius V, Perez Lloret S, Cury RG, Teixeira MJ, Barbosa VR, Barbosa ER, et al. The Parkinson disease pain classification system: results from an international mechanism-based classification approach. Pain. 2021 Apr 1;162(4):1201-10.
5. Zaja-Milatovic S, Milatovic D, Schantz AM, Zhang J, Montine KS, Samii A, et al. Dendritic degeneration in neostriatal medium spiny neurons in Parkinson disease. Neurology. 2005 Feb 8;64(3):545-7.
6. Storch A, Schneider CB, Wolz M, Sturwald Y, Nebe A, Odin P, et al. Nonmotor fluctuations in Parkinson disease: severity and correlation with motor complications. Neurology. 2013 Feb 26;80(9):800-9.
7. Lee MA, Walker RW, Hildreth TJ, Prentice WM. A survey of pain in idiopathic Parkinson’ s disease. J Pain Symptom Manage. 2006 Nov;32(5):462-9.
8. Mylius V, Moller JC, Bohlhalter S, Ciampi de Andrade D, Perez Lloret S. Diagnosis and Management of Pain in Parkinson’ s Disease: A New Approach. Drugs Aging. 2021 Jul;38(7):559-77.
9. Mylius V, Perez Lloret S, Brook CS, Kruger MT, Hagele-Link S, Gonzenbach R, et al. The new Parkinson’ s disease pain classification system (PD-PCS). Nervenarzt. 2022 Oct;93(10):1019-27.
10. Mylius V, Moisset X, Rukavina K, Rosner J, Korwisi B, Marques A, et al. New ICD-11 diagnostic criteria for chronic secondary musculoskeletal pain associated with Parkinson disease. Pain. 2024 Jan 11.
11. Cohen SP, Vase L, Hooten WM. Chronic pain: an update on burden, best practices, and new advances. Lancet. 2021 May 29;397(10289):2082-97.
12. Finnerup NB, Haroutounian S, Kamerman P, Baron R, Bennett DL, Bouhassira D, et al. Neuropathic pain: an updated grading system for research and clinical practice. Pain. 2016 Aug;157(8):1599-606.
13. Bouhassira D, Attal N, Alchaar H, Boureau F, Brochet B, Bruxelle J, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain. 2005 Mar;114(1-2):29-36.
14. Chaudhuri KR, Rizos A, Trenkwalder C, Rascol O, Pal S, Martino D, et al. King’ s Parkinson’ s disease pain scale, the first scale for pain in PD: An international validation. Mov Disord. 2015 Oct;30(12):1623-31.
15. Brefel-Courbon C, Payoux P, Thalamas C, Ory F, Quelven I, Chollet F, et al. Effect of levodopa on pain threshold in Parkinson’ s disease: a clinical and positron emission tomography study. Mov Disord. 2005 Dec;20(12):1557-63.
16. Boura E, Stamelou M, Vadasz D, Ries V, Unger MM, Kagi G, et al. Is increased spinal nociception another hallmark for Parkinson’ s disease? J Neurol. 2017 Mar;264(3):570-5.
17. Mylius V, Brebbermann J, Dohmann H, Engau I, Oertel WH, Moller JC. Pain sensitivity and clinical progression in Parkinson’ s disease. Mov Disord. 2011 Oct;26(12):2220-5.
18. Mylius V, Engau I, Teepker M, Stiasny-Kolster K, Schepelmann K, Oertel WH, et al. Pain sensitivity and descending inhibition of pain in Parkinson’ s disease. J Neurol Neurosurg Psychiatry. 2009 Jan;80(1):24-8.
19. Gerdelat-Mas A, Simonetta-Moreau M, Thalamas C, Ory-Magne F, Slaoui T, Rascol O, et al. Levodopa raises objective pain threshold in Parkinson’ s disease: a RIII reflex study. J Neurol Neurosurg Psychiatry. 2007 Oct;78(10):1140-2.
20. Mylius V, Baars JH, Witt K, Benninger D, de Andrade DC, Kagi G, et al. Deep Brain Stimulation Improves Parkinson’ s Disease-Associated Pain by Decreasing Spinal Nociception. Mov Disord. 2024 Feb;39(2):447-9.
21. Stocchi F, Rascol O, Kieburtz K, Poewe W, Jankovic J, Tolosa E, et al. Initiating levodopa/carbidopa therapy with and without entacapone in early Parkinson disease: the STRIDE-PD study. Ann Neurol. 2010 Jul;68(1):18-27.
22. Kassubek J, Chaudhuri KR, Zesiewicz T, Surmann E, Boroojerdi B, Moran K, et al. Rotigotine transdermal system and evaluation of pain in patients with Parkinson’ s disease: a post hoc analysis of the RECOVER study. BMC Neurol. 2014 Mar 6;14:42.
23. Rascol O, Zesiewicz T, Chaudhuri KR, Asgharnejad M, Surmann E, Dohin E, et al. A Randomized Controlled Exploratory Pilot Study to Evaluate the Effect of Rotigotine Transdermal Patch on Parkinson’ s Disease-Associated Chronic Pain. J Clin Pharmacol. 2016 Jul;56(7):852-61.
24. Borgohain R, Szasz J, Stanzione P, Meshram C, Bhatt MH, Chirilineau D, et al. Two-year, randomized, controlled study of safinamide as add-on to levodopa in mid to late Parkinson’ s disease. Mov Disord. 2014 Sep;29(10):1273-80.
25. Nebe A, Ebersbach G. Pain intensity on and off levodopa in patients with Parkinson’ s disease. Mov Disord. 2009 Jun 15;24(8):1233-7.
26. Li J, Zhu BF, Gu ZQ, Zhang H, Mei SS, Ji SZ, et al. Musculoskeletal Pain in Parkinson’ s Disease. Front Neurol. 2021;12:756538.
27. Buhmann C, Wrobel N, Grashorn W, Fruendt O, Wesemann K, Diedrich S, et al. Pain in Parkinson disease: a cross-sectional survey of its prevalence, specifics, and therapy. J Neurol. 2017 Apr;264(4):758-69.
28. Trenkwalder C, Chaudhuri KR, Martinez-Martin P, Rascol O, Ehret R, Valis M, et al. Prolonged-release oxycodone-naloxone for treatment of severe pain in patients with Parkinson’ s disease (PANDA): a double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2015 Dec;14(12):1161-70.
29. Chagas MH, Zuardi AW, Tumas V, Pena-Pereira MA, Sobreira ET, Bergamaschi MM, et al. Effects of cannabidiol in the treatment of patients with Parkinson’ s disease: an exploratory double-blind trial. J Psychopharmacol. 2014 Nov;28(11):1088-98.
30. Freo U, Furnari M, Ori C. Effects of tapentadol on pain, motor symptoms and cognitive functions in Parkinson’ s disease. J Pain Res. 2018;11:1849-56.
31. Rieu I, Degos B, Castelnovo G, Vial C, Durand E, Pereira B, et al. Incobotulinum toxin A in Parkinson’ s disease with foot dystonia: A double blind randomized trial. Parkinsonism Relat Disord. 2018 Jan;46:9-15.
32. Djaldetti R, Yust-Katz S, Kolianov V, Melamed E, Dabby R. The effect of duloxetine on primary pain symptoms in Parkinson disease. Clin Neuropharmacol. 2007 Jul-Aug;30(4):201-5.
33. Iwaki H, Ando R, Tada S, Nishikawa N, Tsujii T, Yamanishi Y, et al. A double-blind, randomized controlled trial of duloxetine for pain in Parkinson’ s disease. J Neurol Sci. 2020 Jul 15;414:116833.
34. Brefel-Courbon C, Harroch E, Marques A, Devos D, Thalamas C, Rousseau V, et al. Oxycodone or Higher Dose of Levodopa for the Treatment of Parkinsonian Central Pain: OXYDOPA Trial. Mov Disord. 2024 Jun 8.
35. Reuter I, Mehnert S, Leone P, Kaps M, Oechsner M, Engelhardt M. Effects of a flexibility and relaxation programme, walking, and nordic walking on Parkinson’ s disease. J Aging Res. 2011;2011:232473.
36. Huissoud M, Boussac M, Joineau K, Harroch E, Brefel-Courbon C, Descamps E. The effectiveness and safety of non-pharmacological intervention for pain management in Parkinson’ s disease: A systematic review. Rev Neurol (Paris). 2023 Oct 11.
37. Cury RG, Galhardoni R, Fonoff ET, Dos Santos Ghilardi MG, Fonoff F, Arnaut D, et al. Effects of deep brain stimulation on pain and other nonmotor symptoms in Parkinson disease. Neurology. 2014 Oct 14;83(16):1403-9.