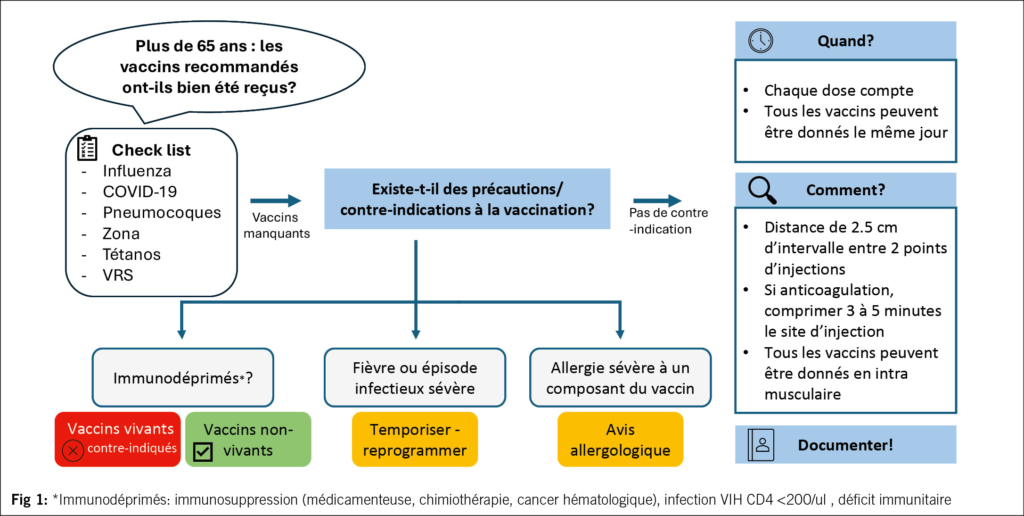
Einleitung
Gemäss der Definition der Society for Integrative Oncology (SIO) ist Integrative Onkologie «ein patientenzentriertes, evidenzinformiertes Gebiet der Krebstherapie, das Mind-Body-Verfahren, natürliche Produkte und/oder Lebensstiländerungen aus unterschiedlichen Traditionen begleitend zu den konventionellen Krebstherapien einsetzt. Die Integrative Onkologie versucht, Gesundheit, Lebensqualität und klinische Outcomes über den Behandlungsverlauf hinweg zu optimieren und Menschen zu befähigen, Krebs vorzubeugen und zu aktiven Teilnehmern vor und während der Krebsbehandlung sowie über diese hinaus zu werden» (1).
Häufig wird der Begriff «Integrative Onkologie» auch als «die Integration von komplementärmedizinischen Therapien in die konventionelle Onkologie» erklärt. Welche therapeutischen Verfahren ergänzend, d. h. komplementär zur konventionellen Therapie, angewendet werden, ist abhängig von den lokalen Gegebenheiten, wie beispielsweise kulturellen oder gesundheitspolitischen Aspekten. Es gibt bisher keine allgemein akzeptierte Definition von Komplementärmedizin, ausser dass diese ergänzend zur konventionellen Medizin eingesetzt wird. Die sinnvolle synergistische Kombination von Komplementärmedizin und konventioneller Medizin wird dann Integrative Medizin genannt (2). Im deutschsprachigen Raum sind beispielsweise «Gesamtsysteme» wie die Anthroposophisch erweiterte Medizin oder die Traditionelle Chinesische Medizin (TCM) verbreitete Methoden. Neben diesen «Gesamtsystemen» spielt beispielsweise die therapeutische Anwendung von Arzneipflanzen in der Integrativen Medizin bzw. Integrativen Onkologie eine wichtige Rolle, und die Herstellung von pflanzlichen Arzneimitteln folgt gesetzlich geregelten Prozessen. Zudem sind verschiedene nicht pharmakologische Therapien wie Akupunktur/Akupressur, Mindfulness-Based Stress Reduction (MBSR), Massageformen, achtsamkeitsbasierte Bewegungstherapien wie Tai Chi/Qi Gong, Yoga und Heileurythmie verbreitet, die teilweise ursprünglich ebenfalls aus den oben genannten «Gesamtsystemen» stammen.
Die Komplementärmedizin ist seit einer Volksabstimmung im Jahr 2009 in der Schweizerischen Verfassung verankert, und vier der komplementärmedizinischen Fachrichtungen werden durch die Grundversicherung erstattet, wenn sie von Ärzt/-innen ausgeübt werden, welche Inhaber/-in- nen eines entsprechenden SIWF-Fähigkeitsausweises sind. Diese sind aktuell Anthroposophisch erweiterte Medizin, Traditionelle Chinesische Medizin/Akupunktur, klassische Homöopathie und Phytotherapie (Pflanzenheilkunde). Bedingungen für einen solchen Fähigkeitsausweis sind ein Facharzttitel, um die 360 Stunden definierte Weiterbildung, eine Abschlussprüfung und regelmässige Rezertifizierung. Als Dachverband repräsentiert die UNION der komplementärmedizinischen Ärzteorganisationen diese vier Richtungen (3). Neuere komplementärmedizinische Richtungen, die gerade in der Onkologie eine grosse Rolle spielen und in der Schweiz ebenfalls verbreitet sind, sind die sogenannte Mind Body Medicine und die medizinische Hypnose. Sie werden durch den Schweizer Fachverband Mind Body Medicine (SFMBM) und die Schweizerische Ärztegesellschaft für Hypnose (SMSH) qualitätsgesichert. Zudem spielt die Integrative Pflege sowohl in der ambulanten als auch in der stationären Integrativen Onkologie eine zunehmende Rolle (siehe Abschnitt weiter unten) (4).
Die oben genannten Fachrichtungen weisen – zumindest teilweise – gewisse Gemeinsamkeiten auf, so z. B. das Inszentrumstellen der Salutogenese (5), ein Betonen von Lebensstilfaktoren, ein explizites Menschenbild (häufig multidimensional, ähnlich der Palliative Care) (6) und eine Individualisierung der Therapie. Diese Gemeinsamkeiten wurden bisher nicht explizit formuliert; eine solche gemeinsame Abstimmung von «Grundprinzipien» erscheint jedoch wichtig, um die konzeptuelle Basis für die Integrative Onkologie, wie sie in den Schweizer Krebszentren gelebt wird, festzuhalten. Das Formulieren solcher «Grundprinzipien» ist das Ziel eines Delphi Consensus des Swiss Network for Integrative Oncology (SNIO), der aktuell durchgeführt wird und mittels dessen mittelfristig auch Kriterien für hochqualitative Integrative Onkologie in Schweizer Krebszentren erstellt werden sollen.
Das Swiss Network for Integrative Oncology wurde 2024 als Zusammenschluss von zertifizierten Krebszentren, welche ein integrativ-onkologisches Angebot vorweisen, gegründet. Es hat zum Ziel, Zusammenarbeit, Qualität, Edukation und Forschung in der Integrativen Onkologie zu fördern. Bedingung für die volle Mitgliedschaft im Swiss Network for Integrative Oncology ist die mindestens zweimal monatliche Sprechstunde oder Konsilien durch einen Arzt/eine Ärztin mit einem Fähigkeitsausweis in einer der oben genannten komplementärmedizinischen Fachrichtungen, einem Fähigkeitsausweis in medizinischer Hypnose oder einem CAS in Mind Body Medicine oder jeweils einem Äquivalent (7).
Im Folgenden werden diese verschiedenen Fachrichtungen insbesondere im Zusammenhang mit der Onkologie vorgestellt. Die Inhalte der folgenden Unterkapitel werden (nur) von den aufgeführten Autoren der Subkapitel verantwortet.
Fazit und Ausblick
Diese Kerndisziplinen der Integrativen Onkologie beruhen auf unterschiedlichen Konzepten und Traditionen, greifen jedoch – wie bereits dargestellt – auf gemeinsame Grundhaltungen zurück.
Im Rahmen der Integrativen Onkologie werden diese Disziplinen grundsätzlich begleitend zu konventionellen Therapien eingesetzt und erfordern eine enge, transparente Kommunikation mit onkologischen Fachpersonen sowie Hausärztinnen und -ärzten.
Die Auswahl geeigneter Verfahren richtet sich nach verfügbarer Evidenz aus klinischer Erfahrung und Studien für die individuelle Indikation, der lokalen Verfügbarkeit und den Präferenzen der Betroffenen.
Das Swiss Network for Integrative Oncology verfolgt das Ziel, Qualitätskriterien zu entwickeln, Behandlungsangebote (auch zukünftige, wenn Qualitätskriterien erfüllt sind) zu vernetzen und Weiterbildungen zu fördern, um eine koordinierte und qualitätsgesicherte Versorgung zu ermöglichen.
Literatur
1. Witt CM, Balneaves LG, Cardoso MJ, Cohen L, Greenlee H, Johnstone P, Kücük Ö, Mailman J, Mao JJ. A Comprehensive Definition for Integrative Oncology. J Natl Cancer Inst Monogr. 2017 Nov 1;2017(52).
2. WHO-Definition: complementary medicine refers to additional healthcare practices that are not part of a country’s mainstream medicine. https://www.who.int/health-topics/traditional-complementary-and-integrative-medicine#tab=tab_1
3. www.unioncomed.ch
4. Lunde A, Gunnarsdottir T, Busch M, van der Heijden MJE, Falkenberg T, van Dijk M, Dürr DW. Integrative nursing in Europe – A competency profile for nursing students validated in a Delphi-study. Nurse Educ Today. 2023 Jul;126:105807.
5. Antonovsky A, Sagy S. Aaron Antonovsky (1923–1994): The Personal, Ideological, and Intellectual Genesis of Salutogenesis. 2022 Jan 1. In: Mittelmark MB, Bauer GF, Vaandrager L, Pelikan JM, Sagy S, Eriksson M, Lindström B, Meier Magistretti C, editors. The Handbook of Salutogenesis (Internet). 2nd ed. Cham (CH): Springer; 2022. Chapter 4. PMID: 36122003.
6. WHO Definition Palliative Care (https://www.who.int/news-room/fact-sheets/detail/palliative-care)
7. www.integrative-oncology.ch
Anthroposophisch erweiterte Medizin in der Integrativen Onkologie
Autorenschaft
Dr. med. Natalie Kalbermatten
PD Dr. med. Florian Strasser
Prof. Dr. med. Ursula Wolf
Einleitung und Definition
Die Anthroposophisch erweiterte Medizin (AEM) ist ein integrativer, multimodaler, ganzheitlicher und individueller Ansatz und vereint konventionelle Medizin mit spezifischen anthroposophisch-medizinischen Therapien. Sie wurzelt in Mitteleuropa (1) und wurde ab ca. 1910 (2) von Drs. Rudolf Steiner und Ita Wegman in Zusammenarbeit mit Ärzt/-innen und Pharmazeut/-innen entwickelt (3). Die AEM wird in vielen europäischen Ländern, auch global, praktiziert (4) und ist in Deutschland und in der Schweiz gut im Gesundheitswesen integriert (5, 6). In interprofessionellen Teams arbeiten Ärzt/-innen, Apotheker/-innen, Pflegefachpersonen, Kunst-, Heileurythmie- und Massagetherapeut/-innen und weitere Berufsgruppen zusammen (7). In ihrem ganzheitlichen Menschenbild berücksichtigt die AEM die körperlichen, vitalen, geistigen, spirituellen und sozialen Dimensionen eines Menschen (8). Durch die AEM-Linse betrachtet, stehen diese Dimensionen während des gesamten Lebenszyklus in ständiger Wechselwirkung, was bedeutet, dass eine Veränderung in einer Dimension sich auch auf die anderen Dimensionen auswirkt (9). Daher umfasst die AEM Therapien, die spezifisch auf eine oder mehrere dieser Dimensionen einwirken im Sinn eines «Whole Medical Systems» (10).
Diagnostik und therapeutisches Vorgehen
Die AEM ergänzt die üblichen diagnostischen Methoden der konventionellen Medizin mit zwei anthroposophisch-medizinischen diagnostischen Schlüsselkonzepten, namentlich der funktionellen Vier- und Dreigliederung des Menschen (11, 12, 13, 14). Nach anthroposophischem Verständnis (15) wird der menschliche Organismus nicht nur durch physikalische und chemische Kräfte geformt, sondern durch insgesamt vier Arten von Gestaltungskräften (funktionelle Viergliederung) (16). Diese können entweder direkt oder indirekt am Menschen wahrgenommen werden (3). Kurz formuliert, umfasst die funktionelle Viergliederung den physischen Körper (sichtbar u. a. an der Materie, quantifizierbar), die Lebensorganisation (Wachstum, Regeneration, Fortpflanzung), die Empfindungsorganisation (Emotionen, Schmerz, Freude, Sympathie, Antipathie) und die Ich-Organisation (Biografie) (17). Im Organismus wirken diese vier Kräfteorganisationen unterschiedlich in drei Funktionssystemen, die die funktionelle Dreigliederung bilden (11–14). Das Konzept wurzelt in dem methodischen Ansatz, dass Polaritäten sich gegenseitig beleuchten und damit dem Erkenntnisgewinn dienen können (Goethe) (18), welcher von Rudolf Steiner für die menschliche Gesundheit und Krankheit weiterentwickelt wurde. Die Dreigliedrigkeit umfasst das neurosensorische Nerven-Sinnes-System (NSS) und das Stoffwechsel-Gliedmassen-System (SWGS) als die beiden Pole und das Rhythmische System (RS) als das ausgleichende, vermittelnde System. Alle drei Systeme sind funktionell in allen Teilen des Organismus vorhanden, aber jedes hat einen vorherrschenden anatomischen Ort (NSS: Schädel/Kopf; RS: Brustkorb; SWGS: Bauchraum/untere Extremitäten). Die Wahrnehmung dieser Kräfte und Funktionssysteme ist klinisch lernbar und Teil der AEM-Diagnose und -Therapie. Verschiebt sich der dynamische Zustand zu sehr oder zu lange, kann ein Krankheitszustand entstehen, zuerst funktionell und bei längerem Bestehen organisch manifest. AEM zielt darauf ab, dieses dynamische Gleichgewicht zu erhalten oder wiederherzustellen.
Therapiert wird in der AEM mit Arzneimitteln und einer Vielfalt von «nicht medikamentösen» Therapien.
Die Arzneimittel werden aus Pflanzen, Mineralien, Metallen und tierischen Substanzen nach GMP und standardisierten AM-spezifischen pharmazeutischen Verfahren hergestellt (19) und haben einen ausgezeichneten Sicherheitsausweis (4). Sie werden in konzentrierter Form und als potenzierte Produkte (siehe Kapitel Homöopathie) angewendet (Vademecum Anthroposophische Arzneimittel https://www.gaed.de/vademecum).
Die Misteltherapie (Viscum album) ist eine der bekanntesten AEM-Behandlungen bei Krebs (20) mit adäquatem Sicherheitsprofil, auch bei onkologischen Immuntherapien (21, 22). Zur Misteltherapie liegen präklinische Daten vor, u. a. zur Immunmodulation (23, 24, 25) und Hemmung von Tumorzellwachstum (26, 27). Sie wird primär durch subkutane Injektionen verabreicht. Die Misteltherapie wird eingesetzt, um Nebenwirkungen herkömmlicher Krebsbehandlungen (z. B. Krebstherapie-assoziierte Fatigue) (28) und Symptome der aktiven Tumorerkrankung zu verringern (29, 30) sowie allgemein die Lebensqualität zu verbessern (31, 32, 33). Die deutsche S3-Guideline Komplementärmedizin (Version 2.0 – Mai 2024) hat eine «Kann»-Empfehlung ausgesprochen (Evidenz 1a) für eine subkutane Misteltherapie zur Verbesserung der Lebensqualität bei soliden Tumoren (34). Die Anwendung einer Misteltherapie (Wirtsbaumwahl, Produktwahl, Dosierungen, Intervalle, Begleitmedikation) sollte durch AEM-erfahrene Ärzt/-innen individualisiert erfolgen, mit Kenntnis der AEM-Diagnostik (s. o.) und allenfalls supportiven Begleitmassnahmen (z. B. Tagesrhythmen/Schlaf, Ernährung, äussere Anwendungen).
Massnahmen der Integrativen Pflege (siehe Kapitel IP) können in der AEM als äussere Anwendungen (https://pflege-vademecum.de/) (35), auch begleitend zur Misteltherapie, eingesetzt werden (z. B. Schafgarben-Leberwickel [36], Oxalis-Zwerchfellwickel, Lavendel- oder Rosmarinöl-Fusseinreibungen, Aurum/Lavandula/Rosen-Herzauflage). Bei chronischen Schmerzsyndromen können rhythmische Einreibungen mit Solum (37) erfolgen.
Zur Behandlung verschiedenster Beschwerden und Nebenwirkungen der Krebstherapie (z. B. Polyneuropathie, Schlafstörungen [siehe Artikel Survivorship] oder Strahlendermatitis) steht eine breite Palette von anthroposophisch-medizinischen Heilmitteln in Verbindung mit nicht medikamentösen Therapien zur Verfügung. Heileurythmie (38, 39) und Kunsttherapien (gestalterisch: Malen, Plastizieren) (40), Musik (41, 42), Sprachgestaltung (43) werden auch in der Onkologie eingesetzt, um die körperlichen Funktionen (z. B. bei Schmerzen oder Steifheit nach einer Operation), die Vitalität (z. B. bei Erschöpfung) und das emotionale Gleichgewicht (z. B. bei Ängsten, Depression) zu verbessern. Sie können, evtl. ergänzt mit Biografiearbeit (44), ebenfalls die Patient/-innen unterstützen, sich neu zu orientieren und Zukunftsperspektiven für ihr Leben zu finden.
Evidenz der Anthroposophisch erweiterten Medizin
Die Beurteilung der Wirksamkeit der AEM, welche seit vielen Jahrzehnten traditionell angewandt wird, umfasst ein Spektrum von AEM-Interventionen bis zum «Whole Medical System Research» (45) und sollte Eigenheiten der AEM berücksichtigen (46). Eine Evaluation erfolgte vertieft 2011 im Programm Evaluation Komplementärmedizin mit insgesamt 265 klinischen Studien, davon 253 mit positiven Ergebnissen für AEM-Interventionen (47) (s. o.). Die AMOS-Studie untersuchte AEM prospektiv bei 1631 Patient/-innen mit verschiedenen Indikationen, 21 Publikationen dokumentierten eine Wirksamkeit im «Real-World-Setting» (48). Die Herausforderung, die komplexe, dynamische, individualisierte (49) und interprofessionelle AEM zu erforschen, erfordert innovative und wissenschaftlich fundierte Konzepte (siehe Artikel Forschung).
Qualitätskriterien
Um eine wirksame, sichere und qualitätsgesicherte Anwendung der AEM zu gewährleisten, sind spezialisierte AEM-Ausbildungen, verfügbar für alle medizinischen Berufe (7) (z. B. Pflege Soleo-Akademie, Kunsttherapie und Heileurythmie Zertifikate SBFI), notwendig (siehe Artikel Edukation). Weitere allgemeine Qualitätskriterien umfassen die kooperative und transparente Absprache mit onkologischen Fachpersonen, auch bei Patient/-innen, die keine «Schulmedizin» möchten (siehe Artikel Edukation).
Fazit
Die AEM bietet ein breites Spektrum an risikoarmen und sicheren Therapiemöglichkeiten für Symptome und Erkrankungen innerhalb des Krebskontinuums.
Literatur
1. Kienle GS, Albonico HU, Baars E, et al. Anthroposophic medicine: an integrative medical system originating in Europe. Glob Adv Health Med 2013;2(6):20–31
2. Martin D. 100-year anniversary of anthroposophic medicine as an integrative medical system. Complement Med Res 2020;27(6):375–378
3. Steiner R, Wegmann I. Grundlegendes für eine Erweiterung der Heilkunst nach geisteswissenschaftlichen Erkenntnissen. GA 27, Erstausgabe 1925, 8. Unveränderte Auflage 2014. Rudolf Steiner Verlag, Basel
4. Baars EW, Kienle GS, Heusser P, Pedersen PA, van Wietmarschen HA, Kiene H, von Schoen-Angerer T, Hamre HJ. Anthroposophic Medicinal Products: A Literature Review of Features, Similarities and Differences to Conventional Medicinal Products, Scientific and Regulatory Assessment. Glob Adv Health Med. 2022 Mar 8;11:21649561211073079
5. Bartelme RR. Anthroposophic Medicine: a short monograph and narrative review – Foundations, essential characteristics, scientific basis, safety, effectiveness and misconceptions. Glob Adv Health Med 2020;9:2164956120973634
6. Von Schoen-Angerer T, Vagedes J, Schneider R, Vlach L, Pharisa C, Kleeb S, Wildhaber J, Huber BM. Acceptance, satisfaction and cost of an integrative anthroposophic program for pediatric respiratory diseases in a Swiss teaching hospital: An implementation report. Complement Ther Med. 2018 Oct;40:179-184.
7. WHO benchmarks for training in anthroposophic medicine 2023, World Health Organization: Geneva. https://www.who.int/publications/b/55791
8. Steiner, R., Introducing Anthroposophical Medicine: Spiritual Science and Medicine. Vol. CW312. 2010: SteinerBooks
9. Steiner, R., Understanding Healing: Meditative Reflections on Deepening Medicine through Spiritual Science. Vol. CW316. 2017: Rudolf Steiner Press
10. Baars EW, Hamre HJ. Whole medical systems versus the system of conventional biomedicine: a critical, narrative review of similarities, differences, and factors that promote the integration process. Evid Based Complement Alternat Med 2017;2017:4904930
11. Girke M. Innere Medizin, Grundlagen und therapeutische Konzepte der Anthroposophischen Medizin. Salumed 2020 (3. Auflage). Kapitel III Die Krankheitslehre; Die Anamnesefragen (Unterkapitel 3: 67-82), Klinische Untersuchung des Patienten (Unterkapitel 4: 82-100), Von der Diagnose zur Therapie (Unterkapitel 5: 100-104).
12. Fintelmann V. Intuitive Medizin-Anthroposophische Medizin in der Praxis; Grundlagen-Indikationen-Therapiekonzepte. Hippokrates Verlag, 5. Auflage, 2007.
13. Husemann F. Anthroposophische Medizin, Ein Weg zu den heilenden Kräften. Verlag am Goetheanum; 2009.
14. Treichel M, Reiner J. Anthroposophie-basierte Psychotherapie; Grundlagen – Methoden – Indikationen – Praxis. Salumed Verlag 2019, Kapitel VI: anthroposophie-basierte Psychotherapie in der Praxis
15. Einführung in das Menschenverständnis der Anthroposophischen Medizin. https://www.anthromedics.org/BAS-0319-DE
16. Steiner R. Der unsichtbare Mensch in uns. Dass der Therapie zugrunde liegende Pathologische. Vortrag 11.2.1932, Dornach. In: Erdenwissen und Himmelserkenntnis, GA 221, Dornach 1998
17. Steiner, R., Understanding Healing: Meditative Reflections on Deepening Medicine through Spiritual Science. Vol. CW316. 2017: Rudolf Steiner Press.
18. https://link.springer.com/chapter/10.1007/978-3-476-03656-8_76
19. Anthroposophischer Arzneimittelkodex APC, EDITION 5.1, 2024
20. Thronicke A, Schad F, Debus M, Grabowski J, Soldner G. Viscum album L. Therapy in Oncology: An Update on Current Evidence. Complement Med Res. 2022;29(4):362-368
21. Thronicke A, Steele ML, Grah C, Matthes B, Schad F. Clinical safety of combined therapy of immune checkpoint inhibitors and Viscum album L. therapy in patients with advanced or metastatic cancer. BMC Complement Altern Med. 2017 Dec 13;17(1):534
22. Schad F, Axtner J, Kröz M, Matthes H, Steele ML. Safety of Combined Treatment With Monoclonal Antibodies and Viscum album L Preparations. Integr Cancer Ther. 2018 Mar;17(1):41-51
23. Bonamin, L. V., de Carvalho, A. C. & Waisse, S. Viscum album (L.) in experimental animal tumors: A meta-analysis. Exp Ther Med 13, 2723-2740 (2017)
24. Oei SL, Thronicke A, Schad F. Mistletoe and Immunomodulation: Insights and Implications for Anticancer Therapies. Evid Based Complement Alternat Med. 2019 Apr 17;2019:5893017
25. Hajto, T. et al. Effect of a recombinant lectin, Viscum album agglutinin on the secretion of interleukin-12 in cultured human peripheral blood mononuclear cells and on NK-cell-mediated cytotoxicity of rat splenocytes in vitro and in vivo. Nat Immun 16, 34-46 (1998).
26. Juengel E, Rutz J, Meiborg M, Markowitsch SD, Maxeiner S, Grein T, Thomas A, Chun FK, Haferkamp A, Tsaur I, Vakhrusheva O, Blaheta RA. Mistletoe Extracts from Different Host Trees Disparately Inhibit Bladder Cancer Cell Growth and Proliferation. Cancers (Basel). 2023 Oct 4;15(19):4849
27. Yang P, Jiang Y, Pan Y, Ding X, Rhea P, Ding J, Hawke DH, Felsher D, Narla G, Lu Z, Lee RT. Mistletoe extract Fraxini inhibits the proliferation of liver cancer by down-regulating c-Myc expression. Sci Rep. 2019 Apr 23;9(1):6428.
28. Pelzer F, Loef M, Martin DD, Baumgartner S. Cancer-related fatigue in patients treated with mistletoe extracts: a systematic review and meta-analysis. Support Care Cancer. 2022 Aug;30(8):6405-6418
29. Tröger W, Galun D, Reif M, Schumann A, Stankovi? N, Mili?evi? M. Quality of life of patients with advanced pancreatic cancer during treatment with mistletoe: a randomized controlled trial. Dtsch Arztebl Int. 2014 Jul 21;111(29-30):493-502, 33 p following 502
30. Wode K, Kienle GS, Björ O, Fransson P, Sharp L, Elander NO, Bernhardson BM, Johansson B, Edwinsdotter Ardnor C, Scheibling U, Hök Nordberg J, Henriksson R. Mistletoe Extract in Patients With Advanced Pancreatic Cancer: a Double-Blind, Randomized, Placebo-Controlled Tial (MISTRAL). Dtsch Arztebl Int. 2024 May 31;121(11):347-354.
31. Kienle GS, Kiene H. Complementary cancer therapy: a systematic review of prospective clinical trials on anthroposophic mistletoe extracts. Eur J Med Res. 2007 Mar 26;12(3):103-19.
32. Kienle GS, Kiene H. Review article: Influence of Viscum album L (European mistletoe) extracts on quality of life in cancer patients: a systematic review of controlled clinical studies. Integr Cancer Ther. 2010 Jun;9(2):142-57
33. Loef M, Paepke D, Walach H. Quality of Life in Breast Cancer Patients Treated With Mistletoe Extracts: A Systematic Review and Meta-Analysis. Integr Cancer Ther. 2023 Jan-Dec;22:1534735423119807
34. https://www.leitlinienprogramm-onkologie.de/leitlinien/komplementaermedizin/
35. Mühlenpfordt I, Blakeslee SB, Everding J, Cramer H, Seifert G, Stritter W. Touching body, soul, and spirit? Understanding external applications from integrative medicine: A mixed methods systematic review. Front Med (Lausanne). 2022 Dec 22;9:960960.
36. Ghadjar P, Stritter W, von Mackensen I, Mehrhof F, Foucré C, Ehrhardt VH, Beck M, Gebert P, Kalinauskaite G, Luchte JS, Stromberger C, Budach V, Eggert A, Seifert G. External application of liver compresses to reduce fatigue in patients with metastatic cancer undergoing radiation therapy, a randomized clinical trial. Radiat Oncol. 2021 Apr 19;16(1):76.
37. Ostermann T, Blaser G, Bertram M, Michalsen A, Matthiessen PF, Kraft K. Effects of rhythmic embrocation therapy with solum oil in chronic pain patients: a prospective observational study. Clin J Pain. 2008 Mar-Apr;24(3):237-43
38. Büssing A, Ostermann T, Majorek M, Matthiessen PF. Eurythmy Therapy in clinical studies: a systematic literature review. BMC Complement Altern Med. 2008 Mar 31;8:8.
39. Lötzke D, Heusser P, Büssing A. A systematic literature review on the effectiveness of eurythmy therapy. J Integr Med. 2015 Jul;13(4):217-30
40. Abbing A, Baars EW, de Sonneville L, Ponstein AS, Swaab H. The Effectiveness of Art Therapy for Anxiety in Adult Women: A Randomized Controlled Trial. Front Psychol. 2019 May 29;10:1203
41. Kamioka H, Tsutani K, Yamada M, et al. Effectiveness of music therapy: a summary of systematic reviews based on randomized controlled trials of music interventions. Patient Prefer Adherence 2014;8:727–754.
42. Boyde C, Berger B, Längler A, Neugebauer L, Jacobsen SL, Swanick R, Gaebel C, Schneider D, Bernbeck B, Paulussen M, Ostermann T, Hunger-Schoppe C. Interaction-focused music therapy with cancer-affected children and their significant others: a randomized controlled feasibility study with subsequent intervention (INMUT). Pilot Feasibility Stud. 2024 May 28;10(1):86
43. Hotho G, von Bonin D, Krüerke D, Wolf U, Cysarz D. Unexpected Cardiovascular Oscillations at 0.1 Hz During Slow Speech Guided Breathing (OM Chanting) at 0.05 Hz. Front Physiol. 2022 May 10;13:875583
44. Thronicke A, Kröz M, Merkle A, Matthes H, Herbstreit C, Schad F. Psychosocial, Cognitive, and Physical Impact of Elaborate Consultations and Life Review in Female Patients with Non-Metastasized Breast Cancer. Complement Med Res. 2018;25(2):92-101.
45. Kienle GS, Ben-Arye E, Berger B, et al. Contributing to global health: development of a consensus-based whole systems research strategy for anthroposophic medicine. Evid Based Complement Alternat Med 2019;2019:3706143.
46. Baars EW, Kiene H, Kienle GS, et al. An assessment of the scientific status of anthroposophic medicine, applying criteria from the philosophy of science. Complement Ther Med 2018;40:145–150
47. Kienle GS, Glockmann A, Grugel R, et al. Klinische Forschung zur Anthroposophischen Medizin – Update eines „Health Technology Assessment“-Berichts und Status Quo. (Clinical research on anthroposophic medicine: update of a health technology assessment report and status quo.) Forsch Komplementmed 2011;18(5):269–282
48. Hamre HJ, Kiene H, Ziegler R, et al. Overview of the publications from the Anthroposophic Medicine Outcomes Study (AMOS): A whole system evaluation study. Glob Adv Health Med 2014;3(1):54–70.
49. Koster EB, Baars EW, Delnoij DMJ. Patient-reported quality of care in anthroposophic and integrative medicine: A scoping review. Patient Educ Couns 2020;103(2):276–285
Klassische Homöopathie in der Integrativen Onkologie
Autor
PD Dr. med. Florian Strasser
Einleitung und Definitionen
Die klassische Homöopathie (KH) basiert auf dem Ansatz, für individuelle, idealerweise einzigartige, Symptome eines Menschen ein darauf möglichst gut passendes Arzneimittel (sog. Simile) zu finden.
Die umfassende Anamnese zur Symptomsammlung mit offener und strukturierter Befragung, die «Homöopathische Anamnese», mit Systemanamnese und Themen wie Ernährungspräferenzen (Geschmacksqualitäten; fettig), Erleben von Wärme/Kälte und Sonnenlicht/Durchzug, seelischen Themata, Schlafrhythmen. Idealerweise wird ein «einzigartiges» Symptom («§ 153 Symptom»: z. B. Halsschmerzen besser durch Schlucken von festen Speisen oder Verlangen nach Entblössen bei Kälte) gefunden.
Für jedes homöopathische Arzneimittel erfolgt eine Arzneimittelprüfung: Gesunde Probanden beschreiben neue Symptome, zusammen mit toxikologischen und klinischen Beobachtungen entsteht das «Arzneimittelbild». Die homöopathischen Präparate sind potenziert und gelistet (Europäische Pharmakopöe). Zur Potenzierung wird eine Substanz (Pflanzenteile, Tierprodukte, chemisch definierte Stoffe, Mineralien) wiederholt 1:10/1:100 verdünnt und intensiv verschüttelt/verrieben. Damit werden auch Arzneimittel von unverträglichen (z. B. Silber, Jod, Petrol) oder giftigen (Schlangengift, Eisenhut, Arsen) Substanzen hergestellt. Die Wirkung von homöopathischen Hochpotenzen (ohne nachweisbare Moleküle) kann u. a. Modifikationen der Moleküldynamik betreffen (1, 2) neben insgesamt 14 verschiedenen theoretischen Modellen (3) und erklärt werden durch eine Erweiterung des naturwissenschaftlichen Materieverständnisses (4).
Ein passendes Arzneimittel wird in der Arzneimittel-Symptomsammlung («Materia medica») gesucht mithilfe eines «Repertoriums» (Bücher, Software).
Die Verlaufsbeobachtung evaluiert den Symptomverlauf und allgemeine Verlaufsparameter (Energieniveau, Wohlbefinden, Temperaturempfindlichkeiten, Appetit, Menses, Schlaf etc.) und fokussiert auf eine Erstreaktion, die Krankheitsentwicklung und die Entwicklung der Symptome nach der Anwendung des homöopathischen Arzneimittels. Bei akuten Verletzungen oder Infekten existieren sog. bewährte Arzneimittel, die mittels einer sehr kurzen Anamnese ermittelt werden können (Commotio, Distorsion, Insektenstich, Otitis media etc.).
Die KH erfordert eine ärztliche Weiterbildung mit SIWF-Fähigkeitsausweis Homöopathie (SVHA) (5). Daneben existieren nicht ärztliche Ausbildungen (eidgenössisches Diplom, Abrechnung nur über Zusatzversicherung).
Der Begriff Homöopathie wird auch verwendet (6) bei Anwendung von potenzierten Arzneimitteln bei Situationen mit allgemeinen Krankheitsbegriffen (z. B. «Schnupfen/Erkältung», «Gelenkschmerzen»), aber ohne individualisierte Anamnese und Arzneimittelwahl. Eine Umfrage bei allen Ärzten des Kantons Zürich (n = 4052, Antwortrate 38 %; 2.4 % homöopathische Spezialisten) (7) zeigte, dass 23 % mind. 1 x/Jahr homöopathische Arzneimittel verschrieben, davon 50.4 % mit Erwartungen an eine spezifische Wirkung und 21.4 % eines Placeboeffekts; 53 % aller Ärzte unterstützen den Einsatz von homöopathischen Arzneimitteln (8).
Diagnostik und therapeutisches Vorgehen der KH in der Integrativen Onkologie
Die KH-Erstkonsultation beinhaltet typischerweise eine fokussierte körperliche Untersuchung, aber keine speziellen Laboruntersuchungen. Die homöopathische Behandlung erfolgt begleitend zur onkologischen Behandlung.
Bei krebsbetroffenen Menschen können akute Nebenwirkungen (Toxizität) der krebsspezifischen Behandlung oder der Krebserkrankung und deren Folgen (z. B. Fatigue, CINP, Angst, Schlafprobleme, Wallungen [9], postoperatives Serom/Blutungen nach Mastektomie) [10]) mit einer (typischen, nur teilweise individualisierten) Auswahl (s. o.) von homöopathischen Arzneimitteln behandelt werden (11), dies als Teil einer supportiven onkologischen Behandlung (12). Diese wird in Frankreich von einer Mehrheit von Onkologen unterstützt (13) und in Strasbourg von 1/3 der Patienten angewendet (14). Bei 98 009 Patientinnen mit neuer Brustkrebsdiagnose und Mastektomie (nationales französisches Datenregister) bekam jede 4. Frau homöopathische Arzneimittel, die supportive Medikation für Nebenwirkungen der Krebstherapie war signifikant weniger bei ≥ 3 homöopathischen Dosen (15). Die günstige und nebenwirkungsarme homöopathische Behandlung mit fokussierter Anamnese wird in ressourcenarmen Situationen gerne eingesetzt (16).
Die Risiken der KH sind klein aufgrund der minimalen substanziellen Arzneimittelwirkung.
Evidenzlage der Homöopathie
Die Grundlagenforschung (17) untersucht die Frage, ob potenzierte homöopathische Arzneimittel spezifische Wirkungen zeigen im Vergleich zu nicht potenzierten Arzneimitteln: Die Datenlage unterstützt mit Evidenz aus physikalisch-chemischen (18), In-vitro- (19), Pflanzen- (20) und Tier- (21)-basierten Experimenten eine solche Wirkung, die aber nicht mit einer heute verfügbaren Begrifflichkeit und Messmethode definiert werden kann.
Die Datenlage der klinischen Homöopathieforschung basiert auf mehreren Hundert randomisierten Studien (z. B. Insomnie [22]) mit vielen Metaanalysen zu verschiedenen spezifischen Indikationen (z. B. schwere Depression [23], Fibromyalgie [24]). Der indikationsübergreifende Unterschied von Homöopathie und Placebo wurde in sechs Metaanalysen untersucht, welche zusammengefasst wurden (25), mit besserer Gesamtwirkung allgemeiner Homöopathie als Placebo. Die Gesamtevidenz für Homöopathie (hoch/moderat/niedrig/sehr niedrig) war hoch für KH (Metaanalyse mit niedrigem [26] und hohem [27] Verzerrungsrisiko) und moderat für nicht individualisierte Homöopathie (niedriges Verzerrungsrisiko [28]).
Eine individualisierte KH-Behandlung wurde bei onkologischen Patienten in vier randomisierten Studien eingesetzt (29). Zwei «Single-center»-Pilotstudien (Glasgow/UK, n = 47) (30); Seattle/USA, n = 83) (31) dokumentierten Hinweise für bessere Wirkung gegenüber Placebo von KH (Vergleich 1:1) oder einer homöopathischen Einzel- oder Kombinationssubstanz (Vergleich 1:2). Eine «Single-center»-Studie dokumentierte bei 194 Patienten mit KH parallel zur systemischen Krebstherapie Hinweise für bessere Lebensqualität gegenüber 179 Kontrollpatienten (32). Eine nachfolgende doppelblind-placebokontrollierte randomisierte Studie dokumentierte bei 98 Menschen mit fortgeschrittenem Lungenkarzinom (NSCLC) positive Effekte von KH als ergänzende supportive Behandlung im Vergleich zu Placebo auf Lebensqualität und Gesamtüberleben (33). Die Studie wurde kritisiert aus konzeptueller «Generalkritik» (34) und methodischen Gründen (35), die fehlenden methodischen Angaben wurden nach vertiefter Analyse ergänzt (36).
Die Placeboforschung dokumentiert Hinweise für bessere Wirkungen von «aktivem» Placebo (der Patient wird informiert, sog. open-label) (37) gegenüber klassischem Placebo (38). In der individualisierten Homöopathie werden den Patienten typischerweise keine Informationen abgegeben über die erwartete Wirkung des Arzneimittels.
Qualitätskriterien und Zusammenarbeit mit weiteren Disziplinen der Integrativen Onkologie
Der Einsatz von KH in der (komplexen) Onkologie erfordert sehr gute Zusammenarbeit und proaktive, transparente Kommunikation und Absprache mit onkologischen und anderen integrativ-medizinischen Disziplinen. Dazu gehört auch eine aktive Zuweisung bei ungenügenden Effekten oder (zu) hohen Erwartungen von Patienten (siehe Artikel Edukation).
Fazit
Die KH kann als eine von Patient/-innen oft erwünschte, nebenwirkungsarme und wissenschaftlich belegte Behandlungsform in der Integrativen Onkologie eingesetzt werden, sofern eine transparente und proaktive Zusammenarbeit mit onkologischen Fachpersonen gewährleistet wird.
Literatur
1. Cartwright SJ. Homeopathic potencies may possess an electric field(-like) component: evidence from the use of encapsulated solvatochromic dyes. Homeopathy. 2020;109(1):14-22
2. Pinto A, Nagai M, Coimbra EN, et al. Bioresilience to Mercury Chloride of the Brine Shrimp Artemia Salina after Treatment with Homeopathic Mercurius Corrosivus. Homeopathy. 2021;110(4):244-55.
3. Dombrowsky C, Klein SD, Würtenberger S, Baumgartner S, Tournier AL. Mapping the Theories and Models on the Mode of Action of Homeopathy: A Scoping Review. J Integr Complement Med. 2025 Jun 11.
4. Kiene H, Hamre HJ. Eine zentrale Frage zur Komplementärmedizin: Gibt es in der Natur ausser den physikalischen Grundkräften noch weitere Kräfte? Complement Med Res 2024;31(1): 64–70.
5. https://svha.ch/f_higkeitsausweis_hom_opathie
6. https://www.ikim.unibe.ch/forschung/uebersichten_zum_stand_der_forschung/homoeopathie/index_ger.html
7. Markun S, Maeder M, Rosemann T, Djalali S. Beliefs, endorsement and application of homeopathy disclosed: a survey among ambulatory care physicians. Swiss Med Wkly. 2017 Oct 12;147:w14505.
8. Righetti M, von Ammon K, Malchow H, Frei-Erb M, Bläuer F, Etter G. Comments on the Article ‚Beliefs, Endorsement and Application of Homeopathy Disclosed: A Survey among Ambulatory Care Physicians‘ by Markun et al. Complement Med Res. 2018;25(6):417-418.
9. Heudel PE, Van Praagh-Doreau I, Duvert B, Cauvin I, Hardy-Bessard AC, Jacquin JP, Stefani L, Vincent L, Dramais D, Guastalla JP, Blanc E, Belleville A, Lavergne E, Pérol D. Does a homeopathic medicine reduce hot flushes induced by adjuvant endocrine therapy in localized breast cancer patients? A multicenter randomized placebo-controlled phase III trial. Support Care Cancer. 2019 May;27(5):1879-1889
10. Sorrentino L, Piraneo S, Riggio E, Basilicò S, Sartani A, Bossi D, Corsi F. Is there a role for homeopathy in breast cancer surgery? A first randomized clinical trial on treatment with Arnica montana to reduce post-operative seroma and bleeding in patients undergoing total mastectomy. J Intercult Ethnopharmacol. 2017 Jan 3;6(1):1-8.
11. Bagot JL. Krebs und Homöopathie. narayana-verlag 2020. ISBN: 978-3-944125-15-2
12. Theunissen I, Bagot JL. Supportive cancer care: is integrative oncology the future? Curr Opin Oncol. 2024 Jul 1;36(4):248-252
13. Bagot JL, Theunissen I, Serral A. Perceptions of homeopathy in supportive cancer care among oncologists and general practitioners in France. Support Care Cancer. 2021 Oct;29(10):5873-5881
14. Bagot JL, Legrand A, Theunissen I. Use of Homeopathy in Integrative Oncology in Strasbourg, France: Multi-center Cross-Sectional Descriptive Study of Patients Undergoing Cancer Treatment. Homeopathy. 2021 Aug;110(3):168-173.
15. Medioni J, Scimeca D, Lopez Marquez Y, Leray E, Dalichampt M, Hoertel N, Bennani M, Trempat P, Boujedaini N. Benefits of Homeopathic Complementary Treatment in Patients With Breast Cancer: A Retrospective Cohort Study Based on the French Nationwide Healthcare Database. Clin Breast Cancer. 2023 Jan;23(1):60-70.
16. Tangelloju A, Chakravarti R, Singh R, Bhattacharya B, Ghosh A, Bhutia SK, Ravichandiran V, Ghosh D. A Review on the Current Status of Homeopathy in the Clinical Manage-ment of Cancer. Curr Drug Targets. 2022;23(13):1252-1260
17. https://www.ikim.unibe.ch/forschung/uebersichten_zum_stand_der_forschung/homoeopathie/index_ger.html. accessed August 2025.
18. Tournier A, Würtenberger S, Klein SD, Baumgartner S. Physicochemical investigations of homeopathic preparations: a systematic review and bibliometric analysis, Part 3. J Altern Complement Med. 2021;27(1):45-57
19. Witt CM, Bluth M, Albrecht H, Weisshuhn TE, Baumgartner S, Willich SN. The in vitro evidence for an effect of high homeopathic potencies – a systematic review of the literature. Complement Ther Med. 2007;15(2):128-38.
20. Ücker A, Baumgartner S, Martin D, Jäger T. Critical evaluation of specific efficacy of preparations produced according to European Pharmacopeia Monograph 2371. Biomedicines. 2022;10(3).
21. Bonamin LV, Cardoso TN, de Carvalho AC, Amaral JG. The use of animal models in homeopathic research – a review of 2010-2014 PubMed indexed papers. Homeopathy. 2015;104(4):283-91
22. Michael J, Singh S, Sadhukhan S, Nath A, Kundu N, Magotra N, Dutta S, Parewa M, Koley M, Saha S. Efficacy of individualized homeopathic treatment of insomnia: Double-blind, randomized, placebo-controlled clinical trial. Complement Ther Med. 2019 Apr;43:53-59
23. Rotella F, Cassioli E, Falone A, Ricca V, Mannucci E. Homeopathic Remedies in Psychiatric Disorders: A Meta-analysis of Randomized Controlled Trials. J Clin Psychopharmacol. 2020 May/Jun;40(3):269-275.
24. Boehm K, Raak C, Cramer H, Lauche R, Ostermann T. Homeopathy in the treatment of fibromyalgia–a comprehensive literature-review and meta-analysis. Complement Ther Med. 2014 Aug;22(4):731-42
25. Hamre HJ, Glockmann A, von Ammon K, Riley DS, Kiene H. Efficacy of homeopathic treatment: Systematic review of meta-analyses of randomised placebo-controlled homeopathy trials for any indication. Syst Rev. 2023;12:191.
26. Mathie RT, Lloyd SM, Legg LA, Clausen J, Moss S, Davidson JR, Ford I. Randomised placebo-controlled trials of individualised homeopathic treatment: systematic review and meta-analysis. Syst Rev. 2014 Dec 6;3:142
27. Linde K, Melchart D. Randomized controlled trials of individualized homeopathy: a state-of-the-art review. J Altern Complement Med. 1998 Winter;4(4):371-88.
28. Mathie RT, Ramparsad N, Legg LA, Clausen J, Moss S, Davidson JR, Messow CM, McConnachie A. Randomised, double-blind, placebo-controlled trials of non-individualised homeopathic treatment: systematic review and meta-analysis. Syst Rev. 2017 Mar 24;6(1):63.
29. Wagenknecht A, Dörfler J, Freuding M, Josfeld L, Huebner J. Homeopathy effects in patients during oncological treatment: a systematic review. J Cancer Res Clin Oncol. 2023 May;149(5):1785-1810
30. Thompson EA, Montgomery A, Douglas D, Reilly D (2005) A pilot, randomized, double-blinded, placebo-controlled trial of individualized homeopathy for symptoms of estrogen withdrawal in breast-cancer survivors. J Altern Complement Med 11(1):13–20.
31. Jacobs J, Herman P, Heron K, Olsen S, Vaughters L (2005) Homeopathy for menopausal symptoms in breast cancer survivors: a preliminary randomized controlled trial. J Altern Complement Med 11(1):21–27
32. Frass M, Friehs H, Thallinger C, Sohal NK, Marosi C, Muchitsch I, Gaertner K, Gleiss A, Schuster E, Oberbaum M (2015) Influence of adjunctive classical homeopathy on global health status and subjective wellbeing in cancer patients—a pragmatic randomized controlled trial. Complement Ther Med 23(3):309–317
33. Frass M, Lechleitner P, Gründling C, Pirker C, Grasmuk-Siegl E, Domayer J, Hochmair M, Gaertner K, Duscheck C, Muchitsch I, Marosi C, Schumacher M, Zöchbauer-Müller S, Manchanda RK, Schrott A, Burghuber O. Homeopathic Treatment as an Add-On Therapy May Improve Quality of Life and Prolong Survival in Patients with Non-Small Cell Lung Cancer: A Prospective, Randomized, Placebo-Controlled, Double-Blind, Three-Arm, Multicenter Study. Oncologist. 2020 Dec;25(12):e1930-e1955.
34. Schulz VM, Ücker A, Scherr C, Tournier A, Jäger T, Baumgartner S. Systematic review of conceptual criticisms of homeopathy. Heliyon. 2023 Oct 21;9(11):e21287
35. Expression of Concern: Homeopathic Treatment as an Add-On Therapy May Improve Quality of Life and Prolong Survival in Patients with Non-Small Cell Lung Cancer: A Prospective, Randomized, Placebo-Controlled, Double-Blind, Three-Arm, Multicenter Study. Oncologist. 2022 Dec 9;27(12):e985.
36. Correction to: Homeopathic Treatment as an Add-On Therapy May Improve Quality of Life and Prolong Survival in Patients with Non-Small Cell Lung Cancer: A Prospective, Randomized, Placebo-Controlled, Double-Blind, Three-Arm, Multicenter Study. Oncologist. 2024 Nov 4;29(11):e1631-e1632.
37. Yennurajalingam S, Azhar A, Lu Z, Rodriguez AJ, Arechiga AB, Guerra-Sanchez M, Stanton P, Andersen CR, Urbauer DL, Bruera E. Open-Label Placebo for the Treatment of Cancer-Related Fatigue in Patients with Advanced Cancer: A Randomized Controlled Trial. Oncologist. 2022 Dec 9;27(12):1081-1089
38. Laursen DR, Nejstgaard CH, Bjørkedal E, Frost AD, Hansen MR, Paludan-Müller AS, Prosenz J, Werner CP, Hróbjartsson A. Impact of active placebo controls on estimated drug effects in randomised trials: a systematic review of trials with both active placebo and standard placebo. Cochrane Database Syst Rev. 2023 Mar 6;3(3):MR000055
Medizinische Hypnose
Autorinnen
Dr. med. Natacha Bordry
Prof. Dr. med. Chantal Berna
Einleitung und Definition
Hypnose ist eine Intervention, die Körper und Geist einbezieht und einen Zustand fokussierter Aufmerksamkeit und erhöhter Suggestibilität herbeiführt (1). Sie wird eingesetzt, um Patienten dabei zu helfen, ihre Wahrnehmungen, Empfindungen und Reaktionen auf Symptome zu verändern (2). Dieser psychologische Zustand wird durch geführte therapeutische Kommunikation, positive Sprache und massgeschneiderte Suggestionen erreicht, unterstützt durch eine starke Beziehung zwischen Therapeuten und Patient (3). Die klinische Hypnose, angewandt von ausgebildeten Therapeut/-innen, wird bei Krebspatienten (noch) wenig angewandt (4), möglicherweise bedingt durch begrenztes Bewusstsein, begrenzte Verfügbarkeit und verbreitete Missverständnisse – wie Ängste, die Kontrolle zu verlieren oder manipuliert zu werden (5).
Der Begriff Hypnose kann auch verwendet werden bei Anwendung einer Sprache («kommunikative Hypnose») mit Vermeidung negativer Formulierungen (z. B. wird «das wird stechen» ersetzt durch «diese Medikation betäubt die Stelle») und Optimierung von Patientenerwartungen (6). Die bewusste Fokussierung auf positive Lebens- und Erfahrungsaspekte wie Dankbarkeit (7, 8), eigene Ressourcen (9) und Lebenssinn (10, 11), als einzelne Massnahmen oder kombiniert als «Positive Psychologie Intervention» (12), enthält auch Elemente der Hypnose, es kann der Begriff Selbsthypnose verwendet werden. Dies betrifft auch Veränderungen der eigenen Denkweise (Mindset-Change) mit wachsender neurowissenschaftlicher Grundlage (13) und viele Aspekte der Kognitiven Verhaltenstherapie (KVT) (14) (z. B. bei Insomnie [15] oder Fatigue [16], siehe Kapitel Survivorship). Bei vielen Mind-Body-Interventionen spielen (selbst-)hypnotische Elemente eine Rolle (siehe Kapitel Mind Body Medicine), auch bei Anwendung von Open-label-Placebo (17, 18).
Klinische Anwendungen von Therapeut/-innen geleiteten Hypnosen werden zunehmend in der perioperativen Anästhesie (19) eingesetzt, bei menopausalen Symptomen (20) und auch in der Onkologie (s. u.).
Diagnostik und therapeutischer Ansatz
Eine sorgfältige diagnostische Beurteilung des Patienten ist notwendig, um Sicherheit und Eignung der klinischen Hypnosetherapie zu gewährleisten. Wichtige Aspekte ist der medizinische und psychologische Zustand des Patienten, seine Bereitschaft sowie das Fehlen wesentlicher Gegenanzeigen.
Zu den wichtigsten Kontraindikationen der klinischen Hypnose gehören:
• schwere psychotische Erkrankungen wie Schizophrenie und paranoide Störungen
• starke dissoziative Störungen
• aktive Wahnvorstellungen oder Halluzinationen
• schwere kognitive Beeinträchtigungen und Demenz
• nicht kontrollierte Epilepsie
• akute Intoxikationen oder aktueller Konsum von Substanzen, die die Bewusstseinslage stark beeinträchtigen (z. B. Alkohol, Drogen)
Zur Diagnose gehören auch die Klärung und Vereinbarung der Indikation resp. des individuellen Ziels der klinischen Hypnosetherapie.
Klinische Hypnose wird klassischerweise in Einzelgesprächen von Fachleuten – Ärzten, Psychologen oder Pflegekräften mit zertifizierter Expertise (21) in klinischer Hypnose – durchgeführt. Indikationen für Gruppensitzungen umfassen z. B. Stressbewältigung, Angststörungen, bestimmte Suchterkrankungen (z. B. Rauchentwöhnung) oder Unterstützung bei chronischen Erkrankungen, bei denen die Stärkung der persönlichen Ressourcen in der Gruppe vorteilhaft ist.
Der Prozess der klinischen Hypnosesitzung dauert von wenigen Minuten bis 1–3 Stunden und umfasst üblicherweise:
• Induktion in einen entspannten, fokussierten Zustand
• Übermittlung personalisierter Suggestionen und Nutzung mentaler Bilder, z. B.
– zur Veränderung der Wahrnehmung von Symptomen
– zum Kennenlernen von «inneren Familienmitgliedern»
– zum Entdecken und Stärkung sog. innerer Kraftwesen
• allmähliche Rückkehr zum normalen Bewusstsein
Das Intervall zwischen Sitzungen der klinischen Hypnose umfasst typischerweise 1–3 Wochen, angepasst an die individuelle Situation, den Zustand des Patienten und die Art des Problems. Die Behandlungsdauer variiert je nach Bedarf.
Evidenz der klinischen Hypnose und Hauptindikationen in der Integrativen Onkologie
Die Datenlage für die potenzielle Wirksamkeit von klinischer Hypnose in der Onkologie nimmt zu, angewandt sowohl in Einzelsitzungen als auch in Selbsthypnoseformaten (1, 22). Es werden positive Effekte auf Angst, Schmerz (postoperativ, neuropathisch), Nausea, Fatigue, Medikamentenverbrauch und Hospitalisationsdauer sowie auf depressive Symptome, Insomnie, Hitzewallungen und Lebensqualität gezeigt (23).
Prozedurale Angst
Hypnose wird (ASCO-/SIO-Guideline) (24) empfohlen bei diagnostischen und therapeutischen Prozeduren in der Onkologie (intermediäre Evidenz, moderate Empfehlung).
Perioperativ-Hypnosedierung
Beispielhaft zeigte eine randomisierte Studie (Aufmerksamkeitskontrolle), dass eine 15-Minuten-Hypnosesitzung (Psychologe: geführte Imagination zur Muskelrelaxation, angenehme innere Bilder/Friede, spezifische «innere Linderung» von Nausea, postoperativer Schmerz) vor Brustkrebsoperation eine verbesserte Schmerzreduktion (25) und Patientinnenerfahrung (26) bewirkte.
Fatigue
Beispielhaft zeigte eine randomisierte Studie (Aufmerksamkeitskontrolle; n = 200 Brustkrebs, Radiotherapie), dass 15 Minuten Hypnose (zu Beginn und Ende der Radiotherapie, dazwischen wöchentlich 5 Minuten) in Kombination mit KVT eine klinisch und statistisch signifikante Verbesserung der Fatigue nach Abschluss der Radiotherapie und 1 bis 6 Monate danach aufweist (27) (siehe auch Artikel Survivorship).
Schlafstörungen
Beispielhaft zeigte eine Wartelisten-randomisierte Studie (n = 95 cancer survivors), dass eine kombinierte Self-
Care- / Self-Hypnosis-Gruppen-Intervention (8-wöchentliche 2-Stunden-Sitzungen mit 15 Minuten Hypnose) eine signifikante Verbesserung der Schlafstörung (ISI) nach 3 bis 12 Monaten bewirkte (28) (siehe auch Artikel Survivorship).
Für andere Symptome (z. B. chronische Schmerzen, Übelkeit/Erbrechen bei Erwachsenen und Kindern [29] bei Chemotherapie, Krebstherapie-bedingte Hitzewallungen oder Angst ausserhalb prozeduraler Kontexte) ist die wissenschaftliche Evidenz noch limitiert.
Qualitätskriterien
Die therapeutische Qualität der Hypnose in der Onkologie hängt ab von der Kompetenz der Behandler, der Einhaltung ethischer Standards und transparenter Kommunikation. Der Titel «Hypnotherapeut» ist in den meisten Ländern nicht geschützt.
Verschiedene Anbieter können Hypnose je nach Kontext und lokalen Vorschriften durchführen, weshalb die Qualifikation der Therapeuten idealerweise durch renommierte Organisationen wie die International Society for Hypnosis (ISH) geprüft werden sollte.
Qualitativ hochwertige Hypnose erfordert:
• Therapeut/-innen mit medizinischem Hintergrund und Hypnoseexpertise
• ethisches Arbeiten im Rahmen ihrer Zulassung (z. B. nach ISH-Ethikkodex)
• sorgfältige Dokumentation der Techniken und Patientenergebnisse
• Kommunikation mit anderen Gesundheitsfachkräften
• Aufmerksamkeit für Patientensicherheit und verbale Einwilligung
Fazit
Klinische Hypnose kann als wirksame unterstützende Therapie bei onkologischen Patient/-innen eingesetzt werden zur Behandlung akuter und postoperativer Schmerzen, von Fatigue, Schlafproblemen oder anderen Symptomen bei qualifizierter Anwendung durch gut ausgebildete Therapeut/-innen mit medizinischem Hintergrund.
Literatur
1. Zahedi A, Jay Lynn S, Sommer W. How hypnotic suggestions work – A systematic review of prominent theories of hypnosis. Conscious Cogn. 2024 Aug;123:103730.
2. Elkins GR, Barabasz AF, Council JR, Spiegel D. Advancing Research and Practice: The Revised APA Division 30 Definition of Hypnosis. Am J Clin Hypn. 2015 Apr;57(4):378–85.
3. Rinaldi MR, van Luijtelaar G, Hasanat NU, Yuniarti KW. Clinical Hypnosis for Chronic Illnesses: A Scoping Review of Randomized Controlled Trials. Int J Clin Exp Hypn. 2025 Jul 24:1-30
4. Barnes PM, Powell-Griner E, McFann K, Nahin RL. Complementary and alternative medicine use among adults: United States, 2002. Adv Data. 2004 May 27;(343):1-19
5. Geagea D, Ogez D, Kimble R, Tyack Z. Redefining hypnosis: A narrative review of theories to move towards an integrative model. Complement Ther Clin Pract. 2024 Feb;54:101826
6. Lang EV, Hatsiopoulou O, Koch T, Berbaum K, Lutgendorf S, Kettenmann E, Logan H, Kaptchuk TJ. Can words hurt? Patient-provider interactions during invasive procedures. Pain. 2005 Mar;114(1-2):303-9.
7. You M, Kim E. Effects of Gratitude Journaling on Patients with Breast Cancer: A Randomized Controlled Trial. Curr Oncol. 2025 Jul 12;32(7):400
8. Tan TT, Tan MP, Lam CL, Loh EC, Capelle DP, Zainuddin SI, Ang BT, Lim MA, Lai NZ, Tung YZ, Yee HA, Ng CG, Ho GF, See MH, Teh MS, Lai LL, Pritam Singh RK, Chai CS, Ng DLC, Tan SB. Mindful gratitude journaling: psychological distress, quality of life and suffering in advanced cancer: a randomised controlled trial. BMJ Support Palliat Care. 2023 Dec 7;13(e2):e389-e396
9. George LS, Park CL: Meaning in life as comprehension, purpose, and mattering: Toward integration and new research questions. Rev Gen Psychol 2016;20:205–220
10. Yuan P, Lu W, Yong X, Yang W, Zhong X, Wang M, Zhang Y, Fang T, Xie Y, Li X, Zhang L. Evidence summary of meaning in life intervention for cancer patients. Front Oncol. 2025 Jul 30;15:1603349
11. Winger JG, Ramos K, Kelleher SA, Somers TJ, Steinhauser KE, Porter LS, Kamal AH, Breitbart WS, Keefe FJ. Meaning-Centered Pain Coping Skills Training: A Pilot Feasibility Trial of a Psychosocial Pain Management Intervention for Patients with Advanced Cancer. J Palliat Med. 2022 Jan;25(1):60-69.
12. Amonoo HL et al. A Positive Psychology Intervention in Allogeneic Hematopoietic Stem Cell Transplantation Survivors (PATH): A Pilot RCT, JNCCN 2024;22(2 D):e237117.
13. Tang Y, Tang R. Health Neuroscience-How the Brain/Mind and Body Affect our Health Behavior and Outcomes. J Integr Neurosci. 2024 Apr 1;23(4):69.
14. Xiang L, Wan H, Zhu Y. Effects of cognitive behavioral therapy on resilience among adult cancer patients: a systematic review and meta-analysis. BMC Psychiatry. 2025 Mar 6;25(1):204
15. Cooper JT, Svoboda E, Prochazka AV, Ha DM. Effects of cognitive-behavioral therapy for insomnia compared with controls among cancer survivors: a systematic review and meta-analysis of randomized trials. BMC Cancer. 2025 May 14;25(1):871.
16. Hosseini Koukamari P, Karimy M, Ghaffari M, Milajerdi A. Effect of cognitive-behavioral therapy on fatigue in cancer patients: a systematic review and meta-analysis. Front Psychol. 2025 Jan 10;15:1435110
17. Yennurajalingam S, Azhar A, Lu Z, Rodriguez AJ, Arechiga AB, Guerra-Sanchez M, Stanton P, Andersen CR, Urbauer DL, Bruera E. Open-Label Placebo for the Treatment of Cancer-Related Fatigue in Patients with Advanced Cancer: A Randomized Controlled Trial. Oncologist. 2022 Dec 9;27(12):1081-1089
18. Laursen DR, Nejstgaard CH, Bjørkedal E, Frost AD, Hansen MR, Paludan-Müller AS, Prosenz J, Werner CP, Hróbjartsson A. Impact of active placebo controls on estimated drug effects in randomised trials: a systematic review of trials with both active placebo and standard placebo. Cochrane Database Syst Rev. 2023 Mar 6;3(3):MR000055
19. Arslan U, Özgünay ?E, Yi?it D, Düzköylü Y. Comparison of hypnosis plus sedoanalgesia and sedoanalgesia alone methods used in the ERCP procedure: A prospective randomized study. Medicine (Baltimore). 2025 Jun 6;104(23):e42641.
20. Evans S, Van Niekerk L, Orellana L, O‘Shea M, Druitt MI, Jones S, Corrigan S, Heggen C, Arashiro Z, Baber R, Satyen L, Skvarc D, Mikocka-Walus A. The need for biopsychosocial menopause care: a narrative review. Menopause. 2024 Dec 1;31(12):1090-1096.
21. Palsson OS, Kekecs Z, De Benedittis G, Moss D, Elkins GR, Terhune DB, Varga K, Shenefelt PD, Whorwell PJ. Current Practices, Experiences, and Views in Clinical Hypnosis: Findings of an International Survey. Int J Clin Exp Hypn. 2023 Apr-Jun;71(2):92-114.
22. Carlson LE, Toivonen K, Flynn M, Deleemans J, Piedalue KA, Tolsdorf E, Subnis U. The Role of Hypnosis in Cancer Care. Curr Oncol Rep. 2018 Nov 13;20(12):93.
23. Franch M, Alarcón A, Capafons A. Applications of Hypnosis as an Adjuvant in Oncological Settings: A Systematic Review. Int J Clin Exp Hypn. 2023 Jan-Mar;71(1):1-24.
24. Carlson LE, Ismaila N, Addington EL, Asher GN, Atreya C, Balneaves LG, Bradt J, Fuller-Shavel N, Goodman J, Hoffman CJ, Huston A, Mehta A, Paller CJ, Richardson K, Seely D, Siwik CJ, Temel JS, Rowland JH. Integrative Oncology Care of Symptoms of Anxiety and Depression in Adults With Cancer: Society for Integrative Oncology-ASCO Guideline. J Clin Oncol. 2023 Oct 1;41(28):4562-4591.
25. Montgomery GH, Bovbjerg DH, Schnur JB, David D, Goldfarb A, Weltz CR, Schechter C, Graff-Zivin J, Tatrow K, Price DD, Silverstein JH. A randomized clinical trial of a brief hypnosis intervention to control side effects in breast surgery patients. J Natl Cancer Inst. 2007 Sep 5;99(17):1304-12
26. Montgomery GH, Hallquist MN, Schnur JB, David D, Silverstein JH, Bovbjerg DH. Mediators of a brief hypnosis intervention to control side effects in breast surgery patients: response expectancies and emotional distress. J Consult Clin Psychol. 2010 Feb;78(1):80-8.
27. Montgomery GH, David D, Kangas M, Green S, Sucala M, Bovbjerg DH, Hallquist MN, Schnur JB. Randomized controlled trial of a cognitive-behavioral therapy plus hypnosis intervention to control fatigue in patients undergoing radiotherapy for breast cancer. J Clin Oncol. 2014 Feb 20;32(6):557-63
28. Grégoire C, Faymonville ME, Vanhaudenhuyse A, Jerusalem G, Willems S, Bragard I. Randomized, Controlled Trial of an Intervention Combining Self-Care and Self-Hypnosis on Fatigue, Sleep, and Emotional Distress in Posttreatment Cancer Patients: 1-Year Follow-Up. Int J Clin Exp Hypn. 2022 Apr-Jun;70(2):136-155
29. Molassiotis A, Affronti ML, Fleury M, Olver I, Giusti R, Scotte F. 2023 MASCC/ESMO consensus antiemetic guidelines related to integrative and non-pharmacological therapies. Support Care Cancer. 2023 Dec 16;32(1):30.
Mind Body Medicine und Mind-Body- Verfahren in der Integrativen Onkologie
Autorinnen
Dr. med. Marie-Estelle Gaignard
Prof. Dr. med. Claudia M. Witt
Einleitung und Definitionen
Mind Body Medicine ist ein modernes, wissenschaftlich basiertes, integratives Konzept. Es verbindet den Körper mit der Psyche, vermittelt Self Care und wird sowohl präventiv als auch therapeutisch eingesetzt. Durch multimodale Therapiekonzepte sollen Symptome reduziert, Ressourcen und Selbstwirksamkeit gestärkt werden. Eine universitäre Weiterbildung erfolgt in der Schweiz nur an der Universität Zürich (1) und sichert zusammen mit dem Fachverband (2) die Qualität der Angebote.
Werden einzelne Interventionen verwendet, spricht man von Mind-Body-Verfahren (z. B. Achtsamkeitsinterventionen, Yoga, Tai Chi, Qi Gong, geführte Imagination, Atemübungen und klinische Hypnose). Ziel der Anwendung der Verfahren ist es, Krebspatient/-innen durch Reduktion psychischer Belastungen, verbessertes Symptommanagement und gesteigerte Lebensqualität während der gesamten Behandlung zu unterstützen. Trotz unterschiedlicher Formen beruhen die eingesetzten Techniken auf einem gemeinsamen Prinzip: Sie fördern die bewusste Wahrnehmung innerer Erfahrungen – emotional, kognitiv und körperlich – und ermöglichen einen veränderten Umgang damit (3). Unter den Mind-Body-Verfahren sind achtsamkeitsbasierte Interventionen am bekanntesten. Sie basieren auf dem Konzept der Achtsamkeit – häufig beschrieben als «nicht wertende Wahrnehmung des gegenwärtigen Moments» – und werden meist in strukturierten Gruppenformaten angeboten, insbesondere im Rahmen des Programms «Mindfulness-Based Stress Reduction» (MBSR) (4). MBSR-Angebote in der Schweiz findet man über den Fachverband (5). In einigen Kerndisziplinen der Integrativen Onkologie (siehe Kapitel Anthroposophisch erweiterte Medizin, Integrative Pflege und TCM in diesem Artikel) werden auch Mind-Body-Verfahren eingesetzt.
Diagnostik und therapeutisches Vorgehen
In der Mind Body Medicine steht das konzeptionelle Vorgehen im Vordergrund. Mind Body Medicine versteht den Menschen als Ganzes, bezieht seine Lebenswelt ein, orientiert sich an den individuellen Bedürfnissen der Patient/
-innen und integriert Achtsamkeit als zentrales Element in die therapeutischen Ansätze (2). Konzepte und Methoden aus der Gesundheitspsychologie inkl. Motivation für Verhaltensänderungen (HAPA-Modell [6]) spielen eine wichtige Rolle, und die Mind-Body-Verfahren werden individualisiert.
Diagnostik und das Vorgehen der einzelnen Mind-Body-Verfahren unterscheiden sich stark und hängen auch von deren Einbettung in komplementärmedizinische Therapiesysteme ab (z. B. Tai Chi als Teil der TCM oder Heileurythmie als Teil der Anthroposophisch erweiterten Medizin). Mind-Body-Verfahren sind in der Regel nicht medikamentös und nicht invasiv und damit zumeist risikoarm. Bei bekannter schwerer Depression oder Angststörungen ist eine ärztlich-psychiatrische Verordnung und Begleitung notwendig (30).
Onkologie-spezifische Angebote
Es gibt spezielle für Krebspatient/-innen entwickelte Angebote (siehe www.integrative-oncology.ch). Zum Beispiel sind «Mindfulness-Based Cancer Recovery» (MBCR) und «Mindfulness-Based Cognitive Therapy for Cancer» (MBCT-Ca) Onkologie-spezifische Weiterentwicklungen der MBSR (7, 8). MBCR integriert Achtsamkeitspraktiken mit psychoedukativen Inhalten (7), und MBCT-Ca basiert auf dem ursprünglichen MBCT-Protokoll (Achtsamkeitsbasierte Kognitive Therapie) und kombiniert Achtsamkeit mit kognitiv-verhaltenstherapeutischen Strategien (8). Beide Programme werden, ebenso wie die MBSR, über acht Wochen mit wöchentlichen Gruppensitzungen sowie einem ganztägigen Retreat angeboten.
Evidenzlage zu Mind-Body-Verfahren in der Onkologie
Mind-Body-Verfahren gehören zu den häufigsten Empfehlungen in Leitlinien (siehe Artikel Edukation). Für achtsamkeitsbasierte Interventionen zeigen Studien und Metaanalysen eine Effektivität bei der Reduktion von Angst, Depression und Stress – häufige Belastungen bei Menschen mit Krebs. Auch bei der Verbesserung von Schmerzen, Fatigue, Schlafqualität und der allgemeinen Lebensqualität zeigten sich kleine bis grosse Effektstärken (9, 10). In der MINDSET-Studie war z. B. die MBCR der supportiv-expressiven Therapie deutlich überlegen sowohl in der Stressreduktion als auch in der Förderung sozialer Unterstützung – mit anhaltenden Effekten nach einem Jahr (11). Eine weitere randomisierte Studie zeigte, dass sowohl die Präsenz- als auch die Onlineversion von MBCT psychische Belastungen wirksamer reduzierten als die übliche Versorgung – insbesondere hinsichtlich Rückfallangst, Achtsamkeit und mentaler Lebensqualität (12). Die MATCH-Studie verglich Achtsamkeitsmeditation und Tai Chi, wobei auch die Präferenzen der Teilnehmenden berücksichtigt wurden, was zwar die Teilnahmebereitschaft und Zufriedenheit erhöhte, aber keinen Einfluss auf die Wirksamkeit hatte (13). Über die reine Symptomreduktion hinaus fördern achtsamkeitsbasierte Interventionen eine nachhaltige psychologische Anpassung, indem sie die emotionale Regulation, Resilienz und Fähigkeit zur Bewältigung existenzieller Belastungen – wie Angst vor Rückfällen oder Unsicherheit – mit grösserer Klarheit und Akzeptanz stärken (12, 14, 15). Neuere Forschungsergebnisse weisen darauf hin, dass achtsamkeitsbasierte Interventionen auch biologische Prozesse beeinflussen können, die mit Stress und zellulärer Alterung in Verbindung stehen (Veränderungen in Bezug auf den Tagesrhythmus des Cortisols [6, 17], die Herzratenvariabilität [18], Entzündungsmarker [19–21] und die Telomerlänge [22] nach regelmässiger Achtsamkeitspraxis [23–26]).
Implementierung und Qualitätskriterien
Die Formate der Angebote variieren von Einzelkonsultationen bis hin zu Gruppenangeboten, wobei sie zumeist von Ärztinnen, Psychologinnen und Personal der Gesundheitsberufe angeboten werden. Mit der digitalen Transformation der Medizin werden Angebote zunehmend flexibel und skalierbar – was den Zugang für Patient/-innen mit Mobilitätseinschränkungen, Fatigue oder geografischer Isolation erleichtert. Die kürzlich veröffentlichte randomisierte CanRelax-Studie (27) zeigte beispielsweise, dass eine App mit Achtsamkeits- und Entspannungsübungen, unterstützt durch einen Chatbot, psychische Belastung reduzieren kann.
Die einzelnen Mind-Body-Verfahren unterscheiden sich in der Qualitätssicherung und den Ausbildungsstandards und werden durch spezialisierte Fachverbände (z. B. MBSR-Verband Schweiz [5]) geregelt. Der Schweizer Fachverband für die Mind Body Medicine hat auch Grundsätze zur Qualitätssicherung formuliert (2) . Mind Body Medicine soll ausschliesslich von qualifizierten Fachpersonen (Medizin, Psychologie Gesundheitsberufe) mit Zusatzqualifikation in Mind Body Medicine in einem adäquaten Setting angeboten werden. Das Angebot ist zudem methodisch nachvollziehbar, transparent und frei von ideologischen Prägungen zu gestalten und soll sich kontinuierlich weiterentwickeln, basierend auf wissenschaftlicher Evidenz und praktischen Erfahrungen.
Fazit
Mind Body Medicine und Mind-Body-Verfahren lassen sich gut mit der Tumortherapie kombinieren und ermöglichen eine aktive Teilnahme von Patient/-innen im Therapieprozess. Eine hochwertige Implementierung erfordert institutionelle Unterstützung (28, 29) und ausreichend Ressourcen. Die Angebote müssen die vielfältigen Bedürfnisse der Patient/-innen – einschliesslich schwer erkrankter Personen – berücksichtigen und kulturell, sprachlich sowie sozioökonomisch sensibel gestaltet sein. Die Integration dieser Interventionen in bestehende onkologische Versorgungspfade und die Förderung der interprofessionellen Zusammenarbeit im Gesundheitswesen stärken eine nachhaltige Implementierung.
Literatur
1. Zurich, U.o. CAS in Gesundheitspsychologischer Lebensstiländerung und Mind Body Medicine. 2025 (cited 2025 September 2025); Available from: https://www.psychologie.uzh.ch/de/bereiche/sob/angsoz/CAS.html.
2. Medicine, S.F.M.B. Schweizer Fachverband Mind Body Medicine. 2025 (cited 2025 11 September 2025); Available from: http://sfmbm.org.
3. Carlson, L.E. and B.D. Bultz, Mind-body interventions in oncology. Curr Treat Options Oncol, 2008. 9(2-3): p. 127-34.
4. Kabat-Zinn, J., Full catastrophe living: Using the wisdom of your body and mind to face stress, pain and illness. 1990, New York, NY: Delacorte.
5. Schweiz, M.-V. Mindfulness Swiss. 2025 (cited 2025 11 September 2025); Available from: https://www.mindfulness.swiss/.
6. Schwarzer, R., Health Action Process Approach (HAPA) as a Theoretical Framework to Understand Behavior Change. Actualidades en Psicología, 2016. 30(121): p. 119-130.
7. Linden, W., Linda E. Carlson and Michael Speca: Mindfulness-Based Cancer Recovery: A Step-By-Step MBSR Approach to Help You Cope with Treatment & Reclaim Your Life. Mindfulness, 2011. 2: p. 216-217.
8. Bartley, T., Mindfulness-Based Cognitive Therapy for Cancer: Gently Turning Towards. 2011.
9. Haller, H., et al., Mindfulness-based interventions for women with breast cancer: an updated systematic review and meta-analysis. Acta Oncol, 2017. 56(12): p. 1665-1676.
10. Xunlin, N.G., Y. Lau, and P. Klainin-Yobas, The effectiveness of mindfulness-based interventions among cancer patients and survivors: a systematic review and meta-analysis. Support Care Cancer, 2020. 28(4): p. 1563-1578.
11. Carlson, L.E., et al., Randomized-controlled trial of mindfulness-based cancer recovery versus supportive expressive group therapy among distressed breast cancer survivors (MINDSET): long-term follow-up results. Psychooncology, 2016. 25(7): p. 750-9.
12. Compen, F., et al., Face-to-Face and Internet-Based Mindfulness-Based Cognitive Therapy Compared With Treatment as Usual in Reducing Psychological Distress in Patients With Cancer: A Multicenter Randomized Controlled Trial. J Clin Oncol, 2018. 36(23): p. 2413-2421.
13. Carlson, L.E., et al., Protocol for the MATCH study (Mindfulness and Tai Chi for cancer health): A preference-based multi-site randomized comparative effectiveness trial (CET) of Mindfulness-Based Cancer Recovery (MBCR) vs. Tai Chi/Qigong (TCQ) for cancer survivors. Contemp Clin Trials, 2017. 59: p. 64-76.
14. Hölzel, B.K., et al., How Does Mindfulness Meditation Work? Proposing Mechanisms of Action From a Conceptual and Neural Perspective. Perspect Psychol Sci, 2011. 6(6): p. 537-59.
15. Faghani, F., et al., Effectiveness of mindfulness-based supportive psychotherapy on posttraumatic growth, resilience, and self-compassion in cancer patients : A pilot study. Wien Klin Wochenschr, 2022. 134(15-16): p. 593-601.
16. Lamothe, M., et al., Changes in hair cortisol and self-reported stress measures following mindfulness-based stress reduction (MBSR): A proof-of-concept study in pediatric hematology-oncology professionals. Complement Ther Clin Pract, 2020. 41: p. 101249.
17. Drogos, L.L., et al., No effect of mindfulness-based cancer recovery on cardiovascular or cortisol reactivity in female cancer survivors. J Behav Med, 2021. 44(1): p. 84-93.
18. Dutcher, J.M., et al., Neural responses to threat and reward and changes in inflammation following a mindfulness intervention. Psychoneuroendocrinology, 2021. 125: p. 105114.
19. Matiz, A., et al., The effect of mindfulness-based interventions on biomarkers in cancer patients and survivors: A systematic review. Stress Health, 2024. 40(4): p. e3375.
20. Melis, M., et al., The Impact of Mindfulness on Functional Brain Connectivity and Peripheral Inflammation in Breast Cancer Survivors with Cognitive Complaints. Cancers (Basel), 2023. 15(14).
21. Oswald, L.B., et al., Preliminary Effects of Mindfulness Training on Inflammatory Markers and Blood Pressure in Young Adult Survivors of Cancer: Secondary Analysis of a Pilot Randomized Controlled Trial. Int J Behav Med, 2022. 29(5): p. 676-684.
22. Aghajanyan, V., et al., A Narrative Review of Telomere Length Modulation Through Diverse Yoga and Meditation Styles: Current Insights and Prospective Avenues. Cureus, 2023. 15(9): p. e46130.
23. Lengacher, C.A., et al., A pilot study evaluating the effect of mindfulness-based stress reduction on psychological status, physical status, salivary cortisol, and interleukin-6 among advanced-stage cancer patients and their caregivers. J Holist Nurs, 2012. 30(3): p. 170-85.
24. Carlson, L.E., et al., Mindfulness-based cancer recovery and supportive-expressive therapy maintain telomere length relative to controls in distressed breast cancer survivors. Cancer, 2015. 121(3): p. 476-84.
25. Harkess, K.N., et al., Preliminary indications of the effect of a brief yoga intervention on markers of inflammation and DNA methylation in chronically stressed women. Transl Psychiatry, 2016. 6(11): p. e965.
26. Black, D.S., G. Christodoulou, and S. Cole, Mindfulness meditation and gene expression: a hypothesis-generating framework. Curr Opin Psychol, 2019. 28: p. 302-306.
27. Barth, J., et al., Mobile health intervention CanRelax reduces distress in people with cancer in a randomized controlled trial. npj Digital Medicine, 2025. 8(1): p. 269.
28. Mao, J.J., et al., Implementing a virtual mind-body prehabilitation program for patients undergoing thoracic surgery: A quality improvement project. JTCVS Open, 2023. 14: p. 615-622.
29. Trevino, K.M., et al., Rapid deployment of virtual mind-body interventions during the COVID-19 outbreak: feasibility, acceptability, and implications for future care. Support Care Cancer, 2021. 29(2): p. 543-546.
30. Campayo J. Unwanted effects: Is there a negative side of meditation? A multicentre survey. PLoS One. 2017 Sep 5;12(9):e0183137
Phytotherapie in der Integrativen Onkologie
Autorinnen
Dr. med. Natalie Kalbermatten
Dr. med. Tilly Nothhelfer
Einleitung und Definition
Phytotherapie – die medizinische Anwendung pflanzlicher Arzneimittel – gehört zu den ältesten Heilverfahren der Menschheitsgeschichte (1, 2). Sie ist seit Jahrhunderten ein fester Bestandteil verschiedener traditioneller Medizinsysteme. Viele ihrer historischen Anwendungen konnten im Verlauf durch moderne pharmakologische Forschung bestätigt oder zumindest plausibilisiert werden (3–6). Phytotherapie besitzt im mitteleuropäischen Raum eine lange kulturelle Tradition und ist insbesondere in der Volksmedizin fest verankert (7). In der Schweiz ist sie insbesondere im deutschsprachigen Teil beliebt und wird breit genutzt (8).
Pflanzliche Arzneimittel liegen in vielfältigen Darreichungsformen vor – von Tees und Tinkturen über standardisierte Extrakte bis zu Zubereitungen für die äussere Anwendung. Ihre Herstellung erfolgt mittels definierter Extraktionsverfahren (ethanolisch, wässrig, CO₂), wodurch Zusammensetzung und Dosierung nachvollziehbar werden. Entscheidend ist die Abgrenzung von zugelassenen pflanzlichen Arzneimitteln zu nicht geprüften Nahrungsergänzungsmitteln (NEM), die keiner Zulassungspflicht unterliegen und teils erhebliche Qualitätsunterschiede aufweisen; insbesondere im onkologischen Kontext wird von nicht geprüften NEM abgeraten (9, 10).
Pflanzliche Arzneimittel unterscheiden sich grundlegend von konventionellen Monosubstanzpräparaten: Sie stellen komplexe Vielstoffgemische dar, deren therapeutische Wirksamkeit häufig auf synergistischen oder modulierenden Effekten mehrerer Inhaltsstoffe beruht. Im Gegensatz dazu gelten isolierte Einzelsubstanzen pflanzlichen Ursprungs, wie beispielsweise Cannabidiol (CBD) oder Curcumin, nicht als pflanzliche Arzneimittel im eigentlichen Sinn. Ein Beispiel für den beschriebenen synergistischen Effekt ist Johanniskraut (Hypericum perforatum), dessen antidepressive Wirkung nur im Zusammenspiel verschiedener Inhaltsstoffe reproduzierbar ist (11, 12). Ein weiteres Charakteristikum pflanzlicher Vielstoffgemische ist ihre sogenannte Pleiotropie: Viele phytotherapeutische Arzneimittel entfalten gleichzeitig mehrere Wirkungen. Ein Beispiel hierfür ist Ingwer (Zingiber officinale), welcher, vermutlich über eine Modulation serotonerger (5HT3) und weiterer Rezeptorsysteme im Gastrointestinaltrakt und Zentralnervensystem, antiemetisch wirksam ist (13–15) – für Chemotherapie-induzierte Übelkeit und Erbrechen (CINV) ist die Evidenzlage allerdings heterogen (16) – und darüber hinaus analgetische, antiinflammatorische und antioxidative Eigenschaften besitzt (17).
Diagnostik und therapeutisches Vorgehen
Eine Orientierungshilfe für die klinische Anwendung pflanzlicher Arzneimittel bieten die Monografien internationaler Fachgremien wie der Europäischen Arzneimittelagentur (Committee on Herbal Medicinal Products, EMA-HMPC), der Weltgesundheitsorganisation (WHO) und der European Scientific Cooperative on Phytotherapy (ESCOP). Diese Monografien unterscheiden zwischen «well-established use» (wissenschaftlich belegte Wirksamkeit auf Grundlage klinischer Studien) und «traditional use» (langjährige medizinische Nutzung mit Plausibilität durch pharmakologische Daten und Erfahrung) (18). Diese Unterscheidung verdeutlicht die Spannbreite zwischen studiengestützter Anwendung und systematisch dokumentiertem Erfahrungswissen.
Evidenz der Phytotherapie und typische Indikationen in der Onkologie
Viele Patient/-innen mit Krebserkrankungen interessieren sich für pflanzliche Arzneimittel als Ergänzung zu ihrer konventionellen Therapie (19). Orientierung könnte hier für behandelnde Ärzt/-innen die S3-Leitlinie «Komplementärmedizin in der Behandlung von onkologischen Patient/-innen» bieten (20). Sie fokussiert jedoch ausschliesslich auf randomisierte kontrollierte Studien in onkologischen Populationen. Das schafft zwar eine hohe methodische Qualität, grenzt die Anwendbarkeit aber erheblich ein: Präparate mit guter Evidenz in nicht onkologischen Populationen – etwa orales Lavendelöl bei Angststörungen (21) – werden nicht berücksichtigt. Entsprechend enthält die Leitlinie nur wenige «Kann»-Empfehlungen, etwa für Mistel (Viscum album) zur Verbesserung der Lebensqualität, Traubensilberkerze (Cimicifuga racemosa) bei klimakterischen Beschwerden unter antihormoneller Therapie, Indischen Weihrauch (Boswellia serrata) beim tumorassoziierten Hirnödem, Ginseng (Panax ginseng bzw. quinquefolius) bei Fatigue oder Cannabinoide bei Schmerzen und CINV. Die limitierte Evidenzlage ist im Wesentlichen methodisch bedingt: Die komplexe Zusammensetzung pflanzlicher Präparate mit variablen Inhaltsstoffgehalten erschwert eine Standardisierung, verlässliche Daten zu Dosierung und pharmakokinetischen Parametern fehlen häufig, gerade auch in besonderen Patientenkollektiven. Zudem ist eine adäquate Placebokontrolle aufgrund charakteristischer sensorischer Eigenschaften vieler Präparate nur eingeschränkt möglich (22). Um den tatsächlichen Nutzen pflanzlicher Arzneimittel im klinischen Alltag besser abzubilden, fordern Fachgesellschaften zunehmend eine Ergänzung durch hochwertige Real-World-Daten (23, 24).
Qualitätskriterien für Phytotherapie in der Onkologie
Zugelassene pflanzliche Arzneimittel weisen in der Allgemeinbevölkerung in der Regel ein günstiges Sicherheitsprofil auf (25). Bei onkologischen Patient/-innen können jedoch besondere Bedingungen wie eingeschränkte Organfunktionen oder parallele medikamentöse Therapien das Risiko verändern (26, 32).
Vor dem Einsatz von Phytotherapeutika im onkologischen Kontext ist – wie bei anderen Arzneimitteln – eine sorgfältige Prüfung möglicher Interaktionen erforderlich. Hierfür stehen verschiedene spezialisierte Datenbanken zur Verfügung, etwa «About Herbs, Botanicals & Other Products» des Memorial Sloan Kettering Cancer Center (https://www.mskcc.org/cancer-care/diagnosis-treatment/symptom-management/integrative-medicine/herbs). Die dort aufgeführten Interaktionsrisiken beruhen jedoch häufig auf In-vitro-Daten und sind daher nur begrenzt auf die klinische Situation übertragbar. So sind viele Pflanzeninhaltsstoffe schlecht resorbierbar oder werden rasch metabolisiert (27), sodass angenommen wird, dass sie zumindest teilweise lokal im Gastrointestinaltrakt oder über das intestinale Mikrobiom wirksam sein könnten (28). Um das Interaktionsrisiko weder zu über- noch zu unterschätzen, ist neben der Datenbankrecherche pharmakologisches sowie fundiertes phytotherapeutisches Fachwissen erforderlich. Neben den vorher genannten pharmakokinetischen sind auch pharmakodynamische Interaktionen zu berücksichtigen. Ein wichtiges Beispiel hierfür sind Phytoöstrogene, die eine schwache Affinität zu Östrogenrezeptoren aufweisen. Hauptquellen sind Soja (Glycine max) und Rotklee (Trifolium pratense). Während niedrig dosierte Nahrungsquellen wie traditionelle Sojaprodukte als unproblematisch gelten, sollten hoch dosierte Isoflavon-Extrakte bei Hormonrezeptor-positivem Mammakarzinom vermieden werden (20, 29).
Fazit
Phytotherapie gewinnt im Kontext von «One Health» und Nachhaltigkeit zunehmend an Bedeutung. In einigen Indikationen – etwa unkomplizierte Harnwegsinfekte – empfehlen nationale Leitlinien bereits den bevorzugten Einsatz pflanzlicher Arzneimittel, um den Antibiotikaverbrauch zu reduzieren (30). In der Onkologie kann Phytotherapie – studiengestützt oder sorgfältig begründet erfahrungsbasiert eingesetzt – einen Beitrag zur Symptomkontrolle und Lebensqualität leisten. Neben pharmakologischen Effekten spielen auch kulturelle und sinnliche Aspekte eine Rolle: Zubereitungsrituale, der Duft einer Pflanze oder die Verbindung zu einer langen medizinischen Tradition können das subjektive Erleben positiv beeinflussen. Diese Aspekte sollten jedoch nicht als «blosser Placeboeffekt» verstanden werden, sondern als integraler Bestandteil einer patientenzentrierten, ganzheitlichen Therapie, die sowohl physiologische als auch psychosoziale Wirkmechanismen berücksichtigt (31).
Literatur
1. Mills S, Bone K. Principles and Practice of Phytotherapy. 2nd ed. Churchill Livingstone; 2013
2. Fabricant DS, Farnsworth NR. The value of plants used in traditional medicine for drug discovery. Environ Health Perspect. 2001;109 Suppl 1:69–75.
3. Cragg GM, Newman DJ. Natural products: A continuing source of novel drug leads. Biochim Biophys Acta. 2013;1830(6):3670–3695.
4. Li JW-H, Vederas JC. Drug discovery and natural products: end of an era or an endless frontier? Science. 2009;325(5937):161–165.
5. Pan SY, Zhou SF, Gao SH, et al. New perspectives on how to discover drugs from herbal medicines: CAM’s outstanding contribution to modern therapeutics. Evid Based Complement Alternat Med. 2013;2013:627375.
6. Dal Cero C, Saller R, Weckerle CS. The use of the local flora in Switzerland: A comparison of past and recent medicinal plant knowledge. J Ethnopharmacol. 2015;168:143–151.
7. Wolfender JL, Queiroz EF, Hostettmann K. Phytochemistry in the post-genomic era. Phytochemistry. 2013;91:1–4.
8. Egger M, et al. Complementary and alternative medicine use among adults in Switzerland. Swiss Med Wkly. 2008;138(19–20):300–307.(9) Posadzki P, et al. Adverse effects of herbal medicines: an overview of systematic reviews. Clin Med (Lond). 2013;13(1):7–12.
10. Navarro VJ, et al. Herbal and dietary supplement hepatotoxicity. Semin Liver Dis. 2014;34(2):172–193.
11. Butterweck V, Schmidt M. St. John’s wort: Role of active compounds for its mechanism of action and efficacy. Wien Med Wochenschr. 2007;157(13–14):356–361.
12. Müller WE. Current St John’s wort research from mode of action to clinical efficacy. Pharmacol Res. 2003;47(2):101–109.
13. Marx W, et al. Ginger—mechanism of action in chemotherapy-induced nausea and vomiting: a review. Crit Rev Food Sci Nutr. 2017;57(1):141–146.
14. Zick SM, et al. Randomized controlled trial of ginger for chemotherapy-related nausea in patients with cancer. Support Care Cancer. 2009;17(5):563–572.
15. Ryan JL, et al. Ginger (Zingiber officinale) reduces acute chemotherapy-induced nausea: a URCC CCOP study of 576 patients. Support Care Cancer. 2012;20(7):1479–1489.
16. Lee J, Oh H, Park S, et al. Ginger as an antiemetic modality for chemotherapy-induced nausea and vomiting: a systematic review and meta-analysis. Complement Ther Med. 2013;21(5):464–474.
17. Thomson M, et al. The anti-inflammatory and antioxidant effects of ginger in health and physical activity: A review of the evidence. Int J Prev Med. 2014;5(1):36–44.
18. European Medicines Agency (EMA). Guideline on the assessment of clinical safety and efficacy in the preparation of community herbal monographs. 2010.
19. Drozdoff L, Klein E, Kiechle M. Use of complementary and alternative medicine in Germany – a survey of patients with breast cancer. BMC Complement Altern Med. 2018;18:29.
20. Leitlinie „Komplementärmedizin in der Behandlung von onkologischen Patient/-innen“. AWMF-Registernummer 032/054OL, 2021. https://www.leitlinienprogramm-onkologie.de/leitlinien/komplementaermedizin/
21. Donelli D, Antonelli M, Bellinazzi C, Gensini GF, Firenzuoli F. Lavender oil for anxiety disorders: a systematic review and meta-analysis. Phytomedicine. 2019;65:153099.
22. Panossian A. Challenges in phytotherapy research. Front Pharmacol. 2023;14:1199516.
23. European Society for Medical Oncology (ESMO), European Hematology Association (EHA), European Medicines Agency (EMA). Workshop on the use of real-world evidence in oncology. ESMO Open. 2022;7(3):100543.
24. Eichler HG, et al. Adaptive licensing: taking the next step in the evolution of drug approval. Clin Pharmacol Ther. 2012;91(3):426–437.
25. Izzo AA, Hoon-Kim S, Radhakrishnan R, Williamson EM. A critical approach to evaluating clinical efficacy, adverse events and drug interactions of herbal remedies. Phytother Res. 2016;30(5):691–700.
26. Stickel F, et al. Hepatotoxicity of botanicals. Public Health Nutr. 2000;3(2):113–124.
27. Manach C, Williamson G, Morand C, Scalbert A, Rémésy C. Bioavailability and bioefficacy of polyphenols in humans. Am J Clin Nutr. 2005;81(1 Suppl):230S–242S.
28. Selma MV, Espín JC, Tomás-Barberán FA. Interaction between phenolics and gut microbiota. J Agric Food Chem. 2009;57(15):6485–6501.
29. Messina M, et al. Soy foods, isoflavones, and the health of postmenopausal women. Am J Clin Nutr. 2010;91(5):1138–1145.
30. Wagenlehner FME, et al. National S3 Guideline on uncomplicated urinary tract infections. Urologe A. 2011;50(2):153–169.
31. Kaptchuk TJ. Placebo Studies and Ritual Theory: A Comparative Analysis. Philos Trans R Soc Lond B Biol Sci. 2011;366(1572):1849–1858.
32. Lee RT, et al. Prevalence of potential interactions of medications, including herbs and supplements, before, during, and after chemotherapy in patients with breast and prostate cancer. Cancer. 2021 Jun 1;127(11):1827-1835
Integrative Pflege
Autorin
Sara Kohler, MScN
Einleitung und Definition
Die Integrative Pflege (IP) basiert auf der Definition professioneller Pflege (1). Diese umfasst [Zitat] «die eigenverantwortliche Versorgung und Betreuung, allein oder in Kooperation mit anderen Berufsangehörigen, von Menschen aller Altersgruppen, in allen Lebenssituationen (Settings). Weitere Schlüsselaufgaben der Pflege sind Wahrnehmung der Interessen und Bedürfnisse (Advocacy), Förderung einer sicheren Umgebung, Forschung, Mitwirkung in der Gestaltung der Gesundheitspolitik sowie im Management des Gesundheitswesens und in der Bildung» (1).
Sie versteht sich als Ergänzung oder Erweiterung der professionellen, «konventionellen» Pflege (KP) (2, 3).
Die Erweiterung ist anhand von sechs Prinzipien darstellbar (3):
1. Menschliche Wesen sind untrennbar mit ihrer Umgebung verbunden.
2. Der Mensch hat die angeborene Fähigkeit zu Gesundheit und Wohlbefinden.
3. Die Natur hat heilende und stärkende Eigenschaften.
4. Integrative Pflege ist personenzentriert und beziehungsorientiert.
5. Integrative Pflege ist eine evidenzbasierte Praxis, die das gesamte Spektrum therapeutischer Modalitäten nutzt – von wenig bis stark intensiv/invasiv.
6. Sie konzentriert sich auf das Wohlbefinden der Pflegefachpersonen und der betreuten Personen.
Die IP umfasst ein koordiniertes professionelles Assessment des Kontextes, der Patient/-innen-Bedürfnisse (4) sowie den Einbezug der vorhandenen Evidenz (2). Sie beinhaltet zudem die Selbstfürsorge der Fachpersonen (3). IP verfolgt das Ziel, die Gesundheit der Patient/-innen zu stärken und deren Wohlbefinden sowie das ihrer Angehörigen zu fördern (3), und findet im interprofessionellen Team statt (2).
Die Salutogenese (5, 6) leitet das pflegerische Handeln ebenso wie das bio-psycho-sozial-spirituelle Modell und den Ansatz der Patientenzentrierung.
Integrative Pflegefachpersonen sind in der Lage, Patient/-innen bezüglich komplementärer Methoden zu beraten, Risiken zu erkennen und auf Basis eines integrativen Assessments (4) individualisierte Behandlungspläne zu erstellen. Je nach Hintergrund führen sie komplementäre Pflegeinterventionen (KPI) durch, die den Heilungsprozess unterstützen können. Die integrative Pflegefachperson bemüht sich aktiv um das eigene Wohlbefinden sowie das ihrer Kolleg/-innen und der behandelten Personen.
Die Curricula der KP enthalten heute, entgegen dem historischen Pflegeverständnis (7, 8), meist keine KPI mehr (9). Der ganzheitliche Pflegeansatz (z. B. «Anwendung von frischer Luft, Licht, Wärme, Ruhe und Ernährung, Förderung der Lebenskraft») (10, 11) gerät immer mehr unter Druck. Dies könnte bspw. ein Grund für 40 % Berufsaussteiger/-innen (12) sein. Auch der von 50 % der Onkologiepflegefachpersonen beklagte Zeitmangel für Zuwendung im Alltag (13) könnte hierin begründet sein. Sinnhaftigkeit und die Möglichkeit, das Leben anderer positiv beeinflussen zu können, sind Prädiktoren für den Verbleib im Beruf (14, 15). Auch die Integration ist von jeher Bestandteil der Pflege als Disziplin – sie leitet das Denken, Handeln und die Beziehungen (3).
Um die Aus- und Weiterbildung der IP künftig zu stärken, wurden, basierend auf einem Forschungsprojekt, ein Kompetenzprofil sowie ein Handbuch für Lehrpersonen entwickelt (2). Zudem besteht ein breites Angebot an Fort- und Weiterbildungen im Bereich der komplementären Pflegeinterventionen.
Diagnostik und therapeutisches Vorgehen
Die Diagnostik wird geleitet vom Pflegeprozess (16, 17). Ausgehend von der Anamnese und dem integrativen Assessment (4) wird im interprofessionellen Team (18) die gemeinsame Zielsetzung für die Patient/-innen geplant. Die Zielsetzungen bilden dann wiederum die Basis für den individuellen Interventionsplan, welcher um KPI (18) erweitert ist und dem Prinzip folgt, sich von am wenigsten invasiv zu invasiv vorzuarbeiten (3). Aufklärung, Beratung und Anleitung sind hierbei ebenso elementare Bestandteile (19, 20). Die gemeinsame Evaluation mit den Patient/-innen und die erneute Besprechung im interprofessionellen Team setzen den diagnostisch- therapeutischen Kreislauf fort. Es handelt sich hierbei um einen iterativen Prozess, der sich jeweils an der aktuellen Situation der Patient/-innen orientiert (16).
Komplementäre Pflegeinterventionen
KPI verfolgen typischerweise das Ziel, Symptome oder Nebenwirkungen der Antitumortherapie vorzubeugen oder zu lindern (21, 22). Es gibt einfache KPI, welche alle IP nach kurzer Einführung anwenden können (z. B. Salbenauflagen), und komplexere KPI, welche eine gezielte Fort- oder Weiterbildung benötigen (z. B. rhythmische Einreibungen oder Aromatherapie) (3). Die Auswahl der Interventionen basiert immer auf der vorhandenen Evidenz, der Expertise der IP sowie der individuellen Patient/-innen-Situation. Die KPI sollten zudem immer im Kontext der interprofessionellen Interventionsplanung gewählt werden.
Beispielhaft wird in Tab. 1 dargestellt, welcher integrative Pflegeansatz bei der Behandlung einer Schlafstörung Einsatz finden kann. In dieser Darstellung wird zudem deutlich, dass nicht zwingend alle Massnahmen durch die Pflegefachperson durchgeführt werden müssen, sondern allenfalls eine Anleitung (unter Einbezug vorhandener Angebote, bspw. der Krebsliga) oder auch eine Beratung stattfinden kann. Zudem werden immer auch andere Symptome berücksichtigt, welche allenfalls Einfluss auf den Schlaf zeigen können (z. B. Schmerz oder Hitzewallungen).
Kontraindikationen
Komplementäre Pflegeinterventionen sind meist nebenwirkungsarm (18), sollten jedoch trotzdem immer unter Berücksichtigung verschiedener Kontraindikationen wie relevanten Hautveränderungen, Allergien auf Einzelsubstanzen oder klinisch instabilen Situationen wie Fieber betrachtet werden. Auch Abneigungen gegen Gerüche oder Sturzgefahr (z. B. nach Öleinreibungen an den Füssen) können Aspekte sein, welche in die Entscheidungsfindung einbezogen werden sollten.
Evidenz der Integrativen Pflege
Für die Forschungsfrage der potenziellen Wirksamkeit der IP als Konzept gibt es keine spezifischen Studien. Es werden zunehmend einzelne Interventionen untersucht (30–35) und Konsensusprozesse (36) etabliert. Die methodische Qualität dieser Studien schwankt jedoch sehr und erlaubt zum aktuellen Zeitpunkt für viele Interventionen lediglich Aussagen bezüglich eines positiven Potenzials. Im Bereich der IP sollte es daher künftig ein Ziel sein, die Interventionen vermehrt auch im Setting multimodaler Therapien oder komplexer Pflegeinterventionen (37) zu untersuchen.
Implikationen für das Schweizer Setting
Übertragen auf den Schweizer Kontext bedeutet dies, dass integrative Pflegefachpersonen in der Onkologie gemeinsam im multiprofessionellen Team für die Patient/-innen einen echten Mehrwert leisten können.
In verschiedenen SNIO-Zentren (www.integrative-oncology.ch) bestehen oder entwickeln sich Angebote der IP, gefördert durch Weiterbildungen und Integration von KPI in die Routineabläufe der onkologischen Tageskliniken und Abteilungen.
Fazit
Das Konzept der IP bietet eine Chance, sowohl den Bedürfnissen der Patient/-innen als auch den Herausforderungen des Fachkräftemangels zu begegnen. Die aktuellen Entwicklungen im Bereich der Integrativen Onkologie bieten eine einmalige Chance, auch die IP zu entwickeln und damit einen Beitrag für den Erhalt und die Erweiterung professioneller Pflege zu leisten. «Das kollektive Bestreben und die Passion der Pflegefachpersonen im integrativen Setting ist, dass Integrative Pflege künftig Pflege sein wird» (3).
Literatur
1. White, J., Gunn, M., Chiarella, M., Catton, H. & Stewart, D. (2025). Renewing the Definitions of ‚nursing‘ and ‚a nurse‘. Final project report, June 2025. International Council of Nurses.
2. Lunde A, Busch M, Gunnarsdottir TJ, Falkenberg T, van Dijk M, van der Heijden MJE. Integrative Nursing – Handbook for Teachers in Nursing [Internet]. Overbosch Communicate; 2023 [cited 2025 Apr 17]. Available from: https://pure.eur.nl/ws/portalfiles/portal/83146353/Integrative_Nursing_Handbook_for_Teachers_in_Nursing.pdf
3. Kreitzer, M.J. & Koithan, M. (2019). Integrative Nursing (2. Aufl.). Oxford University Press.
4. Voss, M. E., Sandquist, L., Otremba, K. & Kreitzer, M. J. (2023). Integrative Nursing: A framework for Whole-Person Mental Health Care. Creative Nursing, 29(1), 1-19.
5. Libster, M. M. (2024). Integrative Nursing as a rudder for salutogenic system change. J Integr Nurs, 6, 1-2.
6. Erikson, M. & Langeland, E. (2025). Salutogenesis in the Context of Health Care. In M. Eriksson, L. Vaandrager & B. Lindström (Hrsg.) The Hitchiker`s Guide to Salutogenesis – From the Ottawa Charter for Health Promotion to Planetary Health (2. Aufl.). Springer
7. Nightingale F. Notes on Nursing (unabridged republication of the first American edition published in 1860). New York: Dover; 1969.
8. Ingenbohl Schwestern. Die Krankenpflege zum Gebrauch der barmherzigen Schwestern. Buchdruckerei des Mutterhauses in Ingenbohl; 1861.
9. Van der Heijden
10. Bühring U, Sonn A. Erklärungsansätze- Forschung in Phytotherapie und Pflege. In: Bührung U, Sonn A, editors. Heilpflanzen in der Pflege. Bern: Hans Huber; 2013.
11. Thüler, M. Wohltuende Wickel – Wickel und Kompressen in der Kranken- und Gesundheitspflege (8. Aufl.). Maya Thüler Verlag; 1998.
12. Schweizerisches Gesundheitsobservatorium (Obsan). Gesundheitsfachkräfte in der Schweiz: Absicht im Beruf zu bleiben; 2024 [cited July 9]. Available from: obsan_bulletin_2024_09_d.pdf
13. Eicher, M. Ketzer, M. & Simon, M. Wie geht es den Onkologiepflegenden in der Schweiz? Der Swiss-Austrian Oncology Nurses Survey (SAnOS). Onkologiepflege (2024).
14. McKenna, L., Mambu, I. R., Sommers, C. L., Reisenhofer, S. & McCaughan, J. Nurses` and nursing students` reasons for entering the profession: content analysis of open-ended questions. BMC Nursing (2023) 22(1):152. Doi: 10.1186/s12912-023-01307-8.
15. Chmielewski, A., Przymuszala, P. & Marciniak, R. Why do young people choose nursing as their future profession? – a qualitative study on polish nursing students` motivationg factors to apply to nursing and work in the profession after graduation. BMC Medical Education (2025) 25:343. doi:10.1186/s12909-025-06899-0
16. Hojdelewicz, B. M. (2018). Der Pflegeprozess – Prozesshafte Pflegebeziehung. facultas
17. Kessler, P. D., Monsen, K. A., Lu, S.-C. & Kreitzer, M. J. (2020). Validating standardized integrative nursing guideliens for symptom management. EC Nursing and Healthcare, 2(2), 1-10.
18. Mahler & Joos (Hrsg.) (2025). Integrative Interventionen in der Onkologie – Ein interprofessionelles Praxis- und Beratungsbuch. hogrefe
19. Wagner, Th., Winkler, M., Idler, Ch. & Heine, R. (2023). Orale Mukositis vorbeugen und behandeln – Naturheilkundliche Interventionen während und nach Chemotherapie. PROCARE, 3, 36-38.
20. Kohler, S. & Alig, B. (2023). Komplementäre Pflege in der Onkologie. Die Urologie, 62, 1217-1220. Doi:10.1007/s00120-023-02217-y
21. Klafke, N. Bossert, J., Kröger, B., Neuberger, P., Heyder, U., Layer, M., Winkler, M., Idler, C., Kaschdailewitsch, E., Heine, R., John, H., Zielke, T., Schmeling, B., Joy, S., Mertens, I., Babadag-Savas, B., Kohler, S., Mahler, C., Witt, C. M., Steinmann, D., Voiss, P. & Stolz, R. (2023). Prevention and treatment of chemotherapy-induced peripheral neuropathy (CIPN) with non-pharmacological interventions: clinical recommendations from a systematic scoping review and an expert consensus process. Medical Sciences. 11(1), S. 15. Doi:10.3390/medsci11010015
22. Mentink, M., Verbeek, D., Noordman, J., Timmer-Bonte, A., von Rosenstiel, I. & van Dulmen, S. (2023). The Effects of complementary therapies on patient-reported outcomes: An overview of recent systematic reviews in oncology. Cancers, 15, 4513. Doi: 10.3390/cancers15184513
23. Riemann, D., Baum, E., Cohrs, S., Crönlein, T., Hajak, G., Hertenstein, E., Klose, P., Langhorst, J., Mayer, G. & Nissen, C. (2017). S-3 Leitlinie nicht-erholsamer Schlaf/Schlafstörungen. Somnologie, 21(1), 2-44. Doi: 10.1007/s11818-016-0097-x
24. Blackburn, L., Achor, S., Allen, B., Bauchmire, N., Dunnington, D., Klisovic, R. B., Naber, S. J., Roblee, K., Samczak, A., Tomlinson-Pinkham, K. & Chipps, E. (2017). The Effect of Aromatherapy on Insomnia and other common symptoms among patinets with acute leukemia. Oncol. Nurs. For., 44(4), E185-E193. Doi:10.1188/17.ONF.E185-E193
25. Özkaraman, A. Dügüm, Ö., Yilmaz, H. Ö. & Yeşilbalkan, Ö. U. (2018). The effect of lavender on anxiety and sleep quality in patients treated with chemotherapy. Clinical Journal of Oncology Nursing, 22(2), 203-210. Doi: 10.1188/18.CJON.203-210
26. Reangsing, c., Punsuwun, S. & Oerther, S. (2025). Effects of mindfulness-based interventions (MBIs) on quality of sleep among patients with cancer: A systematic review and meta-analysis of randomized controlled trials. Journal of Psychosomatic Research, 192, 112110. Doi:10.1016/j.jpsychores.2025.112110
27. Mehta, R., Sharma, K., Potters, L., Wernicke, A. G. & Parashar, B. (2019). Evidence for the Role of Mindfulness in Cancer: Benefits and Techniques. Cureus., 11(5), e4629. Doi:10.7759/cureus.4629
28. Deutsche Krebsgesellschaft, Deutsche Krebshilfe & AWMF. (2024). S-3 Leitlinie Komplementärmedizin in der Behandlung von in der Behandlung von onkologischen PatientInnen, angversion2.0, AWMF-Registernummer: 032-055QL. Abgerufen am 11.09.2025 von https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Komplement %C3 %A4r/Version_2/LL_Komplement %C3 %A4rmedizin_Langversion_2.0.pdf
29. Voiss, P., Felber, S., Joy, S., Mertens, I., Cramer, H., Klose, P., Paul, A., Layer, M., Klafke, N., Neuberger, P., Heyder, U., Stolz, R., Winkler, M., Idler, C., Heine, R., Kaschdailewitsch, E., John, H., Schmeling, B., Zielke, T., Witt, C. M. & Steinmann, D. (2018). Nursing Procedures for cancer patients with insomnia- non pharmacological recommendations developed with a mixed methods approach. Unveröffentlichtes Manuskript.
30. Ostermann T, Blaser G, Bertram M, Michalsen A, Matthiessen PF, Kraft K. Effects of rhythmic embrocation therapy with solum oil in chronic pain patients: a prospective observational study. Clin J Pain. 2008 Mar-Apr;24(3):237-43.
31. Mühlenpfordt I, Stritter W, Bertram M, Ben-Arye E, Seifert G. The power of touch: external applications from whole medical systems in the care of cancer patients (literature review). Support Care Cancer. 2020 Feb;28(2):461-471.
32. Mühlenpfordt I, Blakeslee SB, Everding J, Cramer H, Seifert G, Stritter W. Touching body, soul, and spirit? Understanding external applications from integrative medicine: A mixed methods systematic review. Front Med (Lausanne). 2022 Dec 22;9:960960
33. Perneger E, Stollar F, Schoen-Angerer TV, Hudelson P, Huber BM. „It‘s not just another task“: Pediatric Nurses‘ Perspectives on Using Lavender Oil Chest Wraps as Complementary Treatment for Infants with Bronchiolitis. Complement Ther Med. 2025 Aug 22:103236
34. Stritter, W., Gross, M. M., Miltner, D., Rapp, D., Wilde, B., Eggert, A., Steckhan, N. & Seifert, G. (2020). More than just warmth – The perception of warmth and relaxation through warming compresses. Complementary Therapie in Medicine, 54, 102537.
35) P., Stritter, W., von Mackensen, I., Mehrhof, F., Foucré, C., Erhardt, V. H., Beck, M., Gebert, P., Kalinauskaite, G., Luchte, J. S., Stromberger, C., Budach, V., Eggert, A. & Seifert, G. (2021). External application of liver compresses to reduce fatigue in patients with metastatic cancer undergoing radiation therapy, a randomized clinical trial. Radiat Oncol, 16(76), 1-9. Doi: 10.1186/s13014-021-01757-x
36. Stolz, R., Klafke, N., Kröger, B., Boltenhagen, U., Kaltenbach, A., Heine, R., Idler, C., Layer, M., Kohler, S., Winklr, M., Voiss, P., Joos, S. & Mahler, C. (2021). Generierung von Evidenz zu naturheilkundlichen Pflegeinterventionen in der Onkologie – ein systematisches Verfahren. Z. Evid. Fortbild. Qual. Gesundh. Wesen (ZEFQ), 166, 1-7.
37. Busch, A.-K., Mathier, I. & Kohler, S. (2024). Development of an integrative nursing intervention as part of outpatient care in a general practitioner setting in Switzerland. In a. Kremling, C. Buch & J. (Schildmann (Hrsg.) Complementary Medicine in Healthcare – International Perspectives on Concepts and Normative Challenges. Kohlhammer: Stuttgart
Akupunktur und Traditionelle Chinesische Medizin (TCM)
Autorinnen
Dr. med. Isabell Ge
Dr. med. Nurgül Usluoglu
Definition
Das Huang Di Nei Jing (Innerer Klassiker des Gelben Fürsten) ist das grundlegende Werk der Traditionellen Chinesischen Medizin (TCM) und wird um 200 v. Chr datiert. Die TCM besteht aus fünf Säulen, welche neben der Akupunktur, Arzneimitteln (Kräutern), Ernährung auch Tuina (Massage) und Gesundheitsübungen in Form von Qi Gong/Tai Chi umfassen.
Diagnostik
Yin und Yang bilden zusammen mit dem Qi das grundlegende Konzept. Yin und Yang stehen für Gegensätze, aber gleichzeitig auch für Ergänzungen. Krankheitssymptome gelten als Ausdruck eines Yin/Yang-Ungleichgewichts oder gestörten Qi-Flusses. Neben Anamnese, Inspektion und Palpation ähnlich der westlichen Medizin sind insbesondere Zungen- und Pulsdiagnostik charakteristisch für die TCM. Die Zunge wird nach Form, Farbe, Belag, Feuchtigkeit sowie Besonderheiten wie Rissen beurteilt, welche Rückschlüsse über die gestörten Funktionskreise und den Schweregrad der Erkrankung geben (1). Der Puls wird mit drei Fingern an beiden Handgelenken ertastet und nach Frequenz, Rhythmus, Volumen und Form beurteilt, wobei jede Tastposition einem bestimmten Funktionskreis zugeordnet ist (2).
Therapeutisches Vorgehen und Risikoabschätzung
Alle therapeutischen Interventionen zielen auf die Harmonisierung des Qi-Flusses und der Yin/Yang-Dynamik ab: Bewegen von Qi-Stagnationen, Lösen von Qi-Blockaden, Auffüllen bei Qi-Mangel, Zerstreuen bei pathologischen Qi-Ansammlungen. Dies geschieht durch Stimulation von Akupunkturpunkten und Leitbahnen (Akupunktur, Tuina, Qi Gong/Tai Chi) und durch Qi-beeinflussende Arznei- und Nahrungsmittel.
• Akupunktur: 12 Hauptleitbahnen (6 Yin-Meridiane,
6 Yang-Meridiane) verbinden Gewebe und Strukturen des Körpers wie ein komplexes Netzwerk zu einer integrierten Ganzheit. 360 klassische Akupunkturpunkte liegen auf diesen Meridianen und besitzen neben der lokoregionalen Wirkung eine Fernwirkung auf zugehöriges Organ, Gewebe, zugehörige Emotion. Zusätzlich gibt es viele sogenannte Extrapunkte. Durch Setzen von Metallnadeln an definierten Akupunkturpunkten sollen Funktionskreise angeregt und die körpereigene Regulation wiederhergestellt werden. Kontraindikationen sind u. a. schwere Thrombozytopenie, schwere Immunsuppression, eine aktive Infektion oder Fieberzustand (3) (Abb. 1).
• In der Kräutertherapie werden Rezepturen gemäss Krankheitsmustern, individuellen Symptomen und der Konstitution der Patient/-innen zusammengestellt. Der breite Anwendungsbereich reicht vom einfachen Infekt bis hin zu Schmerzen, menopausalen Beschwerden, Schlafstörungen, Fatigue usw. Mögliche theoretische Interaktionen (v. a. Lebermetabolismus-CYP-System, Phytoöstrogene) müssen beachtet werden (4). Jedoch gibt es kaum Daten zur klinischen Relevanz dieser Interaktionen. Entscheidend in der Praxis sind eine offene Kommunikation und der fachliche Austausch (5).
• Nahrungsmittel in der TCM werden nach Temperaturverhalten, Geschmack und Wirkung auf die Funktionskreise eingesetzt, um Yin/Yang auszugleichen und Qi zu stärken. Risiken bestehen in restriktiven Diäten oder unkritischer Selbstmedikation, daher sollten Empfehlungen individuell und interdisziplinär abgestimmt werden.
• Qi Gong und Tai Chi sind Bewegungstherapien, die fliessende Körperbewegungen mit Atmung und Achtsamkeit verbinden. Sie zielen darauf ab, den Qi-Fluss zu fördern, Stress zu reduzieren und Wohlbefinden zu vermitteln. Vor allem Qi Gong ist auch für geschwächte oder untrainierte Patient/-innen geeignet. Bei jeder Bewegungstherapie müssen instabile Knochenmetastasen oder Blutungsrisiken bei Sturz mit schwerer Thrombozytopenie beachtet werden.
Evidenz
In den letzten zwei Jahrzehnten hat die Evidenz vor allem zu Akupunktur und Qi Gong/Tai Chi deutlich zugenommen.
Neurophysiologische Untersuchungen zeigen, dass Akupunktur v. a. über neuronale Reize lokale und systemische Effekte im Körper auslösen können (6). Lokale Effekte sind Förderung der Durchblutung und Wundheilung (Schmerzen, Dysgeusie) (7, 8). Zentral und systemisch kann es zur Freisetzung von Endorphinen, Serotonin und anderen Neurotransmittern kommen (Depressivität, Schmerzen, Lebensqualität) (9, 10), zur Regulation des Sympathikus-Parasympathikus-Systems (Schlaf, menopausale Beschwerden) (11) sowie zur Veränderung der Schmerzverarbeitung und -perzeption (12, 13).
Qi Gong/Tai Chi sprechen durch kombinierte Körperarbeit mit Achtsamkeit mehrere Ebenen (körperlich, geistig, emotional) an. Der Wirkmechanismus beruht einerseits auf dem Training von Kraft, Koordination und Kognition, andererseits auf einer veränderten Reaktivität in der Hypothalamus-Hypophysen-Nebennieren-Achse sowie auf der Modulation des autonomen Nervensystems zugunsten einer parasympathischen Dominanz (14). Aufgrund der mehrschichtigen Wirkung können beide Therapieformen auch als Teil der Mind Body Medicine angesehen werden (15).
Im klinischen Kontext zeigen eine Reihe von randomisierten kontrollierten Studien, systematische Reviews sowie Metaanalysen positive Effekte. Zusammengefasst in den Leitlinien zu Integrativer Onkologie (z. B. S3-Leitlinie oder ASCO-/SIO-Practice-Guidelines) werden insbesondere folgende Bereiche hervorgehoben (16–19):
• Schmerzen: Akupunktur zeigt signifikante Verbesserungen bei tumor- oder therapiebedingten Schmerzen (16, 17).
• Chemotherapie-induzierte Übelkeit und Erbrechen: v. a. durch die Akupunktur oder Akupressur des Punktes Perikard 6 (16, 18)
• Fatigue: Qi Gong/Tai Chi, (Selbst-)Akupressur und Akupunktur haben einen moderaten Effekt auf tumorbedingte Fatigue während und nach abgeschlossener Therapie (16, 19).
• Schlafstörungen: Qi Gong/Tai Chi sollte bei Ein- und Durchschlafstörungen bei onkologischen Patient/-innen während und nach abgeschlossener Therapie zum Einsatz kommen. (Selbst-)Akupressur und Akupunktur können ebenfalls angewandt werden (16, 20).
• Chemotherapie-induzierte periphere Neuropathie und kognitive Beeinträchtigung: In beiden Fällen kann Akupunktur die Beschwerden lindern (16, 17).
• Menopausale Symptome: Akupunktur kann eine Symptomlinderung erzielen, ähnlich der Wirkung von Gabapentin/Venlafaxin, bei gleichzeitig deutlich geringeren Nebenwirkungen. Da Akupunktur keinen Einfluss auf die Sekretion der Geschlechtshormone hat, kann sie auch bei hormonsensitiven Krebsarten zum Einsatz kommen (16).
Qualitätskriterien
Folgende Kriterien sollten erfüllt sein für die Anwendung von Akupunktur und TCM in der Schweiz:
• Zertifizierte Weiterbildung: siehe Artikel Edukation
• Interdisziplinäre Abstimmung: Als Teil der Integrativen Onkologie sollte die Anwendung interdisziplinär mit den behandelnden onkologischen Fachpersonen abgesprochen sein (Indikation, Risiken [siehe oben], Ergebniserwartung).
• Kontinuierliche berufliche Weiterentwicklung und Evaluation (Qualitätszirkel), Teilnahme an Forschungsprojekten
Fazit
TCM als ganzheitliches Medizinsystem bietet vor allem durch die nicht pharmakologischen Interventionen wie Akupunktur, Akupressur, Qi Gong/Tai Chi wirksame, nebenwirkungsarme Optionen zur Unterstützung onkologischer Patient/-innen und kann substanziell zur patientenzentrierten, evidenzbasierten Ergänzung konventioneller Krebstherapien beitragen.
Literatur
1. Gerlach O. Praxis der chinesischen Zungendiagnostik: Elsevier Health Sciences; 2023.
2. Thews F. Pulsdiagnosen nach TCM-Regeln: Pulsgruppen, Pulsbilder und Detaildeutung: Georg Thieme Verlag; 2004.
3. de Valois B, Young T, Zollman C, Appleyard I, Ben-Arye E, Cummings M, et al. Acupuncture in cancer care: recommendations for safe practice (peer-reviewed expert opinion). Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer. 2024;32(4):229.
4. Lee RT, Kwon N, Wu J, To C, To S, Szmulewitz R, et al. Prevalence of potential interactions of medications, including herbs and supplements, before, during, and after chemotherapy in patients with breast and prostate cancer. Cancer. 2021;127(11):1827-35.
5. Rombouts MD, Karg RMY, Raddjoe SSP, Crul M. Over 40 % of cancer patients use complementary and alternative medications while receiving anticancer treatment. European journal of hospital pharmacy : science and practice. 2025;32(4):348-53.
6. Chen T, Zhang WW, Chu YX, Wang YQ. Acupuncture for Pain Management: Molecular Mechanisms of Action. The American journal of Chinese medicine. 2020;48(4):793-811.
7. Pellegrini M, Merlo FD, Agnello E, Monge T, Devecchi A, Casalone V, et al. Dysgeusia in Patients with Breast Cancer Treated with Chemotherapy-A Narrative Review. Nutrients. 2023;15(1).
8. Tsuchiya M, Sato EF, Inoue M, Asada A. Acupuncture enhances generation of nitric oxide and increases local circulation. Anesthesia and analgesia. 2007;104(2):301-7.
9. Cui J, Song W, Jin Y, Xu H, Fan K, Lin D, et al. Research Progress on the Mechanism of the Acupuncture Regulating Neuro-Endocrine-Immune Network System. Veterinary sciences. 2021;8(8).
10. Cheng KJ. Neurobiological mechanisms of acupuncture for some common illnesses: a clinician‘s perspective. Journal of acupuncture and meridian studies. 2014;7(3):105-14.
11. Li QQ, Shi GX, Xu Q, Wang J, Liu CZ, Wang LP. Acupuncture effect and central autonomic regulation. Evidence-based complementary and alternative medicine : eCAM. 2013;2013:267959.
12. Lin JG, Kotha P, Chen YH. Understandings of acupuncture application and mechanisms. American journal of translational research. 2022;14(3):1469-81.
13. Huang W, Pach D, Napadow V, Park K, Long X, Neumann J, et al. Characterizing acupuncture stimuli using brain imaging with FMRI–a systematic review and meta-analysis of the literature. PloS one. 2012;7(4):e32960.
14. Jahnke R, Larkey L, Rogers C, Etnier J, Lin F. A comprehensive review of health benefits of qigong and tai chi. American journal of health promotion : AJHP. 2010;24(6):e1-e25.
15. Yeung A, Chan JSM, Cheung JC, Zou L. Qigong and Tai-Chi for Mood Regulation. Focus (American Psychiatric Publishing). 2018;16(1):40-7.
16. Onkologie L. S3-Leitlinie Komplementärmedizin in der Behandlung von onkologischen PatientInnen, Version 2.0. https://register.awmf.org/assets/guidelines/032-055OLl__S3_Komplementaermedizin-in-der-Behandlung-von-onkologischen-PatientInnen-2025-06.pdf. 2024.
17. Mao JJ, Ismaila N, Bao T, Barton D, Ben-Arye E, Garland EL, et al. Integrative Medicine for Pain Management in Oncology: Society for Integrative Oncology-ASCO Guideline. https://ascopubs.org/doi/10.1200/JCO.22.01357. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2022;40(34):3998-4024.
18. Lyman GH, Greenlee H, Bohlke K, Bao T, DeMichele AM, Deng GE, et al. Integrative Therapies During and After Breast Cancer Treatment: ASCO Endorsement of the SIO Clinical Practice Guideline. https://ascopubs.org/doi/10.1200/JCO.2018.79.2721. Journal of Clinical Oncology. 2018;36(25):2647-55.
19. Bower JE, Lacchetti C, Alici Y, Barton DL, Bruner D, Canin BE, et al. Management of Fatigue in Adult Survivors of Cancer: ASCO–Society for Integrative Oncology Guideline Update. https://ascopubs.org/doi/10.1200/JCO.24.00541. Journal of Clinical Oncology. 2024;42(20):2456-87.
20. Zick SM, Sen A, Wyatt GK, Murphy SL, Arnedt JT, Harris RE. Investigation of 2 Types of Self-administered Acupressure for Persistent Cancer-Related Fatigue in Breast Cancer Survivors: A Randomized Clinical Trial. JAMA oncology. 2016;2(11):1470-6.
Natalie Kalbermatten 1, Chantal Berna 2, Natacha Bordry 2, Marie-Estelle Gaignard 3, Isabell Ge 4, Sara Kohler 5, Tilly Nothhelfer 6, Florian Strasser 7, 8, Nurgül Usluoglu 9, Claudia M. Witt 10, Ursula Wolf 11
1 Onkologie/Hämatologie, Kantonsspital Münsterlingen, Schweiz
2 Centre de médecine intégrative et complémentaire, CHUV, Lausanne, Schweiz
3 Department of Oncology, Swiss Cancer Center Leman, Geneva University Hospitals, Schweiz
4 Frauenklinik und Brustklinik, Universitätsspital Basel, Schweiz
5 Zürcher Hochschule für Angewandte Wissenschaften, Institut für Pflege, Winterthur, Schweiz
6 Klinik für Onkologie und Hämatologie, Kantonsspital Baden, Schweiz
7 Zentrum Integrative Medizin, Hoch Health Ostschweiz, Kantonsspital St. Gallen, Schweiz
8 Cancer Fatigue Clinic (Münsterlingen, Sargans, Schaffhausen), Schweiz
9 Onkologie und Hämatologie, Spital Thun, Schweiz
10 Lehrstuhl Komplementär- und Integrative Medizin, Universität Zürich, Schweiz
11 Institut für Komplementäre und Integrative Medizin, Universität Bern, Schweiz
Onkologie/Hämatologie Kantonsspital Münsterlingen
Spitalcampus 1
CH-8596 Münsterlingen
natalie.kalbermatten@stgag.ch
Marie-Estelle Gaignard ist Board Member des Swiss Network for Integrative Oncology.
Natalie Kalbermatten ist Vizepräsidentin des Swiss Network for Integrative Oncology und ist Mitglied der Eigentümerfamilie eines Unternehmens, das pflanzliche Arzneimittel herstellt und vertreibt.
Matthias Kröz ist Mitarbeiter der Klinik Arlesheim AG.
Gisèle Montavon ist Board Member des Swiss Network for Integrative Oncology.
Tilly Nothhelfer hat Honorare für Vorträge, Beratung oder Teilnahme an Advisory Boards erhalten von Abbvie, Daiichi Sankyo, Eli Lilly Suisse, Novartis, Pfizer, Pierre Fabre, Astra Zeneca, Takeda.
Marc Schläppi ist Präsident des Swiss Network for Integrative Oncology.
Florian Strasser ist Extended Board Member des Swiss Network for Integrative Oncology, er hat Honorare für Vorträge, Beratung oder Teilnahme an Advisory Boards erhalten (letzte 5 Jahre) von Abbott Nutrition, Danone-Nutricia, Fresenius, Helsinn, Ology, Pfizer, Sanofi; er führt in selbstständiger Tätigkeit die ambulanten Sprechstunden der Cancer Fatigue Clinic durch.
Arnoud Templeton hat Honorare für Vorträge, Beratung oder Teilnahme an Advisory Boards erhalten von Astellas (I), Bayer (I), Janssen (I, P), Johnson&Johnson (P), Ipsen (I), Merck (P), MSD (I).
Claudia M. Witt ist Präsidentin des Schweizer Fachverband Mind Body Medicine und erhält Honorare für wissenschaftliche Vorträge zur Integrativen Onkologie und Entwicklung von Behandlungspfaden und Curricula von Schweizer und Deutschen Spitälern.