Les infections urinaires (IU) font partie des infections bactériennes les plus fréquentes chez les femmes et constituent un défi croissant en raison de la résistance antimicrobienne (RAM) croissante. Bien que les antibiotiques constituent un traitement efficace, ils sont associés à des risques tels que le développement d’une résistance, des effets secondaires et des perturbations du microbiome. C’est pourquoi les stratégies de prévention non antibiotiques pour les IU non compliquées et récurrentes chez les femmes non enceintes font l’objet d’une attention croissante. L’article met en lumière le contexte épidémiologique, les facteurs de risque à différentes étapes de la vie ainsi que les aspects du diagnostic différentiel, et présente des mesures non antibiotiques fondées sur des preuves, telles que les changements du comportement, l’œstrogénothérapie locale ou les phytothérapies.
Urinary tract infections (UTIs) are among the most common bacterial infections in women and represent a growing challenge due to increasing antimicrobial resistance (AMR). Although antibiotics are an effective therapy, they are associated with risks such as development of resistance, side effects and disruption of the microbiome. Therefore, non-antibiotic prevention strategies for non-complicated, recurrent UTIs in non-pregnant women are increasingly coming into focus. The article highlights the epidemiological background, risk factors in different life stages as well as differential diagnostic aspects and presents evidence-based non-antibiotic measures such as behavioral changes, local estrogen therapy or phytotherapeutics.
Keywords: Infections urinaires, prophylaxie non antibiotique, résistances antimicrobiennes, microbiome urogénital
«Il est impossible pour un être humain d’apprendre ce qu’il croit déjà savoir.»
Épictète, philosophe grec (env. 50–138 apr. J.-C.)
Introduction
Les antibiotiques sont efficaces tant dans le traitement des infections urinaires (IU) aiguës que dans la prophylaxie des IU récurrentes. Cependant, compte tenu de l’augmentation de la résistance aux antimicrobiens (RAM) et des complications qui y sont associées, des traitements alternatifs efficaces et une prophylaxie non antibiotique sont nécessaires. Dans cet article, nous nous intéresserons, dans la lignée de la pensée d’Épictète, aux approches préventives alternatives efficaces et non antibiotiques actuellement disponibles en Suisse pour les femmes non enceintes souffrant d’infections urinaires récurrentes non compliquées. Nous apportons ainsi une contribution importante à la prévention de la résistance aux antibiotiques.
Définition
Une infection urinaire est une infection du tractus urogénital présentant les symptômes typiques d’une cystite, tels que dys-urie, envie fréquente d’uriner, pollakiurie, douleur sus-pubienne ou hématurie. Dans le cas d’une infection ascendante telle que la pyélonéphrite, s’ajoutent des douleurs aux flancs, de la fièvre, des nausées ou des vomissements. La pyurie et une culture d’urine positive avec détection d’un uropathogène spécifique sont déterminantes pour le diagnostic. Une IU est considérée comme compliquée en cas d’anomalies anatomiques ou fonctionnelles, de cathétérisme permanent, de grossesse ou de transplantation rénale. Les IU récurrentes sont au moins 2 infections en 6 mois ou au moins 3 en 12 mois. Une nouvelle infection par le même agent pathogène dans les deux semaines suivant la fin du traitement est en revanche considérée comme une rechute. Les symptômes d’une vessie hyperactive idiopathique ou d’un syndrome de douleur vésical ressemblent parfois à ceux d’une infection urinaire, ce dont il faut tenir compte en l’absence d’amélioration malgré la prise d’antibiotiques et une analyse d’urine normale.
Épidémiologie
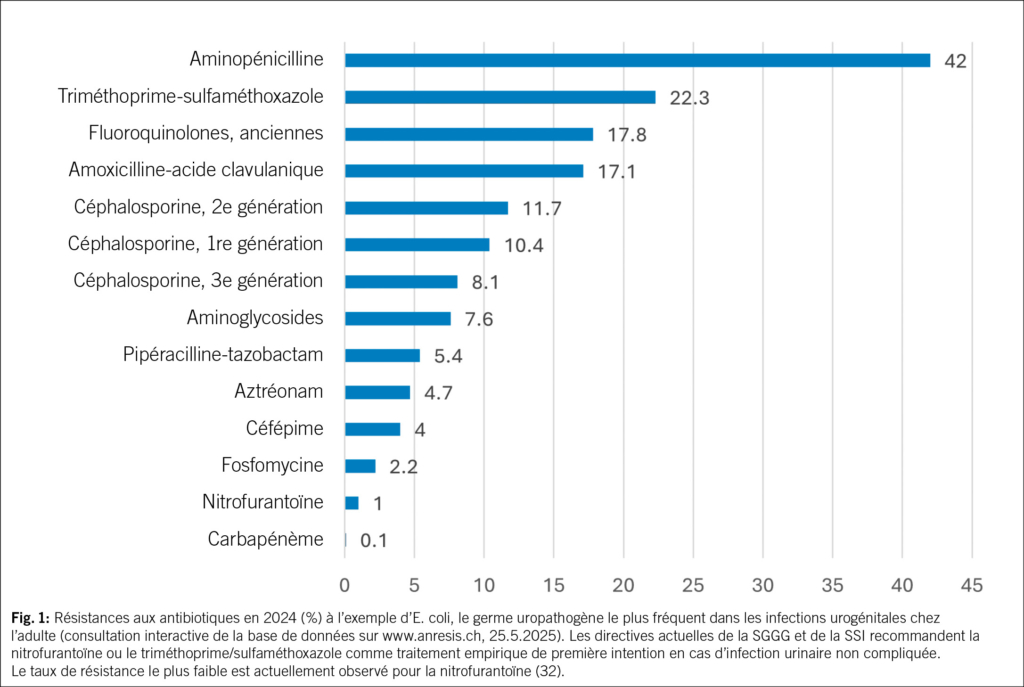
Les infections urinaires comptent parmi les infections bactériennes les plus fréquentes dans le monde et les plus fréquentes chez les femmes: une femme sur deux souffre d’une infection urinaire au cours de sa vie et une sur quatre en souffre plusieurs fois (1). La première recrudescence coïncide avec le début de l’activité sexuelle, les suivantes sont liées à la grossesse et à la ménopause. 20 % de tous les antibiotiques utilisés dans la pratique clinique quotidienne sont prescrits pour traiter des infections urinaires (2, 3). Les IU aiguës et récurrentes peuvent ainsi être traitées efficacement lorsque les traitements non antibiotiques échouent (4–7). À l’échelle mondiale, l’un des plus grands défis médicaux est toutefois l’augmentation de la résistance aux antimicrobiens (RAM) (Fig. 1) avec des agents pathogènes multirésistants et, par conséquent, une augmentation substantielle de la morbidité et de la mortalité (8). Cette question préoccupe également l’Organisation mondiale de la santé (OMS) (https://www.who.int/fr/health-topics/antimicrobial-resistance). La RAM est désormais l’une des causes de décès les plus fréquentes dans le monde, dépassant le VIH/SIDA ou le paludisme. En 2019, une étude a estimé que la RAM avait directement causé 1.27 million de décès et joué un rôle dans 4.95 millions d’autres (9). Il est donc urgent de trouver de nouveaux antibiotiques, mais les nouvelles autorisations sont rares.
Résistance aux antimicrobiens
Ce n’est que depuis peu qu’un nouvel antibiotique, la gépotidacin (autorisé par la FDA le 25 mars 2025), est disponible pour le traitement des infections urinaires non compliquées et de la gonorrhée (10). Son double mécanisme d’action inhibe l’ADN-gyrase bactérienne et la topoisomérase IV, ce qui pourrait réduire le développement de résistances. Reste à voir si cela fonctionnera in vivo. La vie trouve toujours un chemin – et les bactéries aussi. Investir ou non dans de nouveaux antibiotiques est avant tout une décision économique. Mais une utilisation rationnelle permet de réduire la RAM et de protéger nos systèmes de santé (11). C’est pourquoi le Conseil fédéral a lancé le 26 juin 2024 le plan d’action « One Health » dans le cadre de sa « stratégie Antibiorésistance » (StAR) 2024–2027 (12). L’objectif est le renforcement de mesures efficaces et de mettre en œuvre la StAR à l’aide de mesures contraignantes, innovantes et durables, en collaboration avec les offices fédéraux de la santé publique, de la sécurité alimentaire et des affaires vétérinaires, de l’agriculture et de l’environnement, ainsi qu’avec les cantons et d’autres acteurs. Dès lors, des mesures préventives contre les infections urinaires sont utiles pour réduire la consommation d’antibiotiques et le développement de résistances. En outre, l’utilisation d’antibiotiques est également néfaste en raison des effets secondaires suivants: Apparition fréquente de troubles gastro-intestinaux ou de mycoses vaginales, et plus rarement de réactions allergiques ou, comme dans le cas de la nitrofurantoïne, d’une fibrose pulmonaire induite. De plus, l’altération du microbiome de la vessie, du vagin et de l’intestin peut augmenter le risque pour de nouvelles IU et d’autres infections, comme p.ex. par Clostridioides difficile (4–7, 10, 13, 14). La fonction rénale et hépatique des patientes doit également être considérée lors d’un traitement antibiotique, tout comme les interactions possibles avec d’autres médicaments, en particulier chez les patientes âgées sous polypharmacie. Par ailleurs, l’expérience montre que la protection antibiotique prend fin à la fin du traitement.
Peut-on se passer d’antibiotiques?
Mais quand l’utilisation d’antibiotiques est-elle judicieuse? La détection de germes uropathogènes dans la culture d’urine, sans symptômes d’infection urinaire ( = bactériurie asymptomatique), ne nécessite en tout cas pas l’administration d’antibiotiques sauf en cas de grossesse ou d’intervention urologique. Même en cas d’infection urinaire non compliquée, du moins chez certaines patientes sans antécédents de pyélonéphrite et dont les symptômes ne durent que depuis 5 jours au maximum, un traitement non antibiotique avec hydratation accrue et anti-inflammatoires non stéroïdiens peut être tenté pendant 48 heures, (directive SSI).
Facteurs de risque d’infections urinaires récurrentes
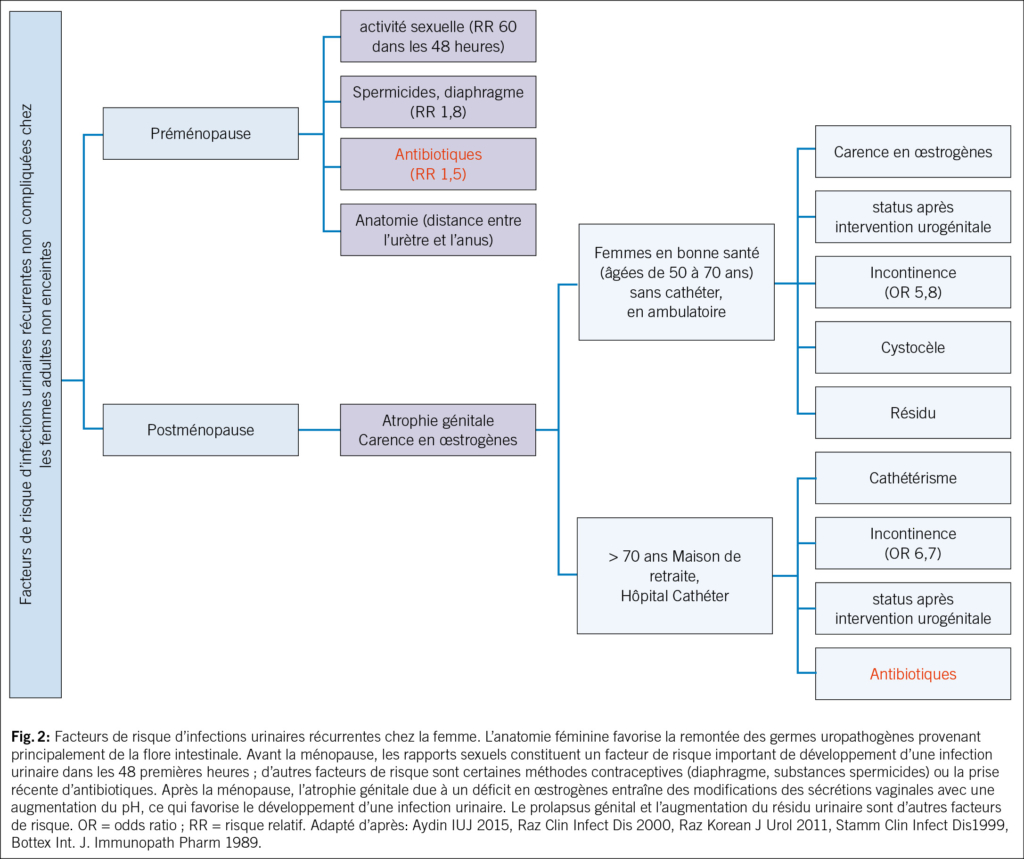
En 2012, un changement de paradigme s’est produit: l’urine n’est pas stérile, même chez les femmes en bonne santé (15, 16). Certaines bactéries E. coli et entérocoques semblent même avoir un effet protecteur (17). Donc, si le traitement antibiotique n’est pas toujours efficace et parfois même contre-productif, des options non antibiotiques deviendraient alors judicieuses. Ainsi, la réduction des facteurs de risque représente une approche importante. Ceux-ci varient pour les femmes avant et après la ménopause (Fig. 2). Parmi les facteurs de risque anatomiques, on compte les muqueuses périurétrales, l’urètre court et les distances entre son ouverture externe et le vagin et l’anus, ce qui favorise l’exposition aux germes uropathogènes provenant principalement de la flore intestinale et leur remontée dans les voies urinaires, et donc les IU (18, 19). Plus ces distances sont courtes, plus les récidives sont fréquentes. Les facteurs de risque préménopausiques sont principalement les rapports sexuels, l’utilisation de spermicides, un nouveau partenaire sexuel, des antécédents d’infections urinaires récurrentes chez la mère, des infections urinaires dans l’enfance et le traitement d’une bactériurie asymptomatique. Les facteurs de risque post-ménopausiques sont la colpite atrophique due à une carence en œstrogènes, une cystocèle et un volume résiduel urinaire augmenté (20). La carence en œstrogènes et la modification de l’urothélium qui en résulte, avec une altération du microbiome urogénital ou « urobiome », augmentent le risque d’IU (21, 22). Les femmes ménopausées souffrant d’infections urinaires récurrentes et prenant quotidiennement des antibiotiques présentent un urobiome modifié avec une augmentation des bactéries anaérobies par rapport aux femmes sans IU (23). Cependant, ce n’est probablement pas un micro-organisme spécifique de l’urobiome qui est associé aux infections urinaires récurrentes, mais plutôt un déséquilibre et un rapport modifié entre certaines espèces de lactobacilles et les bactéries anaérobies. Les antibiotiques ont un effet négatif sur le microbiome et augmentent ainsi le risque d’infections urinaires. Les futures stratégies thérapeutiques pourraient viser à influencer l’urobiome.
Diagnostic
En cas d’infections urinaires récurrentes, un examen gynécolo- gique ou urogynécologique est indiqué. L’examen de base com- prend l’anamnèse (début des infections urinaires, facteurs déclen- chants, comorbidités et facteurs de risque), l’analyse d’urine (bandelettes réactives, sédiment urinaire et culture d’urine avec test de résistance), le status gynécologique (évaluation d’un éventuel prolapsus génital, trophicité des tissus, frottis direct) et la détermination par échographie (US) du résidu urinaire. L’US des voies urinaires sert à exclure des anomalies anatomiques (diverticules urétraux, urolithiase). En cas de facteurs de risque ou d’hématurie indolore, une cystoscopie est indiquée dans l’intervalle. L’examen urodynamique et la mesure du flux urinaire permettent de distinguer une vessie hyperactive, un syndrome douloureux vésical ou une cystite interstitielle.
Options thérapeutiques et prophylactiques
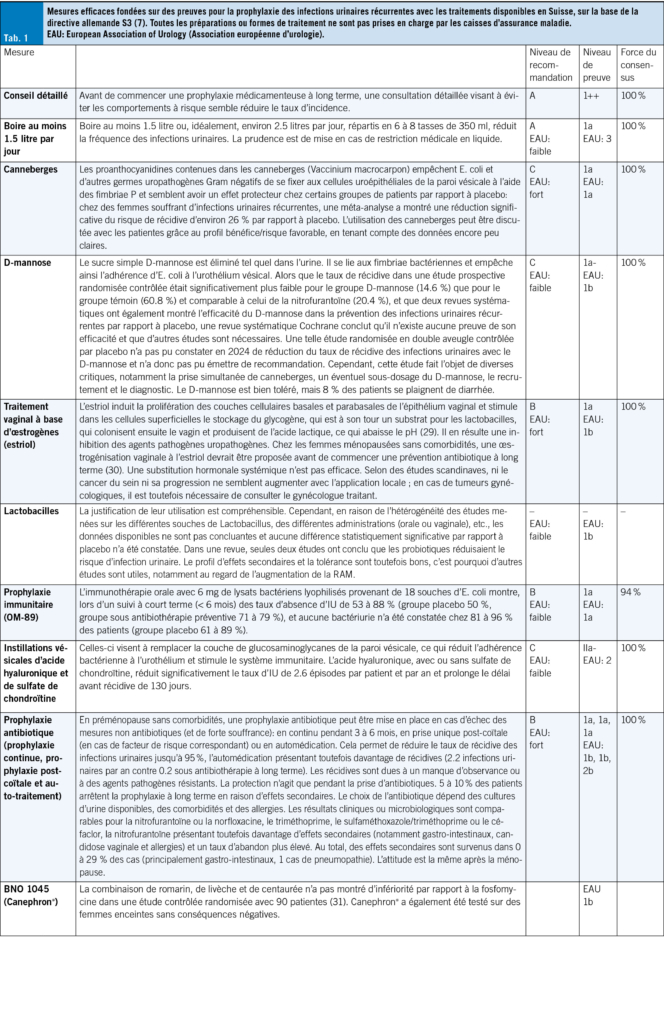
Dans la mesure du possible, les IU aiguës peuvent se traiter de manière symptomatique et sans antibiotiques dans les premiers jours (24). Jusqu’à 50 % des IU non compliquées guérissent ainsi, mais cela prend quelques jours de plus (25, 26). Toutefois, on ne doit pas craindre une infection ascendante: seuls 0.4 à 2.6 % des IU non compliquées non traitées évoluent vers une pyélonéphrite (27), qui se manifeste généralement par de la fièvre ou des douleurs aux flancs. Pour soulager les symptômes de gêne vésicale et favoriser la guérison, il est recommandé de boire suffisamment, ce qui favorise l’élimination des bactéries. En outre, les anti-inflammatoires non stéroïdiens (AINS) tels que l’ibuprofène ou les phytothérapies peuvent également aider (26, 28). En fin de compte, les antibiotiques sont plus efficaces que les AINS dans le traitement des infections urinaires non compliquées, car ils permettent une meilleure éradication bactérienne. En cas d’infections urinaires récurrentes, la prophylaxie et l’identification et la réduction des facteurs de risque sont prioritaires. Une sélection de mesures prophylactiques fondées sur des preuves est résumée dans le Tab 1.
PD Dr David Scheiner, 1, 2, 3
PD Dr Daniele Perucchini 1
Dr Olivia Ziviello 1
Dr Rebecca Zachariah 2, 3
Dr Sören Lange 2, 3
Dr Nicole Keller 2, 3, 4
Prof. Dr Cornelia Betschart 2, 3
1 Centre de la vessie de Zurich, Gottfried Keller-Strasse 7, 8001 Zurich
2 Clinique de gynécologie, Hôpital universitaire de Zurich, Frauenklinikstrasse 10, 8091 Zurich
3 Université de Zurich, Rämistrasse 71, 8006 Zurich
4 Gynécologie et obstétrique, Hôpital de Grabs, Spitalstrasse 44, 9472 Grabs
Copyright
Aerzteverlag medinfo AG
Cet article est une traduction de «info@gynäkologie» 04_25.
– Centre de la vessie de Zurich
Gottfried Keller-Strasse 7
8001 Zurich
– Clinique de gynécologie, Hôpital universitaire de Zurich
Frauenklinikstrasse 10
8091 Zurich
– Université de Zurich
Rämistrasse 71
8006 Zurich
Les auteurs n’ont pas déclaré de conflit d’intérêts en rapport avec cet article.
1. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Am J Med. 2002;113 Suppl 1A:5S-13S.
2. Wawrysiuk S, Naber K, Rechberger T, Miotla P. Prevention and treatment of uncomplicated lower urinary tract infections in the era of increasing antimicrobial resistance-non-antibiotic approaches: a systemic review. Arch Gynecol Obstet. 2019;300(4):821-8.
3. Bevölkerungsumfrage zu Antibiotikaresistenzen 2020. Schlussbericht im Auftrag des Bundesamts für Gesundheit BAG: Demo SCOPE AG; [updated 30.9.2020. Available from: https://www.newsd.admin.ch/newsd/message/attachments/63835.pdf.
4. Ahmed H, Davies F, Francis N, Farewell D, Butler C, Paranjothy S. Long-term antibiotics for prevention of recurrent urinary tract infection in older adults: systematic review and meta-analysis of randomised trials. BMJ Open. 2017;7(5):e015233.
5. Zeng G, Zhu W, Lam W, Bayramgil A. Treatment of urinary tract infections in the old and fragile. World J Urol. 2020;38(11):2709-20.
6. Price JR, Guran LA, Gregory WT, McDonagh MS. Nitrofurantoin vs other prophylactic agents in reducing recurrent urinary tract infections in adult women: a systematic review and meta-analysis. Am J Obstet Gynecol. 2016;215(5):548-60.
7. S3-Leitlinie Epidemiologie, Diagnostik, Therapie, Prävention und Management unkomplizierter, bakterieller, ambulant erworbener Harnwegsinfektionen bei Erwachsenen (HWI). AWMF Leitlinien-Register. 2024.
8. O’Neill J. Tackling Drug-Resistant Infections Globally: Final Report and Recommendations. London: Wellcome Trust & UK Government Review on Antimicrobial Resistance; 2016.
9. Antimicrobial Resistance C. Global burden of bacterial antimicrobial resistance in 2019:a systematic analysis. Lancet. 2022.
10. FDA. Novel Drug Approvals for 2025 2025 [Available from: xhttps://www.fda.gov/drugs/novel-drug-approvals-fda/novel-drug-approvals-2025.
11. Linhares I, Raposo T, Rodrigues A, Almeida A. Incidence and diversity of antimicrobial multidrug resistance profiles of uropathogenic bacteria. Biomed Res Int. 2015;2015:354084.
12. Strategie Antibiotikaresistenzen Bereich Mensch 2024 [Available from: https://www.bag.admin.ch/bag/de/home/strategie-und-politik/nationale-gesundheitsstrategien/strategie-antibiotikaresistenzen-schweiz.html.
13. Frey N, Bircher A, Bodmer M, Jick SS, Meier CR, Spoendlin J. Antibiotic Drug Use and the Risk of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: A Population-Based Case-Control Study. J Invest Dermatol. 2018;138(5):1207-9.
14. Szajewska H, Scott KP, de Meij T, Forslund-Startceva SK, Knight R, Koren O, et al. Antibiotic-perturbed microbiota and the role of probiotics. Nature Reviews Gastroenterology & Hepatology. 2025;22(3):155-72.
15. Wolfe AJ, Brubaker L. “Sterile Urine” and the Presence of Bacteria. European Urology. 2015;68(2):173-4.
16. Fouts DE, Pieper R, Szpakowski S, Pohl H, Knoblach S, Suh MJ, et al. Integrated next-generation sequencing of 16S rDNA and metaproteomics differentiate the healthy urine microbiome from asymptomatic bacteriuria in neuropathic bladder associated with spinal cord injury. J Transl Med. 2012;10:174.
17. Rudick CN, Taylor AK, Yaggie RE, Schaeffer AJ, Klumpp DJ. Asymptomatic bacteriuria Escherichia coli are live biotherapeutics for UTI. PLoS One. 2014;9(11):e109321.
18. Foxman B, Brown P. Epidemiology of urinary tract infections: transmission and risk factors, incidence, and costs. Infect Dis Clin North Am. 2003;17(2):227-41.
19. Hooton TM, Stapleton AE, Roberts PL, Winter C, Scholes D, Bavendam T, et al. Perineal anatomy and urine-voiding characteristics of young women with and without recurrent urinary tract infections. Clin Infect Dis. 1999;29(6):1600-1.
20. Cai T. Recurrent uncomplicated urinary tract infections: definitions and risk factors. GMS Infect Dis. 2021;9:Doc03.
21. Jung C, Brubaker L. The etiology and management of recurrent urinary tract infections in postmenopausal women. Climacteric. 2019;22(3):242-9.
22. Park MG, Cho S, Oh MM. Menopausal Changes in the Microbiome-A Review Focused on the Genitourinary Microbiome. Diagnostics (Basel). 2023;13(6).
23. Vaughan MH, Mao J, Karstens LA, Ma L, Amundsen CL, Schmader KE, et al. The Urinary Microbiome in Postmenopausal Women with Recurrent Urinary Tract Infections. J Urol. 2021;206(5):1222-31.
24. Betschart C, Albrich WC, Brandner S, Faltin D, Kuhn A, Surbek D, et al. Guideline of the Swiss Society of Gynaecology and Obstetrics (SSGO) on acute and recurrent urinary tract infections in women, including pregnancy. Swiss Med Wkly. 2020;150:w20236.
25. Hoffmann T, Peiris R, Mar CD, Cleo G, Glasziou P. Natural history of uncomplicated urinary tract infection without antibiotics: a systematic review. Br J Gen Pract. 2020;70(699):e714-e22.
26. Sachdeva A, Rai BP, Veeratterapillay R, Harding C, Nambiar A. Non-steroidal anti-inflammatory drugs for treating symptomatic uncomplicated urinary tract infections in non-pregnant adult women. Cochrane Database Syst Rev. 2024;12(12):Cd014762.
27. Christiaens TC, De Meyere M, Verschraegen G, Peersman W, Heytens S, De Maeseneer JM. Randomised controlled trial of nitrofurantoin versus placebo in the treatment of uncomplicated urinary tract infection in adult women. Br J Gen Pract. 2002;52(482):729-34.
28. Wagenlehner FM, Abramov-Sommariva D, Höller M, Steindl H, Naber KG. Non-Antibiotic Herbal Therapy (BNO 1045) versus Antibiotic Therapy (Fosfomycin Trometamol) for the Treatment of Acute Lower Uncomplicated Urinary Tract Infections in Women: A Double-Blind, Parallel-Group, Randomized, Multicentre, Non-Inferiority Phase III Trial. Urol Int. 2018;101(3):327-36.
29. Raz R, Stamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med. 1993;329(11):753-6.
30. Tan-Kim J, Shah NM, Do D, Menefee SA. Efficacy of vaginal estrogen for recurrent urinary tract infection prevention in hypoestrogenic women. Am J Obstet Gynecol. 2023;229(2):143 e1- e9.
31. Sabadash M, Shulyak A. Canephron® N in the treatment of recurrent cystitis in women of child-bearing Age: a randomised controlled study. Clinical Phytoscience. 2017;3(1):9.
32. Huttner A, Kronenberg A, Hasse B, Galperine TK. Harnwegsinfekt (HWI). 2025.