Die chronische Nierenkrankheit (CKD) betrifft etwa 10 % der Erwachsenen und ist durch eine dauerhafte Schädigung der Nierenfunktion oder -struktur gekennzeichnet. Aufgrund der häufig asymptomatischen Frühstadien erfolgt die Diagnose oft spät, was das Risiko für schwerwiegende Komplikationen wie Herz-Kreislauf-Erkrankungen oder das Erreichen der Nierenersatzpflichtigkeit erhöht. Für Hausärzt/-innen sind Früherkennung, adäquate Diagnostik und Therapie zentral, um die Progression zu verlangsamen und Folgeerkrankungen zu minimieren. Wichtige Massnahmen umfassen das Screening bei Risikopatient/-innen, regelmässiges Monitoring, die Anpassung der Medikation und nichtmedikamentöse Interventionen wie Lebensstiländerungen. Die enge Kooperation mit Nephrolog/-innen unterstützt eine umfassende Versorgung und verhindert Folgeschäden.
Chronic kidney disease (CKD) affects approximately 10 % of the adult population and is characterized by persistent impairment of kidney function or structure. Due to the often asymptomatic early stages, diagnosis is frequently made late, which increases the risk of serious complications such as cardiovascular disease or the need for renal replacement therapy. For general practitioners, early detection, adequate diagnostics, and treatment are central to slow progression and minimize secondary diseases. Important measures include screening of at-risk patients, regular monitoring, adjustment of medication, and non-pharmacological interventions such as lifestyle changes. Close cooperation with nephrologists supports comprehensive care and helps prevent further complications.
Keywords: Chronische Nierenkrankheit, CKD, Screening, Hausarzt, Therapie, Progression, SGLT2-Inhibitoren
Einführung
Die chronische Nierenkrankheit (CKD) betrifft etwa 10 % der erwachsenen Bevölkerung und stellt somit eine bedeutende gesundheitliche Herausforderung dar. Die Erkrankung ist besonders in den frühen Stadien häufig asymptomatisch und wird daher oft zu spät diagnostiziert. Im fortgeschrittenen Stadium ist sie mit schwerwiegenden gesundheitlichen Komplikationen verbunden, darunter Herz-Kreislauf-Erkrankungen und Nierenfunktionsverlust. Die Bedeutung der CKD wurde lange Zeit unterschätzt. Sie zählt zu den am schnellsten wachsenden Todesursachen weltweit und könnte bis 2050 zur fünfthäufigsten Todesursache werden. In einer am 23.05.2025 verabschiedeten Resolution (EB156/CONF./6) erkennt die WHO die CKD als eine zunehmende globale Gesundheitsbedrohung an, von der etwa 674 Millionen Menschen betroffen sind. Die vorgeschlagene Resolution fordert dazu auf, die Nierengesundheit systematisch in nationale Gesundheitssysteme zu integrieren. Zentrale Massnahmen sind dabei die Stärkung des öffentlichen Bewusstseins, der Ausbau von Überwachungssystemen zur frühzeitigen Erkennung der CKD, die Förderung der Gesundheitskompetenz sowie der Zugang zu einer qualitativ hochwertigen Versorgung. Ziel ist es, die Nierengesundheit weltweit als gesundheitspolitische Priorität zu verankern und bestehende Versorgungslücken zu schliessen. Hausärzt/-innen nehmen neben Nephrolog/-innen in der Umsetzung dieser Massnahmen eine zentrale Rolle ein.
Dieser Artikel vermittelt eine fundierte Übersicht zur CKD und soll Hausärztinnen und Hausärzten eine praxisnahe Unterstützung bei Screening, Diagnostik und therapeutischem Management bieten.
1. Was ist CKD und wie ist diese definiert?
Die CKD ist eine typischerweise fortschreitende Erkrankung der Nieren, die mit einer dauerhaften Beeinträchtigung der Nierenfunktion oder Nierenstruktur einhergeht und negative Auswirkungen auf die Gesundheit hat. Eines oder mehrere der unten genannten Kriterien müssen für mehr als 3 Monate vorliegen, damit die Diagnose gestellt werden kann.
• glomeruläre Filtrationsrate (eGFR) < 60 ml/min/1,73 m²
• Albuminurie > 30 mg/Tag
• abnormales Urinsediment
• Strukturelle Nierenanomalien in bildgebenden Verfahren oder in der Histologie (z.B. polyzystische Nieren oder dünne Basalmembran)
• Zustand nach Nierentransplantation
• Elektrolytstörungen renaler Genese oder renal tubuläre Azidose
2. Was sind die häufigsten Ursachen einer CKD?
• Diabetes mellitus: 30–35 %
• Arterielle Hypertonie: 30–35 %
• Glomerulonephritiden: 15 %
• Polyzystische Nierenkrankheit: ca. 8 %
3. Warum ist eine frühe Diagnose wichtig?
Eine Früherkennung ermöglicht eine Anpassung des Krankheitsmanagements und eine Prävention von schwerwiegenden Konsequenzen:
1. Vermeidung einer (schnellen) Progression: Eine unentdeckte CKD kann zu einem fortschreitenden Nierenversagen führen, was eine Nierenersatztherapie (Dialyse oder Transplantation) erforderlich machen kann.
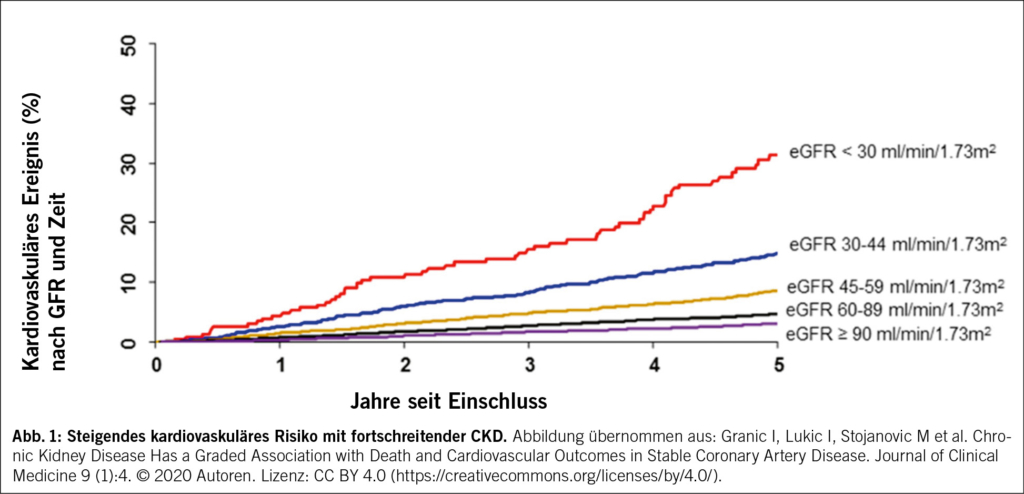
2. Gesteigertes kardiovaskuläres Risiko: Patient/-innen mit einer CKD weisen ein deutlich erhöhtes Risiko für praktisch alle kardiovaskulären Erkrankungen auf (Abb. 1). Dieses Risiko nimmt proportional zur Abnahme der GFR zu und übersteigt in der Mehrzahl der Fälle das Risiko eines terminalen Nierenversagens. Deswegen gelten tiefere Lipidzielwerte als für gleichaltrige Patient/-innen ohne CKD (https://agla.ch/). Unabhängig davon wird, gemäss den KDIGO-Guidelines, bei allen Patient/-innen mit CKD und einem Alter ≥ 50 Jahren der Einsatz eines hochpotenten Statins empfohlen.
3. Komplikationen der CKD: Hierzu gehören Anämie, Azidose, sekundärer Hyperparathyreoidismus, Hyperkaliämie und Störungen des Mineral- und Knochenstoffwechsels (CKD-MBD). Diese nehmen mit abnehmender GFR zu und müssen erkannt und ggf. therapiert werden.
4. Medikamentenanpassungen: Der Einsatz nephrotoxischer Substanzen muss strikt vermieden werden. Die Dosierung vieler Medikamente muss an die Nierenfunktion angepasst werden, wenn die eGFR < 60 ml/min abfällt (www.dosing.de). Dies gilt auch für ältere Patienten mit einer GFR < 60 ml/min, bei denen die Einschränkung der GFR als altersbedingt eingeschätzt wird.
4. Warum ist das Thema für mich in der Grundversorgung wichtig?
Die CKD betrifft mehr als 10 % der erwachsenen Bevölkerung und ist damit häufiger als Diabetes mellitus oder Herzinsuffizienz. In den frühen Stadien sind keine oder nur unspezifische Symptome vorhanden. Die hausärztliche Grundversorgung spielt eine elementare Rolle in der frühen Identifikation dieser Patient/-innen. Hier wird entschieden, ob eine Überweisung zur Nephrologie nötig ist. Zugleich ist die hausärztliche Betreuung entscheidend für das Management und die Therapie der CKD, besonders in frühen Stadien.
5. Wen sollte ich auf eine CKD screenen und wie oft?
Bei Vorliegen von folgenden Risikofaktoren wird ein Screening empfohlen:
• Diabetes mellitus
• arterielle Hypertonie
• andere kardiovaskuläre Erkrankungen (z.B. Herzinsuffizienz)
• familiäre Vorgeschichte von Nierenkrankheiten (z.B. polyzystische Nierenerkrankung)
• nephrotoxische Medikamente (Lithium, NSAR, bestimmte HIV-Medikamente)
• prädisponierende Systemerkrankung (z.B. HIV, Vaskulitis, Lupus)
Bei Diabetes mellitus Typ 2 sollte das Screening jährlich erfolgen, beginnend mit der Diagnosestellung. Bei Typ-1- Diabetes mellitus wird empfohlen, das Screening erstmals 5 Jahre nach Diagnosestellung und anschliessend jährlich durchzuführen. Bei allen anderen Indikationen gibt es keine klare Evidenz für die Screeningfrequenz, sodass sie individuell festgelegt werden sollte.
6. Wie sollte ich auf CKD screenen?
• Schätzung der GFR mittels CKD-EPI Formel anhand der Bestimmung des Serum-/Plasmakreatinins oder in ausgewählten Fällen durch Cystatin C.
• Albuminurie: anhand der Albumin-Kreatinin-Ratio (ACR) im Spontanurin
• Wenn eGFR oder ACR pathologisch sind:
– Urinstreifentest: zur Detektion von Blut im Urin
– Ultraschall der Nieren: Dieser hilft, strukturelle Ursachen der CKD wie etwa eine Obstruktion (Hydronephrose) oder Zysten zu erkennen.
7. Was versteht man unter CKD-Progression?
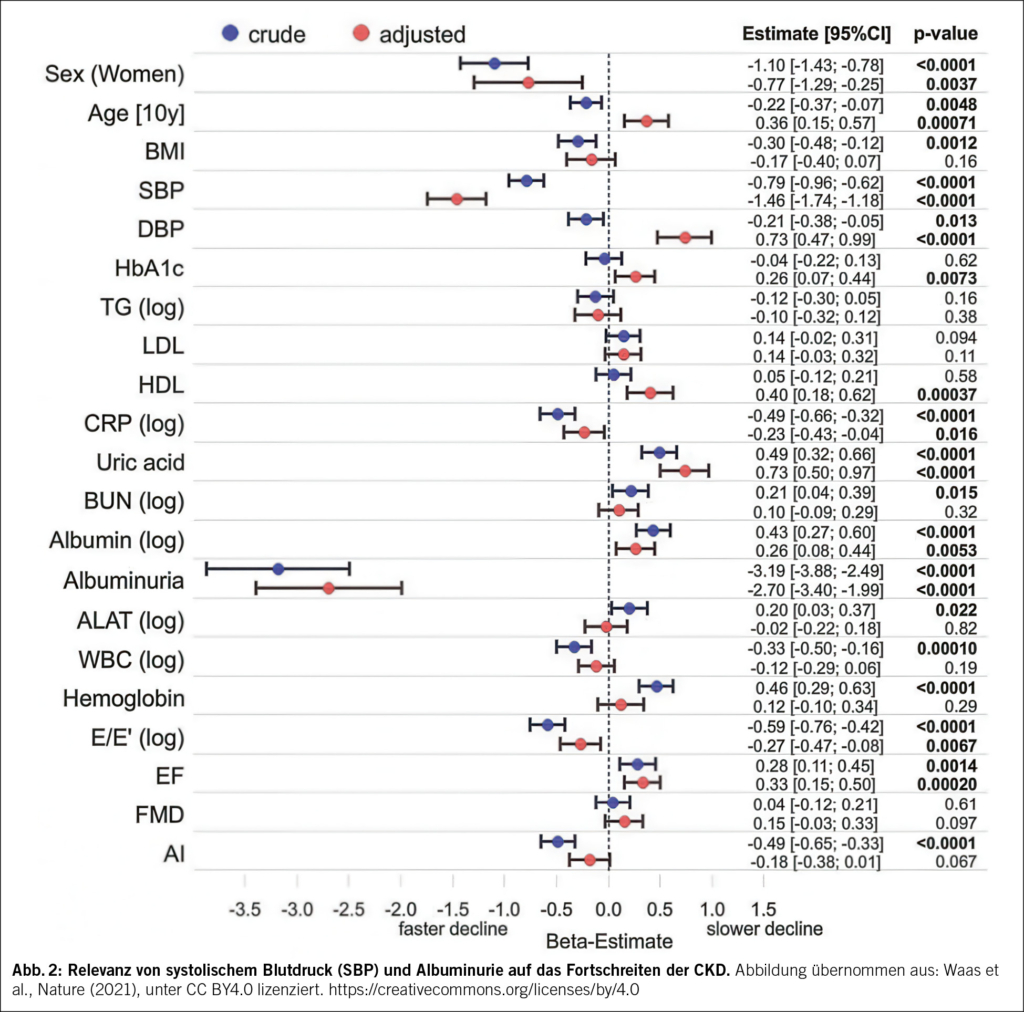
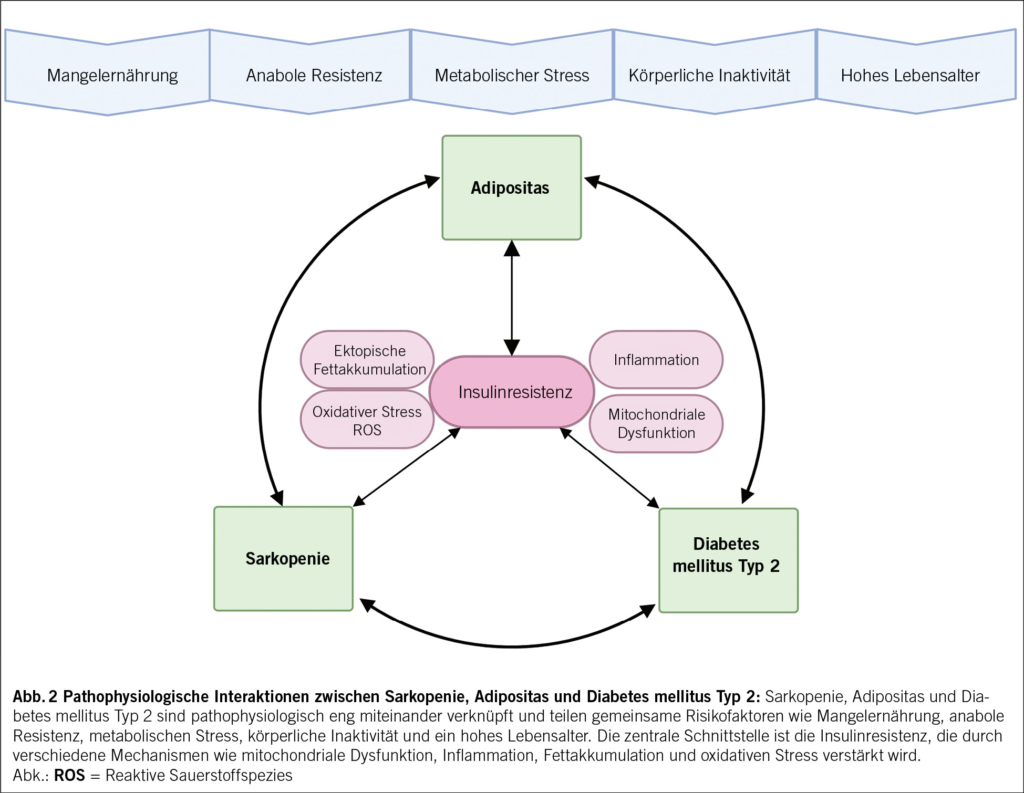
Die CKD führt typischerweise zu einem fortschreitenden Verlust der glomerulären Filtrationsrate (GFR). Dabei ist zwischen dem altersbedingten natürlichen GFR-Abfall (ca. 0,2–1 ml/min/Jahr ab dem 30. Lebensjahr) und der krankheitsbedingten Progression zu unterscheiden. Die GFR muss stets im Alterskontext bewertet werden: Ein eGFR-Wert < 60 ml/min ist nicht automatisch pathologisch, wie möglicherweise bei einer 81-jährigen Frau mit eGFR von 55 ml/min ohne Albuminurie. Dagegen ist eine GFR von 62 ml/min bei einem 32-jährigen Mann pathologisch. Bei einer CKD beschleunigt sich der GFR-Verlust über das natürliche Mass, beeinflusst durch Grunderkrankung, Blutdruck und Albuminurie. Je höher der Blutdruck und je höher die Albuminurie, desto schneller ist das Fortschreiten der CKD, also die GFR-Abnahme (Abb. 2). Die Therapie zielt darauf ab, die Progression auf die physiologische Rate zu verlangsamen, denn je höher die eGFR, desto geringer die Wahrscheinlichkeit für Komplikationen.
8. Was mache ich, wenn ich die Diagnose CKD gestellt habe?
Nach Diagnosestellung gilt es zu prüfen, ob die zugrundeliegende Erkrankung (z. B. Diabetes, Hypertonie) tatsächlich die Hauptursache der CKD ist oder ob eine andere Ursache vorliegt. Bei Bedarf sind weitere Untersuchungen zur Abklärung einer alternativen Ätiologie erforderlich. Dazu gehören ein Urinstreifentest, bei Hämaturie eine mikroskopische Sedimentanalyse sowie eine Nierensonografie zur Abklärung postrenaler oder struktureller Ursachen. Anschliessend sollte eine Risikobewertung erfolgen (siehe Punkt 9).
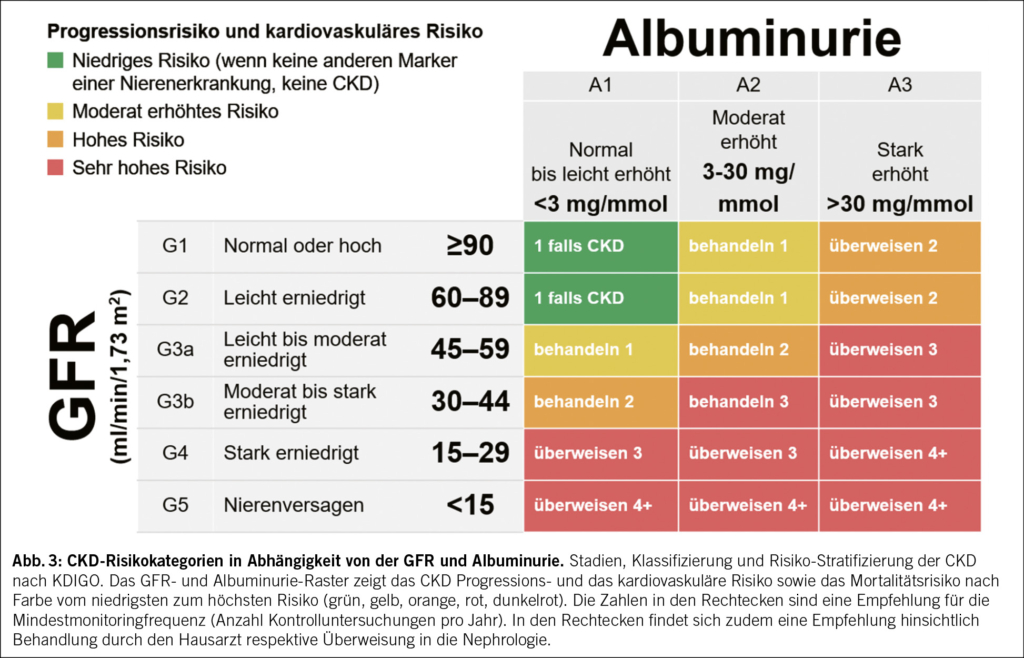
9. Wie kann ich das CKD-Progressionsrisiko und das kardiovaskuläre Risiko bei meinen CKD-Patient/-innen abschätzen?
Die KDIGO-Heatmap beschreibt das Progressions- und kardiovaskuläre Risiko von Patient/-innen anhand eGFR und Albuminurie (Abb. 3).
10. Wann sollte eine nephrologische Mitbeurteilung erfolgen?
• Albuminurie > 30 mg/mmol (300mg/d)
• rasche Verschlechterung der GFR
• eGFR < 30 ml/min/1,73 m²
• glomeruläre Mikrohämaturie
• hereditäre Nierenkrankheit
• CKD und therapieresistente arterielle Hypertonie
• anhaltende Hypo- oder Hyperkaliämie unklarer Ätiologie
• rezidivierende oder ausgedehnte Nephrolithiasis
11. Welche Therapieziele und welche nichtmedikamentösen Massnahmen gibt es bei der Behandlung der CKD?
Primär sollte die Konzentration auf die Verlangsamung der CKD-Progression und die Reduktion des kardiovaskulären Risikos gelegt werden. In Zusammenarbeit mit den nephrologischen Kolleg/-innen liegt der hausärztliche Fokus auch auf dem Management der verschiedenen CKD-Komplikationen, wie der Anämie, metabolischen Azidose, Hyperkaliämie, und Störungen des Mineral- und Knochenstoffwechsels (CKD-MBD). Zuerst sollten folgende nichtmedikamentöse Massnahmen empfohlen werden:
• Ausreichende Bewegung: mindestens 150 Minuten pro Woche oder so viel wie der Patient toleriert
• Ausgewogene Ernährung
• Moderater Kochsalzkonsum (NaCl < 5g/d)
• Rauchstopp: Das Rauchen beschleunigt die CKD-Progression und erhöht das kardiovaskuläre Risiko
• Gewichtsmanagement (Übergewicht führt zur Hyperfiltration und beschleunigten CKD-Progression)
12. Welche medikamentösen Therapieoptionen gibt es bei der CKD?
• Blutdruckeinstellung: Individualisierte Zielwerte gemäss ESC-Guidelines, meist <130/80 mmHg. Bei älteren Patient/-innen mit Frailty oder diabetischer autonomer Neuropathie sollte der Blutdruck im Stehen gemessen werden, um eine orthostatische Hypotonie zu erkennen. Liegt eine solche vor, erfolgt die Blutdruckeinstellung anhand der Messung im Stehen.
• RAS-Inhibitoren (RASi): ACE-Hemmer oder AT1-Blocker sind erste Wahl zur Blutdruckkontrolle und Reduktion der Albuminurie bei CKD mit arterieller Hypertonie, besonders bei pathologischer Albuminurie (ACR > 3 mg/mmol).
• SGLT2-Inhibitoren: empfohlen bei CKD zur Verzögerung der Progression und Senkung kardiovaskulärer Risiken. Sie ergänzen RASi und sind initiierbar, solange die eGFR > 20 ml/min beträgt. Sie können bis zur Dialyse/Transplantation belassen werden.
Indikationen:
– CKD mit Typ-2-Diabetes mellitus und/oder
Herzinsuffizienz
– CKD mit eGFR 20–45 ml/min
– CKD mit eGFR > 45 ml/min und
Albuminurie ≥ 20 mg/mmol
– Canagliflozin ist nur für Typ-2-Diabetes evidenzbasiert, Empagliflozin und Dapagliflozin auch bei nichtdiabetischer CKD
• Weitere Medikamente bei Diabetes mellitus, welche das CKD-Progressionsrisiko und das kardiovaskuläre Risiko verringern und die Albuminurie reduzieren:
– Finerenon kann bei erhöhter Albuminurie zusätzlich zu RASi und SGLT2i bei Typ 2 DM eingesetzt werden.
– Der GLP-1-Rezeptor-Agonist Semaglutid ist vorteilhaft bei Typ-2-Diabetes mit CKD und senkt ausserdem die Mortalität sowie das ardiovaskuläre Risiko.
13. Was ist das Therapieziel bei pathologischer Albuminurie?
Das Ziel der Therapie ist die maximal mögliche Reduktion der Albuminurie, wenn machbar in den Normbereich (< 3mg/mmol Kreatinin). Eine signifikante Reduktion der Albuminurie korreliert mit einer besseren kardiovaskulären Prognose und einer verlangsamten Progression der CKD.
14. Kann es unter Therapie zu einer Abnahme der eGFR kommen?
Unter Therapie mit RAS- oder SGLT2-Inhibitoren kommt es typischerweise zu einer moderaten eGFR-Abnahme, was erwünscht ist, da die Reduktion der Hyperfiltration die CKD-Progression verlangsamt. Nach Beginn von SGLT2-Inhibitoren muss routinemässig keine eGFR-Kontrolle erfolgen. Nach Beginn eines RAS-Inhibitors sollte bei CKD-Patient/-innen mit eingeschränkter eGFR hingegen eine eGFR-Kontrolle nach 7–14 Tagen durchgeführt werden. Ein Rückgang der eGFR um bis zu 25 % bzw. ein Kreatininanstieg bis 30 % gilt als unproblematisch, erfordert aber eine sorgfältige Kontrolle. Ein Funktionsverlust > 30 % sollte eine nephrologische Abklärung veranlassen.
15. Weitere Aspekte der Behandlung und Therapie der CKD-Komplikationen
• Patient/-innen unter RAS-Blockern und/oder SGLT2-Inhibitoren sollten über die «Sick-day rules» (siehe Kasten) informiert werden, da diese Medikamente bei Volumenverlust, Dehydration oder akuten Erkrankungen schädlich sein können. Besonders bei Diabetiker/-innen besteht während Fastenphasen (z. B. vor Operationen) das Risiko einer (euglykämischen) Ketoazidose.
• Kaliumwerte sollten vor sowie 7–10 Tage nach Beginn oder Dosiserhöhung von RASi, sMRA, nsMRA oder Bactrim kontrolliert werden. Bei Hyperkaliämie empfiehlt sich eine Ernährungsberatung; chronische Hyperkaliämie kann den Einsatz von Kaliumbindern erfordern, um die Fortsetzung der nephroprotektiven Therapie (z.B. RASi oder Finerenon) zu ermöglichen.
Die Behandlung von CKD-Komplikationen im hausärztlichen Bereich konzentriert sich auf Volumen- und Blutdruckeinstellung sowie eine ausreichende Versorgung mit Substraten und Vitamin D.
Zielwerte bei CKD sind:
• 25-OH-Vitamin-D-Spiegel > 75 nmol/l (> 30 ng/ml)
• Ferritin > 300 ng/ml, Transferrinsättigung > 30%
• Normwerte für Vitamin B12 und Folsäure gemäss Labor
Folgende CKD-Komplikationen bedürfen einer nephrologischen Mitbeurteilung:
• Persistierende Anämie von <10 g/dl trotz suffizienten Substraten
• Progrediente metabolische Azidose mit einem Serumbikarbonat <18 mmol/l
• Unkontrollierte Hyperkaliämie
• Progrediente Hypokalziämie oder Hyperparathyreoidismus trotz suffizientem 25-OH-Vitamin-D- Spiegel.
16. Was ist bei Diabetiker/-innen mit CKD zu beachten?
Bei Diabetiker/-innen mit fortgeschrittener CKD besteht ein erhöhtes Hypoglykämierisiko. Hypoglykämien sind mit einer deutlich erhöhten akuten Morbidität und Mortalität vergesellschaftet. Unter Behandlung mit Medikamenten, welche keine Hypoglykämie auslösen (Metformin, SGLT2i, DPP-IV-Inhibitoren, GLP1-RA) sollte ein möglichst niedriger HbA1c-Wert angestrebt werden. Werden hypoglykämieauslösende Medikamente eingesetzt (Insulin), empfiehlt sich ein konservativeres HbA1c-Ziel (z. B. < 8 %). Das individuelle HbA1c-Ziel sollte unter Berücksichtigung von Risikofaktoren wie Alter, Frailty und Lebenserwartung angepasst werden. Sulfonylharnstoffe sollten aufgrund der Hypoglykämiegefahr bei CKD mit eingeschränkter Nierenfunktion nicht eingesetzt werden.
17. Was ist bei der Schmerztherapie von CKD-Patient/-innen zu beachten?
Paracetamol und Metamizol sind bevorzugte Schmerzmittel bei CKD, jeweils mit einer Maximaldosis von 3 × 1 g/Tag; eine Kombination ist möglich. NSAR müssen wegen nephrotoxischer Effekte vermieden werden. Opioide können sich anreichern, toxische Metabolite bilden und müssen an die Nierenfunktion angepasst werden. Buprenorphin und Fentanyl werden extrarenal eliminiert und benötigen keine Dosisanpassung. Hydromorphon (Palladon) kann verwendet werden, birgt aber das Risiko der Akkumulation. Bei Gichtarthritis sind Glukokortikoide intraartikulär oder systemisch möglich.
18. Umgang mit jodhaltigen Kontrastmitteln bei CKD
Nur parenterale jodhaltige Röntgenkontrastmittel sind bei CKD potenziell problematisch, wobei das Risiko einer Kontrastmittel-induzierten Nierenschädigung, besonders bei intravenöser Gabe, deutlich geringer ist als früher angenommen. Intraarterielle Applikation scheint nephrotoxischer zu sein als intravenöse. Enterale jodhaltige Kontrastmittel belasten die Nieren nicht. Bei klarer Indikation und fehlenden Alternativen sollten CKD-Patient/-innen jodhaltige Kontrastmittel nicht vorenthalten werden. Wichtig ist, dass sie euvoläm sind; bei prärenalem oder hypervolämen Zustand sollte auf die Gabe möglichst verzichtet werden oder die Untersuchung verschoben werden, wenn medizinisch verantwortbar. Makrozyklische gadoliniumhaltige MR-Kontrastmittel (z.B. Dotarem, Gadovist) sind unbedenklich.
19. Wie monitorisiere ich meine CKD-Patient/-innen?
Das Monitoring ist wichtig, um eine rasche Verschlechterung der Nierenfunktion nicht zu verpassen und die Wirksamkeit der eingeleiteten Massnahmen zu überprüfen. Die Kontrollhäufigkeit richtet sich nach CKD-Stadium und Krankheitsprogression (Abb. 3/KDIGO Heatmap).
Wesentliche Monitoring-Parameter sind:
• Messung des arteriellen Blutdrucks
• eGFR
• ACR
• Kalium
Bei Medikamentenänderungen sind gegebenenfalls zusätzliche Laborkontrollen nötig. Nach Beginn oder Dosiserhöhung von RAS-Blockern oder Mineralokortikoidrezeptorantagonisten sollte das Kalium kontrolliert werden. Bei Beginn eines SGLT2-Inhibitors ist nur bei Risiko für Hypovolämie (z. B. Herzinsuffizienz mit Schleifendiuretika) eine Nierenfunktionskontrolle erforderlich. Bei unerklärtem raschen GFR-Abfall oder stark steigendem Albuminurie-Wert sollte eine nephrologische Abklärung erfolgen.
20. Wo kann ich aktuelle Empfehlungen zur Diagnose und Therapie der CKD finden?
www.swissnephrology.ch
«KDIGO Executive Summary CKD 2024» (via Internetsuche eingeben)
Fazit
Die CKD ist eine häufige Krankheit mit erheblichem Potenzial für schwerwiegende Komplikationen. Früherkennung und gezieltes Management sind entscheidend. Dies beinhaltet sowohl nichtmedikamentöse Massnahmen als auch eine sorgfältige medikamentöse Einstellung. Hausärzt/-innen spielen eine Schlüsselrolle in der Versorgung und sollten eng mit Nephrolog/-innen zusammenarbeiten, um die Progression der Erkrankung zu verlangsamen, das kardiovaskuläre Risiko zu senken, Komplikationen zu verhindern und damit die Lebensqualität der betroffenen Patient/-innen zu erhalten.
Copyright
Aerzteverlag medinfo AG
Institut für Nephrologie und Dialyse
Kantonsspital Baden
Im Ergel 1
5404 Baden
Institut für Nephrologie und Dialyse
Kantonsspital Baden
Im Ergel 1
5404 Baden
Harald Seeger: Vortrags-und Beratungstätigkeit für AstraZeneca, Bayer, Boehringer Ingelheim, CSL Vifor, Medice und Novo Nordisk.
Auf Anfrage bei den Autoren