La vaccination contre la grippe peut réduire de manière significative les événements cardiovasculaires tels que l’infarctus aigu du myocarde, l’accident vasculaire cérébral et la mortalité globale et cardiovasculaire. La prévention au moyen d’un vaccin quadrivalent inactivé à haute dose devrait être effectuée selon l’OMS chaque automne chez les personnes âgées de 65 ans et plus et souffrant d’une maladie chronique ou chez les seniors ≥75 ans. Malheureusement, le taux de vaccination contre la grippe chez les personnes atteintes de maladies chroniques est aujourd’hui encore beaucoup trop faible. Le conseil médical et la motivation sont déterminants à cet égard. L’objectif serait d’atteindre un taux de vaccination de cette population de ≥75%. La surmortalité en cas de grippe est essentiellement cardiovasculaire.
Influenza vaccination can significantly reduce cardiovascular events such as acute myocardial infarction, stroke, and all-cause and cardiovascular mortality. Prevention using an inactivated, quadrivalent HD vaccine should be performed in persons 65 years of age and older with chronic disease or in seniors ≥75 years of age each fall, according to WHO. Unfortunately, influenza vaccination coverage in chronic disease is still far too low today. Medical advice and motivation are critical in this regard. The goal would be a vaccination rate of this population ≥75%. Excess mortality from influ¬enza is primarily cardiovascular.
Key Words: Influenza, influenza vaccination, cardiovascular diseases in influenza, myocardial infarction
Cet article se base sur la littérature actuelle, trois excellentes présentations lors du congrès annuel de la DGK de cette année et les recommandations de vaccination contre la grippe 2023/24 de la CFV/OFSP.
Pour beaucoup de gens, la grippe n’ est qu’ un désagrément passager avec de la fièvre,du rhume, de la toux, des maux de tête et des douleurs musculaires. La durée de la grippe typique est de 5 à 7 jours de maladie aiguë, dont généralement 3-4 jours de repos au lit. Souvent, la toux et l’ asthénie post-grippale persistent. Le fait est que les coûts médicaux, économiques et sociaux de l’ influenza et de ses complications sont largement sous-estimés.
Comparée à d’ autres maladies infectieuses, l’ influenza représente une maladie infectieuse dont la charge de morbidité est la plus élevée. Ceci est illustré par l’impact de la grippe en termes d’ années de vie perdues en bonne santé. Celui-ci est nettement plus important en cas de grippe qu’ en cas d’ infection par la TBC, le VIH ou le pneumocoque, pour ne citer que quelques infections (1). Chez les groupes à risque, la maladie chronique sous-jacente est renforcée et le risque d’ évolution grave ou fatale de la maladie est nettement accru.
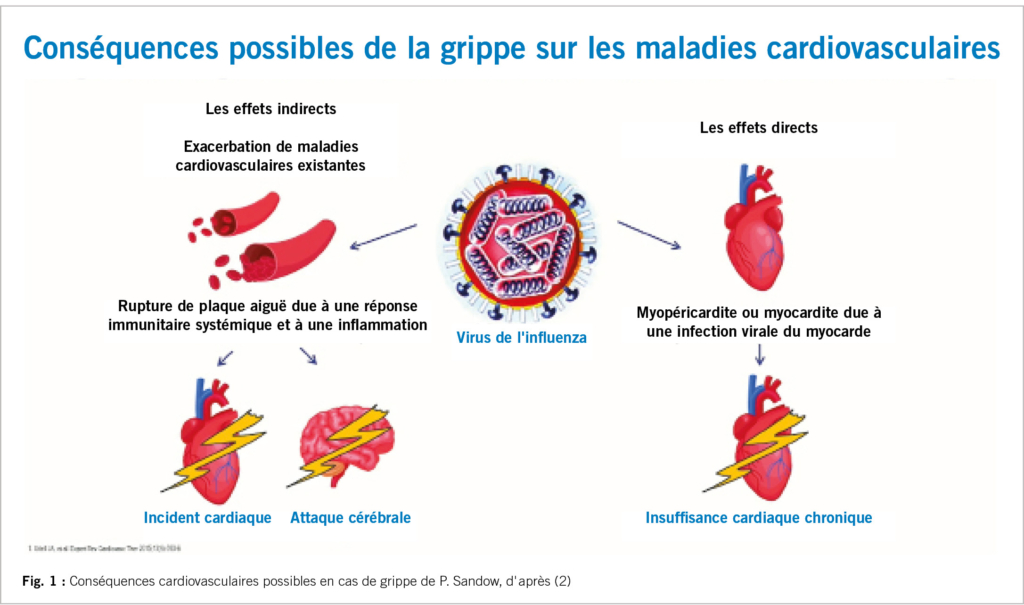
Une infection par le virus de la grippe entraîne, par la libération de cytokines, un état inflammatoire systémique. Cela peut entraîner une hypercoagulabilité, une activation des macrophages et à une éventuelle constellation septique comprenant un déséquilibre hémodynamique avec activation du système nerveux sympathique, une tachycardie et une vasoconstriction. Il peut y avoir aussi un dysfonctionnement endothélial et une rupture de plaque. La conséquence est un infarctus aigu du myocarde, un accident vasculaire cérébral, une péri/myocardite virale avec une possible insuffisance cardiaque et/ou une arythmie peuvent également se produire. Les complications respiratoires jouent un rôle important avec hypoxémie, hypotension et un besoin accru en O2 – cf. fig. 1 (2). En ce qui concerne les maladies secondaires il s’ agit de la pneumonie, de l’ exacerbation d’ une maladie chronique ou d’ une autre BPCO ou d’ un asthme, la décompensation d’ un diabète sucré ou d’ autres maladies métaboliques. En outre existe la possibilité d’ aggravation de maladies rénales, hépatiques, neurologiques, immunologiques, et les maladies cancereuses. Cela entraîne une augmentation de la mortalité cardio-vasculaire et une augmentation de la mortalité globale. Le risque d’ un infarctus aigu est jusqu’ à 10 fois plus élevé dans les 3 premiers jours d’ une grippe, et le risque d’ accident vasculaire cérébral est multiplié par 8. L’ hospitalisation pour infarctus du myocarde est multiplié par 6 dans les sept premiers jours de l’ infection. et le risque d’ hospitalisation est également nettement plus élevé chez les patients avec une maladie cardiaque chronique (2-6). Chez les adultes, le risque cardiovasculaire est 6 fois plus élevé pour un infarctus du myocarde en cas d’ infection respiratoire virale, en particulier de la grippe, pendant l’ épisode infectieuse, du premier au septième jour. D’ autres virus respiratoires présentent un risque plus faible (5).
Lors d’ une forte vague d’ influenza, on peut observer une nette augmentation de la mortalité. Ainsi, selon l’ institut Robert Koch (RKI), 22’ 900 de décès supplémentaires ont été enregistrés en Allemagne en 2016/17, et dans la saison 2017/2018, 25’ 100 de décès supplémentaires, dont 86% étaient âgés de ≥60 ans. 60’ 000 hospitalisations étaient liées à la grippe en 2017/18, 58% chez des personnes de ≥60 ans. Les maladies de base telles que les maladies respiratoires, cardio-vasculaires, le diabète et le cancer ont un risque nettement plus élevé de souffrir d’ une maladie respiratoire liée à la grippe (+65%) et d’ une maladie cardiovasculaire (+23%) (7).
Dix-huit pourcent de tous les décès dus à la grippe chez les patients >65 ans sont dus à des maladies cardiovasculaires. Pour les maladies chronique pulmonaires le risque de décès est 20x plus élevé. Les personnes infectées âgées ont le plus souvent souffert d’ une détérioration de leur état général de santé – chutes, fragilité, diminution de l’ autonomie, altération de l’ état mental et / ou l’ exacerbation de la maladie de base après 1 à 2 mois, que chez les personnes non infectées.
La vaccination
L’ efficacité préventive de la vaccination contre la grippe en ce qui concerne l’ infarctus aigu du myocarde est de 15-45% ; elle est nettement supérieure à celle de l’ administration d’ une statine (19-30%) ou d’ un traitement antihypertenseur (17-25%) et à peu près aussi efficace qu’ une abstinence systématique de nicotine (32-43%) (fig. 2) (3,6).
La vaccination contre la grippe est recommandée par toutes les lignes directrices. Les objectifs de la vaccination sont: la prévention de l’ infection grippale, la prévention de pneumonies secondaires (pneumocoques), la prévention d’ une inflammation systémique et d’ une réaction immunitaire entraînant les événements cardiovasculaires mentionnés, la prévention des hospitalisations et des décès en cas d’ insuffisance cardiaque.
Selon une grande méta-analyse de 2012, la vaccination a permis de réduire les risques: MACE de -54%, la mortalité totale de -40%, l’ infarctus du myocarde de -27% (8). Selon une étude de Cochrane Database en 2015, la mortalité cardiovasculaire a diminuée 55% grâce à la vaccination (9). Selon une nouvelle méta-analyse, le NNT pour la vaccination en cas de MACE est de 23, et de 36 en cas de décès cardio-vasculaire (10). Une méta-analyse très complète de 2022 portant sur 18 études (5x randomisée, 13x études d’ observation) montre chez 217’ 072 patients et patientes à haut risque atteints de maladies cardiovasculaires avec un âge moyen de 68 ans, une réduction significative de la mortalité totale de 29%, des événements cardiovasculaires de 17% et une réduction des critères d’ évaluation secondaires de la mortalité cardiovasculaire et de l’ infarctus du myocarde de respectivement 22 et 18%. Une réduction de l’ insuffisance cardiaque n’ a pu être constatée que de manière non significative. Aucun effet n’ est apparu sur le taux d’ attaque cérébrale (11). Dans une autre grande méta-analyse de 2020, les maladies cardiovasculaires ont pu être réduites de 45% grâce à la vaccination (12). En cas d’ accident vasculaire cérébral (AVC), la vaccination a un effet protecteur modéré peu après l’évènement (13).
Avec l’ âge, l’ efficacité du système immunitaire diminue (immunosénescence); de ce fait, les personnes âgées sont plus vulnérables et présentent des évolutions de maladie plus graves. Les vaccins standard (SD-I.) sont donc moins efficaces pour les personnes âgées. Le vaccin grippal quadrivalent inactivé à haute dose (HD-I.) avec une quantité d’ antigènes 4 fois plus élevée, présente une immunogénicité supérieure. Il est plus efficace et protège les personnes âgées sur la base des données actuelles, contre la grippe et ses complications. L’ efficacité absolue s’ élevait en 2021 selon le RKI à 47% chez les personnes ≥60 ans (7).
La Commission Fédérale Suisse pour les Vaccins et l’ OFSP recommandent la vaccination contre la grippe à dose standard (SD) et à dose élevée (HD) avec la prise en charge des coûts par l’ assurance obligatoire des soins (AOS) pour les groupes d’ âge et les groupes d’ indication respectifs. Pour la vaccination contre la grippe saisonnière 2023/24 un vaccin à haute dose et deux vaccins différents à dose standard sont actuellement disponibles et autorisés par l’ OFSP sous certaines conditions – voir les recommandations de vaccination contre la grippe OFSP 2023/2024. Il s’ agit de: HD-I: Efluelda® ; SD-I : Fluarix Tetra® et Vaxigrip Tetra®.
Le vaccin à haute dose, nettement plus cher, est autorisé par l’ OFSP chez les adultes de 65 ans et plus avec un autre facteur de risque, il est très bien toléré; les effets secondaires sont la rougeur locale au point d’ injection, les myalgies, les céphalées et une sensation de malaise. Rarement, une réaction allergique aiguë peut se produire.
L’ OFSP écrit au sujet du vaccin à haute dose contre la grippe:
„Une méta-analyse (14) portant sur 34 millions de participants sur une durée de période d’ utilisation >10 ans montre une plus grande efficacité des vaccins contre la grippe HD (60μg au lieu de la dose standard de 15 μg d’ antigène par souche vaccinale) contre les complications de la grippe chez les personnes âgées ; une observation qui a également été confirmée au Danemark. Celles-ci et d’ autres données pour les vaccins HD montrent une amélioration de 10 à 20 % de protection pour les personnes ≥65 ans, raison pour laquelle la Suisse a également autorisé le vaccin avec prise en charge des coûts pour toutes les personnes ≥75 ans ainsi que pour les personnes ≥65 ans présentant au moins un autre facteur de risque de grippe sévère en raison d’ une comorbidité selon les recommandations de vaccination contre la grippe.
Dans ces groupes d’ âge, a) le risque de contracter la grippe ou des complications et d’ être hospitalisé est plus élevé que chez les personnes plus jeunes en bonne santé, et b) le type de la réponse immunitaire à la vaccination est plus faible. Ce sont de bonnes raisons pour recommander un vaccin HD pour ces personnes pour les protéger contre la grippe“.
Le vaccin saisonnier doit être administré chaque année en automne.
La composition des antigènes (particules virales sous forme fragmentée) est déterminée chaque année par l’ OMS. Dans les années où la prédiction du vaccin était mauvaise avec une faible efficacité, la protection cardiovasculaire était significativement plus faible. Cela donne des indications claires sur l’efficacité du vaccin. L’ objectif reste que ≥75% des seniors et des enfants (à partir de 6 respectivement 36 mois) souffrant d’ une maladie chronique sous-jacente soient vaccinées. L’ OFSP et la STIKO (Commission permanente de vaccination auprès du RKI) recommandent également une vaccination chez toutes les femmes enceintes à partir du 2e trimestre (plus tôt en cas d’ indication), en post-partum et chez les personnes qui peuvent être considérées comme une source d’ infection potentielle des personnes à risque dans le même ménage ou pour celles-ci qui sont prises en charge par ces personnes. Une indication professionnelle existe chez le personnel médical, chez les personnes travaillant dans des établissements fréquentés par le public y compris les crèches et chez les personnes en contact avec des volailles et oiseaux sauvages – voir www.bag.admin.ch/grippeimpfen ; www.rki.de/grippeimpfen ; www.infovac.ch
Selon le trial IAMI, la vaccination contre la grippe devrait être effectuée dans les 72 heures du traitement hospitalier après un infarctus du myocarde ou en cas d’ une coronaropathie à haut risque, car elle entraîne une réduction significative de la mortalité totale, de l’ infarctus du myocarde ou de thrombose de stent ceci de 28% en 12 mois et de décès cardiovasculaire (15).
Actuellement, le taux de vaccination se situe selon la maladie de base (CHK ou HI) au maximum de 30-43% (3, 7). Chez nous aussi, de nombreux patients ne sont conscients de l’ importance de la vaccination saisonnière annuelle en automne. Souvent, on constate dans la population une méconnaissance de la vaccination ou une mauvaise appréciation des risques liés à une absence de vaccination. Il est donc nécessaire de mettre en place une bonne information et motivation des patients, des seniors et de leurs partenaires/familles par les médecins. Des campagnes de vaccination et, dans à l’ avenir, un soutien par un logiciel de cabinet médical électronique seront très utiles.
Copyright Aerzteverlag medinfo AG
Zelglistrasse 17
8127 Forch
L’ auteur n’ a pas déclaré de conflits d’ intérêts en rapport avec cet article.
1. Cassini et al.,«Impact of infetious diseases on population health ..» Eurosurveillance 2018; 23(16):17-00454
2. Udell JA et al.,«Does influenza vaccination influence cardiovascular complications?», Expert Rev Cardiovasc Ther 2015;13(6)593-596
3. MacIntyre CR et al.,«Influenza vaccine as a coronary intervention for prevention of myocardial infarction», Heart 2016;102:1953–1956
4. Corrales-Medina VF. et al.,«Role of acute infection in triggering acute coronary syndromes». Lancet Infect Dis 2010;10:83–92
5. Kwong JC. et al.,« Acute myocardial infarction after laboratory- confirmed influenza infection», N Engl J Med 2018;378:345–353
6. Yedlapati SH et al., «Vaccines and cardiovascular outcomes: lessons learned from influenza epidemics», EHJ 2023, 25, Suppl.A, A17-A24
7. Robert Koch Institut,«STIKO: Aktualisierung der Influenza-Impfempfehlung für Personen im Alter von ≥60 Jahren», Epid Bull 2021;1:3-25
8. Loomba RS et al.,«Influenza vaccination and cardiovascular morbidity and mortality». J Cardiovasc Pharmacol Ther 2012: 237-343
9. Clar Ch. et al.,«Influenza vaccines for preventing cardivascular disease», Cochrane Database Syst Rev 2015
10. Behrouzi B. et al.,«Association of influenza vaccination with cardiovascular risk, a meta-analysis», JAMA Netw Open. 2022;5(4): e228873 doi:10.1001/jamanetworkopen.2022.8873
11. Jaiswal V. et. al.,«Cardioprotective effects of influenza vaccination among patients with established cardiovascular disease or at high cardiovascular risk: a systemic review and meta-analysis», Eur J Prev Cardiol 2022 ;29 (14):1881-1892
12. Zangiabadian M. et al.,«Protective effect of influenza vaccination on cardiovascular diseases: a systematic review and meta-analysis», Sci Rep 2020;10(1):20656
13. Rodríguez-Martín, S. et al.,«Influenza Vaccination and Risk of Ischemic Stroke: A Population-Based Case-Control Study », Neurology 2022; DOI: 10.1212/WNL.0000000000201123
14. Lee JKH et al.,«Efficacy and effectiveness of high-dose influenza vaccine», Vaccine 2021; doi: 10.1016/j.vaccine.2020.09.004
15. Fröbert O et al.,«Influenza vaccination after myocardial infarction», Circulation 2021;144 (18):1476-1484