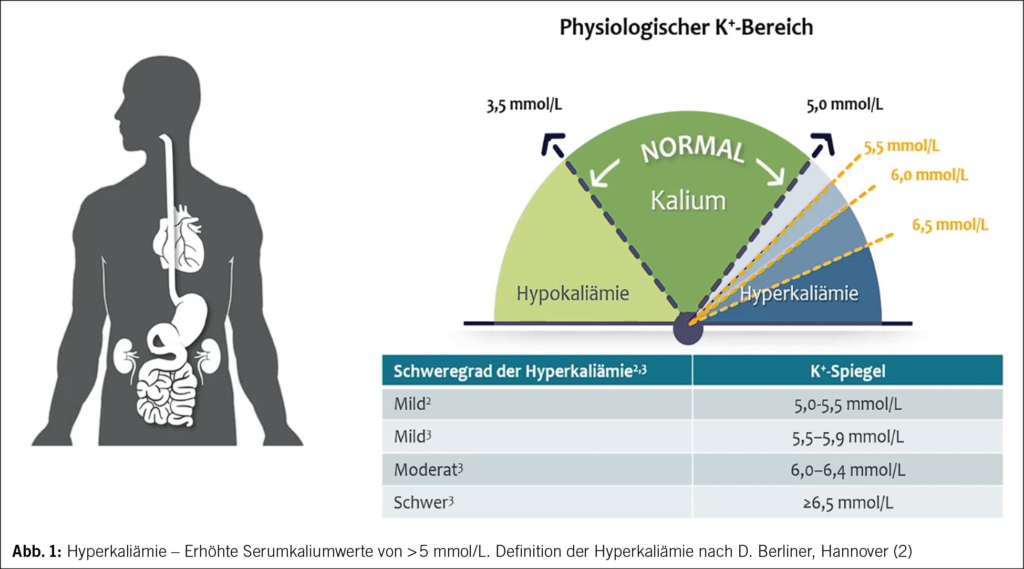
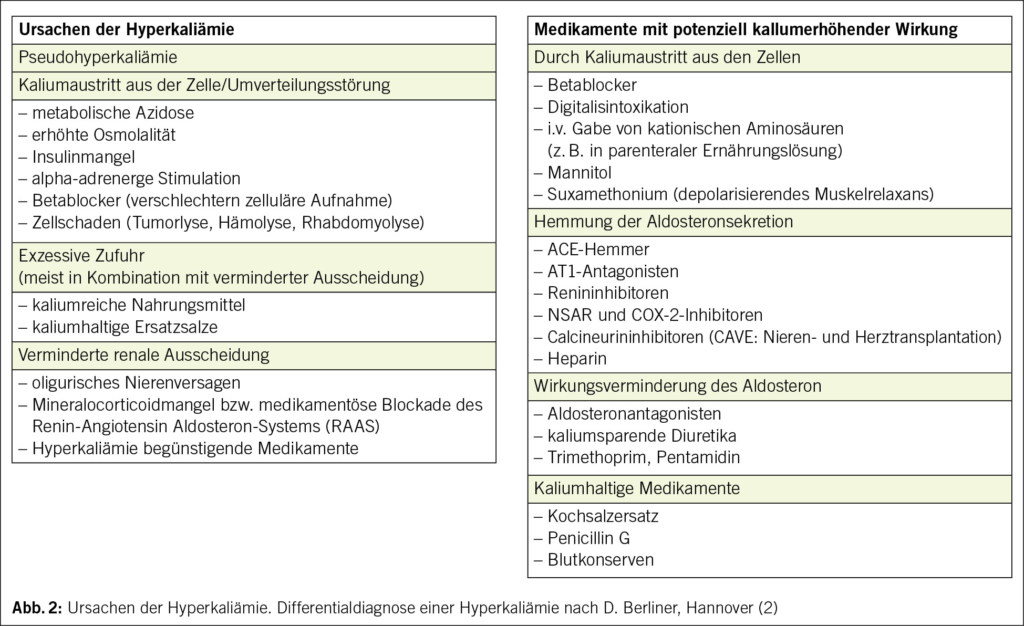
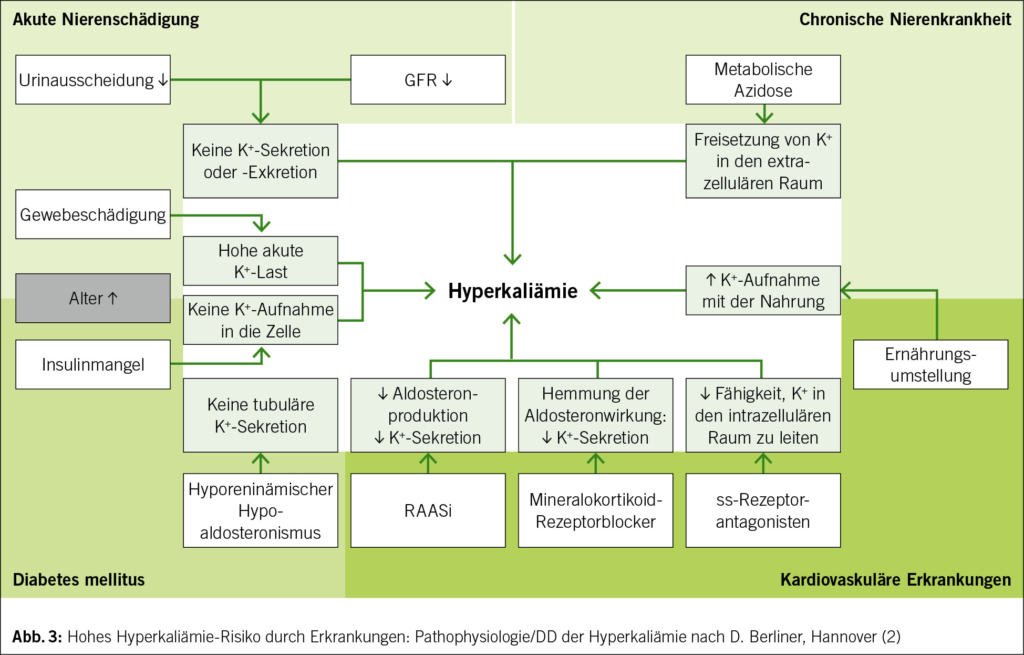
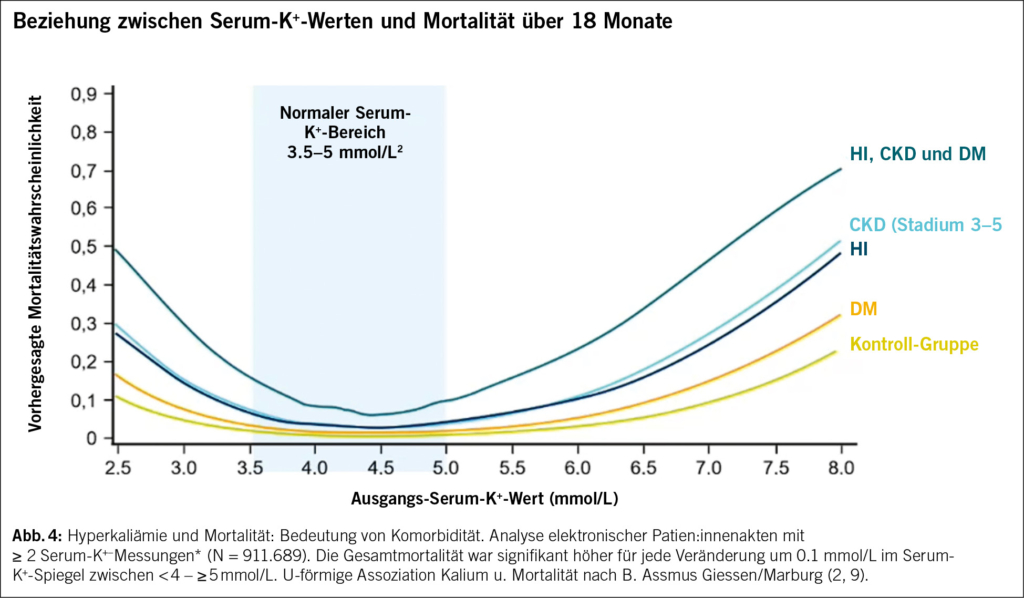
Krebs ist eine Erkrankung des Alters: Etwa 50 % der neuen Krebsfälle treten bei Menschen im Alter von 65 Jahren oder älter auf, und diese Zahl wird bis 2030 voraussichtlich auf 58 % ansteigen. Die Chemotherapie ist neben neuen Therapien wie der Immuntherapie und den zielgerichteten Therapien nach wie vor ein Standardbestandteil der Krebsbehandlung. Allerdings haben ältere Patienten im Vergleich zu jüngeren Erwachsenen ein erhöhtes Risiko für Chemotherapie-induzierte Toxizitäten. Verschiedene pharmakologische Parameter müssen bei der onkologischen Behandlung älterer Patienten berücksichtigt werden. Die Beurteilung altersbedingter Veränderungen durch eine geriatrische Untersuchung ist vor Beginn einer Chemotherapie sehr wichtig. Mehrere Studien haben gezeigt, dass mit Hilfe von geriatrischen Assessment-Variablen ältere Erwachsene identifiziert werden können, bei denen das Risiko einer schweren Toxizität durch die Chemotherapie am höchsten ist. Orale onkologische Therapien haben mehrere Vorteile. Sie haben jedoch auch Nachteile, insbesondere bei älteren Patienten, die zu einer geringeren Wirksamkeit oder einem früheren Therapieabbruch führen können. Trotz der physiologischen Phänomene der Immunoseneszenz und der Entzündungsreaktionen zeigen die Daten, die hauptsächlich aus Subgruppenanalysen von Metaanalysen stammen, dass die Immuntherapie auch bei älteren Patienten tendenziell wirksam und gut verträglich ist.
Cancer is a disease of old age with approximately 50% of new cancer cases occurring in humans aged 65 years and older and this number is expected to rise to 58% by 2030. Chemotherapy remains a standard part of cancer treatment, alongside new therapies such as immunotherapy and targeted therapies. However, older patients are at increased risk of chemotherapy-induced toxicity compared to younger adults. Various pharmacological parameters must be taken into account in the oncological treatment of older patients. Assessing age-related conditions that affect tolerability with geriatric evaluation is very important when planning chemotherapy. Several studies have shown that geriatric assessment variables can be used to identify older adults who are most at risk of severe toxicity from chemotherapy. Oral oncological therapies present several advantages. However, they also contain disadvantages, especially in older patients, which can lead to poorer efficiency or earlier discontinuation of therapy. Despite the physiological phenomena of immunosenescence and inflammaging, the data, mainly coming from subgroup analysis of meta-analyses, tends to show that immunotherapy is effective and well-tolerated even in older patients.
Key Words: Cancer treatment, Chemotherapy toxicity, Geriatric assessment, Immunotherapy
Krebs ist eine Erkrankung des höheren Lebensalters, wobei etwa 50 % der neuen Krebsfälle bei Menschen im Alter von 65 Jahren oder älter auftreten und diese Zahl bis 2030 voraussichtlich auf 58 % ansteigen wird (1). Obwohl die meisten Krebserkrankungen bei älteren Menschen auftreten, werden neue Krebsmedikamente hauptsächlich auf der Grundlage von Daten zugelassen, die an jüngeren Menschen oder an einer Auswahl gesunder älterer Menschen ohne Komorbiditäten oder geriatrische Beeinträchtigungen untersucht wurden.
Die Chemotherapie ist neben neuen Therapien wie der Immuntherapie und den zielgerichteten Therapien nach wie vor ein Standardbestandteil der Krebsbehandlung. Ältere Patienten haben jedoch im Vergleich zu jüngeren Erwachsenen ein höheres Risiko für Chemotherapie-induzierte Toxizität (2). Darüber hinaus wird älteren Erwachsenen seltener eine Chemotherapie angeboten, da es Bedenken hinsichtlich ihrer Fähigkeit, die Behandlung zu überstehen, gibt (3). Wichtig ist, dass sich die Pharmakologie von Krebsmedikamenten bei jüngeren und älteren Menschen aufgrund von Veränderungen in der Zusammensetzung der Körperflüssigkeiten, im Leberstoffwechsel, in der renalen und hepatischen Ausscheidung und in der Pharmakodynamik unterscheiden kann (4).
Pharmakokinetik bei älteren Leuten
Bei der onkologischen Behandlung älterer Patienten müssen verschiedene pharmakologische Parameter berücksichtigt werden. Die nachfolgend aufgeführten Parameter können einen Einfluss auf die onkologische Therapie haben (5):
• Orale Absorption
• Verteilungsvolumen
• Körperzusammensetzung
• Serum Albumin
• Hemoglobin
• Lebermetabolismus
• Renale Ausscheidung
• Biliäre Ausscheidung
• Medikamentöse Interaktionen
• Pharmakodynamik auf die zelluläre Ebene
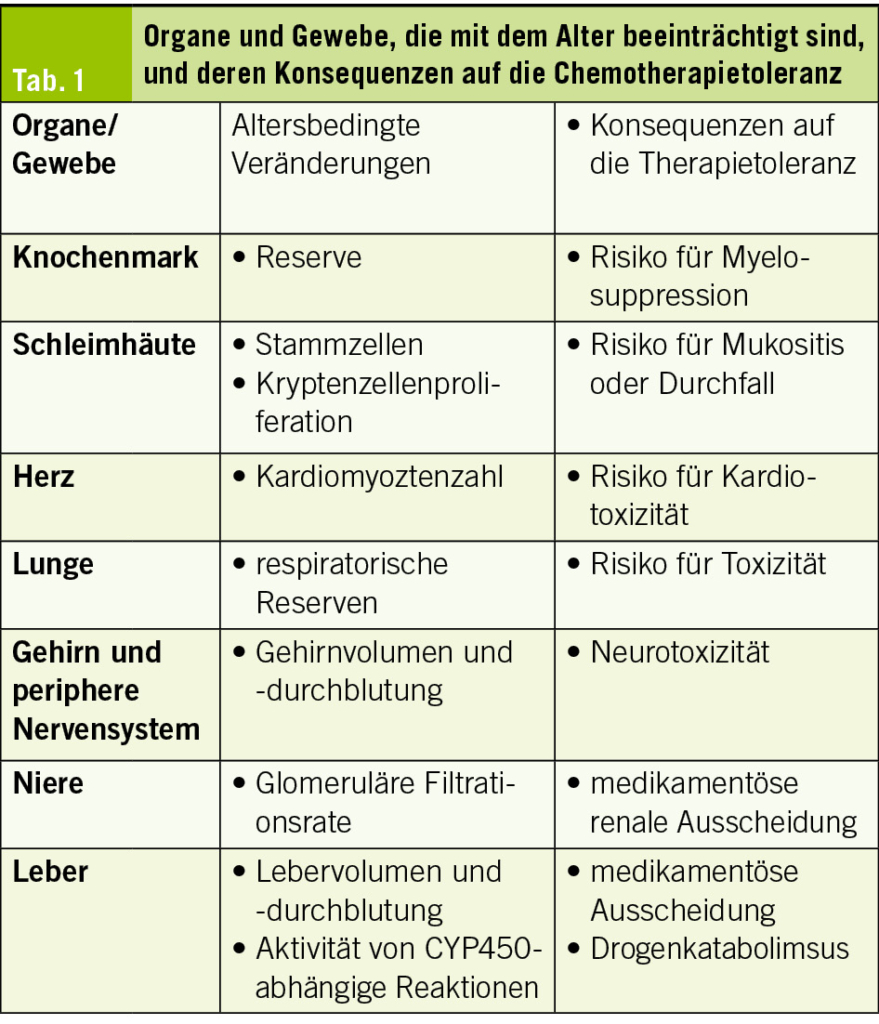
Bis zum Alter von 85 Jahren kommt es in der Regel zu einer allmählichen Zunahme des Körperfetts und zu einer Abnahme des Körperwassers. Man schätzt, dass zwischen dem 25. und 75. Lebensjahr der Fettgehalt von 15 % auf 30 % des Körpergewichts ansteigt und der intrazelluläre Wassergehalt von 42 % auf 33 % abnimmt (4). Diese Veränderungen führen dazu, dass das Verteilungsvolumen von wasserlöslichen Arzneimitteln wie Anthrazyklinen abnimmt und das Verteilungsvolumen von fettlöslichen Verbindungen wie Carmustin (BCNU) zunimmt. Auch die Leberfunktion verändert sich mit zunehmendem Alter: Es wurde über eine Abnahme der Lebergrösse (um 18-44 %), des Blutflusses, der Albuminproduktion und der CYP-Funktion berichtet. Aufgrund der glomerulären Veränderungen ist die verminderte renale Elimination die am besten vorhersagbare pharmakokinetische Veränderung. Die Filtrationsrate (GFR) nimmt ab dem 40. Lebensjahr mit zunehmendem Alter kontinuierlich um etwa 1 ml/min pro Jahr ab (Tab. 1).
Geriatrische Evaluation
Das chronologische Alter allein reicht nicht aus, um die Verträglichkeit einer Therapie vorherzusagen (6).
Das geriatrische Assessment (GA) verwendet validierte Instrumente zur Beurteilung altersbedingter Erkrankungen, einschliesslich Funktion, körperlicher Leistungsfähigkeit (z. B. Mobilität), Komorbiditäten, Medikamente, Kognition, Ernährungszustand, psychischer Status und soziale Unterstützung.
• Funktion: Aktivitäten des täglichen Lebens (ADL) und instrumentelle ADL (IADL)
• Komorbidität: aktualisierter Charlson-Komorbiditätsindex
• Mobilität: Timed Up and Go
• Kognition: Mini-Cog
• Ernährung: Gewichtsverlust und Body-Mass-Index
• Stimmung: kurze geriatrische Depressionsskala
• soziale Unterstützung: Alleinleben versus Unterstützung zu Hause.
In den USA hat sich die Alliance for Clinical Trials in Oncology (Allianz für klinische Studien in der Onkologie) für eine standardisierte geriatrische Beurteilung in Therapiestudien mit älteren Erwachsenen eingesetzt (7). In klinischen Therapiestudien hat sich gezeigt, dass die GA das Verständnis der Verträglichkeit durch 1. eine bessere Charakterisierung der Studienstichprobe über das Alter hinaus verbessert, 2. eine genauere Identifizierung von Faktoren, die mit einer schlechten Verträglichkeit in Zusammenhang stehen, ermöglicht, 3. die Integration in Randomisierungen zur Unterstützung von Behandlungsentscheidungen sowie 4. die Beurteilung der Auswirkungen der Behandlung auf für ältere Erwachsene wichtige Ergebnisse verbessert. Im Zeitraum von 2000 bis 2017 beinhalteten nur 41,5 % der 41 Phase-II-III-Studien mit systemischen Therapien, an denen ausschliesslich ältere Erwachsene mit Krebs teilnahmen, eine Bewertung von Komorbidität oder Gebrechlichkeit, und nur 36,6 % berücksichtigten Todesfälle aus anderen Gründen.
Chemotherapie-Toxizität Prädiktoren
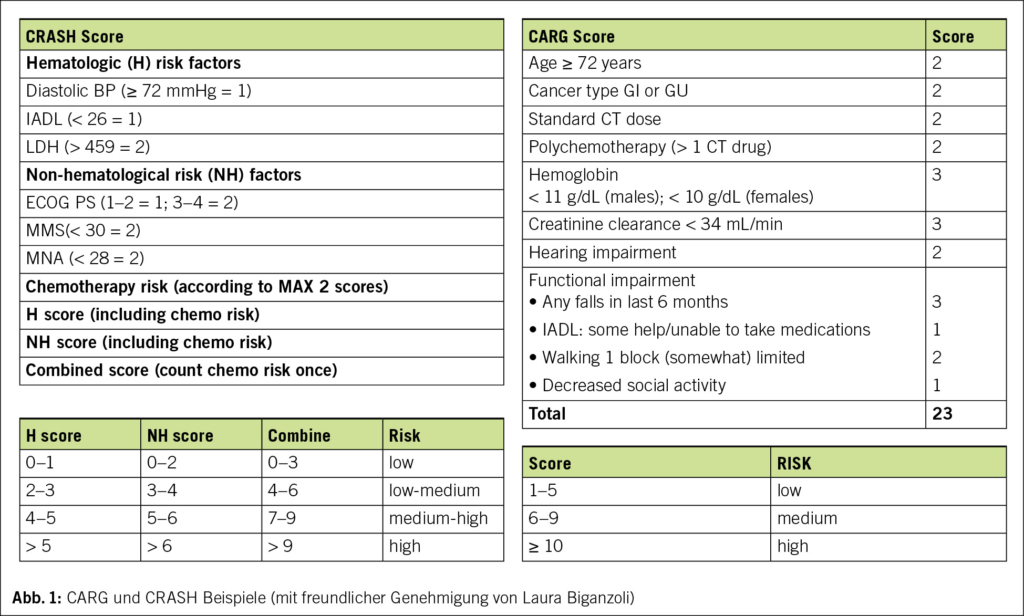
Mehrere Studien haben gezeigt, dass die Verwendung von GA-Variablen es ermöglicht, ältere Erwachsene zu identifizieren, bei denen das Risiko einer schweren Toxizität durch Chemotherapie am höchsten ist. Das CARG (Cancer and Aging Research Group) Toxicity Tool (2) und die Chemotherapy Risk Assessment Scale for High-Age Patients (CRASH) (8) wurden entwickelt und jeweils an etwa 1000 älteren Patienten validiert. Diese Instrumente wurden in spezifischen klinischen Szenarien wie der adjuvanten Chemotherapie bei Brustkrebs und in Gesundheitssystemen ausserhalb der USA mit unterschiedlichen Ergebnissen weiter untersucht.
Das CRASH Score erlaubt Patienten in 4 Kategorien zu stratifizieren: low, medium-low, medium-high und high Risk einer hämatologische (H) oder nicht-hämatologische (NH) Toxizität zu entwickeln. In der CARG-Studie war interessanterweise der vom Arzt bewertete Karnofsky Performance Score weder in der Entwicklungskohorte noch in der Validierungskohorte prädiktiv für die Toxizität der Chemotherapie. Beide dienen dem Onkologen im klinischen Alltag als zusätzliche Hilfe, wenn Zweifel an einer optimal angepassten Behandlung bestehen. Diese Modelle sollten berücksichtigt werden, wenn Risiken und Nutzen einer Chemotherapie bei älteren Patienten diskutiert werden (Abb. 1)
Übersicht verschiedener Chemotherapien bei betagten Karzinompatienten (9)
Alkylanzien
Alkylanzien sind seit Jahrzehnten die Grundlage der onkologischen Therapie. Ihre wichtigste dosislimitierende Toxizität (DLT) ist die Hämatotoxizität. Es besteht eine grosse interindividuelle Variabilität hinsichtlich der Knochenmarkreserven, welche physiologisch mit dem Alter reduziert sind. Der Stoffwechsel stellt für die meisten Verbindungen den biliären Ausscheidungsweg dar. Häufig sind enzymatische Prozesse in der Leber beteiligt und können sich mit zunehmendem Alter ändern.
Cyclophosphamid:
Der Metabolismus von Cyclophosphamid zu den aktiven Metaboliten wird durch Cytochrom P450 (Unterfamilie 3A und 2B), hauptsächlich in der Leber, eingeleitet. Bei Niereninsuffizienz ist mit einer Akkumulation toxischer alkylierender Metaboliten zu rechnen, die je nach Grad der Niereninsuffizienz eine Dosisreduktion von 20 bis 30 % rechtfertigt. Es gibt präklinische Hinweise darauf, dass Cyclophosphamid bei älteren Menschen langsamer metabolisiert wird, ohne solide Evidenz, dass die Dosis von Cyclophosphamid bei älteren Patienten reduziert werden sollte (10).
Intravenöse Fluoropyrimidine
Fluoropyrimidine sind eine der am häufigsten in der Onkologie eingesetzten Substanzklassen (11). Für eine Dosisanpassung allein aufgrund des Alters gibt es keine pharmakokinetische Grundlage (10). Allerdings kann es zu erheblichen altersbedingten Toxizitäten kommen. Bisherige Daten empfehlen keine Dosisreduktion allein aufgrund des Alters, ausser bei schwerer Niereninsuffizienz oder Komorbiditäten.
Capecitabine
Die Pharmakokinetik von Capecitabin ist altersunabhängig, sofern eine normale Nierenfunktion vorliegt (12). Bei Patienten mit mässiger Niereninsuffizienz (geschätzte CrCl 30 bis 50 ml/min) wurde eine höhere Inzidenz von Grad 3 und 4 Toxizitäten (Hand-Fuss-Syndrom, Diarrhoe, Myelotoxizität) beschrieben.
Platine
Oxaliplatin
Oxaliplatin wird hauptsächlich bei Patienten mit Darmkrebs eingesetzt. Die wichtigsten dosislimitierenden Toxizitäten sind periphere Neuropathie und Knochenmarkssuppression. Die Kombination von Oxaliplatin und Capecitabin wurde bei Patienten über 70 Jahren untersucht, und es konnte kein Zusammenhang zwischen dem Ansprechen und dem Alter des Patienten, dem ECOG Performance Status oder der Fähigkeit, Aktivitäten des täglichen Lebens (ADL) oder instrumentelle ADL (IADL) durchzuführen, gezeigt werden (13). Es liegen keine Daten vor, die eine Dosisreduktion allein aufgrund des Alters rechtfertigen. Eine Dosisreduktion sollte jedoch bei Patienten mit stark eingeschränkter Nierenfunktion erfolgen.
Cisplatin
Aufgrund des Beitrags der renalen Elimination von Cisplatin hängt die Pharmakokinetik von Cisplatin von einer normalen Nierenfunktion ab. Das Alter ist ein unabhängiger und signifikanter Prädiktor für die AUC (Area Under the Curve) der freien ultrafiltrierbaren Platinfraktion und des Gesamtplasmaplatins, wobei die AUC mit zunehmendem Alter ansteigt (14). Die hohe Inzidenz von altersbedingtem Hörverlust sollte ebenfalls berücksichtigt werden. Cisplatin sollte in einem niedrigeren Dosisbereich (z.B. 60 mg/m2) und vorzugsweise mit einer reduzierten Infusionsrate (z.B. über 24 Stunden) verabreicht werden, um eine übermässige Toxizität bei älteren Menschen zu vermeiden.
Carboplatin
Carboplatin hat einen ähnlichen Wirkungsmechanismus wie Cisplatin mit antineoplastischer Wirkung in mehreren onkologischen Indikationen, die mehr oder weniger mit Cisplatin vergleichbar sind. Carboplatin wird renal eliminiert und in der Regel nicht über die Körperoberfläche, sondern über die Kreatinin-Clearance berechnet. Die Formeln nach Cockcroft-Gault, Calvert und Chatelut ermöglichen eine genaue und sichere Dosierung, die AUC berücksichtigt die Nierenfunktion und das Alter (15). Aufgrund der geringen Inzidenz nicht-hämatologischer Toxizität kann Carboplatin Cisplatin im palliativen Setting oder bei Nebenwirkungen ersetzen.
Anthrazykline
Anthrazykline sind Bestandteil verschiedener Chemotherapieprotokolle, die auch bei älteren Patienten eingesetzt werden können. Die am häufigsten beobachtete Toxizität ist die Kardiotoxizität, die bei der Behandlung mit Doxorubicin am stärksten ausgeprägt ist. Eine erhöhte Inzidenz von Herzinsuffizienz wurde nach Behandlung mit Anthrazyklinen mit zunehmendem Alter über 70 Jahre beschrieben (16).
Antimikrotubuli
Vinka alkaloide
Für die Arzneimittel Vincristin und Vinorelbin liegen derzeit keine Daten zu rein altersabhängigen Dosismodifikationen vor. Für Vinorelbin wurden zahlreiche Interaktionen mit anderen Arzneimitteln beschrieben, die für ältere Patienten relevant sein könnten (17). Vincristin weist im Vergleich zu Vimorelbin eine erhöhte Neurotoxizität auf und sollte bei älteren und vorerkrankten
Patienten in der Dosis angepasst werden.
Taxane
Über den Einfluss des Alters auf die Clearance von Paclitaxel liegen widersprüchliche Daten vor. Die Haupttoxizität ist hämatologisch und neurologisch mit peripherer Neuropathie. Eine wöchentliche Verabreichung scheint besser verträglich zu sein, ohne Wirksamkeitsverlust (18), jedoch ohne klare Daten für die eine oder andere Dosierung. Mehrere Studien haben die Toxizität von Docetaxel bei älteren Patienten untersucht (19). Letztendlich gibt es keine eindeutigen Daten, die eine Dosisanpassung allein aufgrund des Alters rechtfertigen, obwohl bekannt ist, dass die 3-wöchentliche Gabe hämatotoxischer ist und dass die Knochenmarksreserve bei älteren Patienten physiologisch reduziert ist.
Zytidine Analoga
Gemcitabin zeigt in der Monotherapie bei älteren Patienten im Allgemeinen eine minimale Toxizität (20).
Antimetaboliten
Pemetrexed sollte bei älteren Patienten mit eingeschränkter Nierenfunktion mit Vorsicht verabreicht werden, da das Risiko einer Hämatotoxizität erhöht sein kann.
Adhärenz zu oralen Medikamenten
Orale onkologische Therapien stellen mehrere Vorteile dar. Sie ermöglichen weniger klinische Termine, sind weniger invasiv und verbessern die Patientenautonomie. Sie haben jedoch auch Nachteile, insbesondere bei älteren Patienten, die zu einer geringeren Wirksamkeit oder einem früheren Therapieabbruch führen können.
Es gibt verschiedene Faktoren, die die Adhärenz zu oralen Therapien bei älteren Patienten beeinflussen (21):
• Patientenbezogene Faktoren: Alter, Gender, Gesundheitsstatus
• Alterspezifische Faktoren: kognitive Defizite, visuelle oder auditive Beeinträchtigungen, Komorbiditäten, Polypharmazie
• Sozioökonomische Situation: soziale Situation, caregiver-Qualität, familiäre Unterstützung
• Krankheitsbedingte Faktoren: Krankheitschwere, unkontrollierte Beschwerden, psychologische Komponente
• Therapiebezogene Faktoren: Toxizität der Therapie, Therapiedauer, Wirksamkeit
• Health-care Team Faktoren: Medikamentenverfügbarkeit und –versorgung, Patient-Anbieter Beziehung, Kommunikationsbarriere, unzureichende oder unklare Arzneimittelinformation
Bei schlechterer Effizienz, früherem Abbruch oder erhöhter Toxizität ist Non-Adherenz mit einer erhöhten Mortalität assoziiert.
Verschiedene Interventionen, wie z. B. klare schriftliche Patientenanweisungen, Einbeziehung der Betreuungspersonen, soziale Unterstützung, kontinuierliche Überwachung und Bewertung durch das Gesundheitsteam, können die Therapietreue verbessern.
Toxizität der Immuntherapie bei älteren Patienten (22)
Immunbedingte Nebenwirkungen können bei älteren Menschen aufgrund einer reduzierten funktionellen Reserve und altersbedingter Komorbiditäten eine grössere Herausforderung darstellen (23). Trotz der physiologischen Phänomene der Immunoseneszenz und des Inflammaging zeigen die Daten, die überwiegend aus Subgruppenanalysen von Metaanalysen stammen, tendenziell, dass eine Immuntherapie auch bei älteren Patienten wirksam und gut verträglich ist. In der klinischen Praxis stellen Checkpoint-Inhibitoren daher auch für ältere Patienten eine gute Behandlungsoption dar (24).
Copyright Aerzteverlag medinfo AG
Aktualisierte und Überarbeitete Version aus Therapeutische Umschau 08/2023
HFR Freiburg – Kantonsspital
Chemin des Pensionnats 2-6
1752 Villars-sur-Glâne
verene.dogoud-chauvin@h-fr.ch
Dr. med. Dougoud-Chauvin hat Travel Grants von Amgen erhalten.
1. Pilleron S, Sarfati D, Janssen-Heijnen M, Vignat J, Ferlay J, Bray F, et al. Global cancer incidence in older adults, 2012 and 2035: A population-based study. International Journal of Cancer. 2019;144(1):49 58.
2. Hurria A, Mohile S, Gajra A, Klepin H, Muss H, Chapman A, et al. Validation of a Prediction Tool for Chemotherapy Toxicity in Older Adults With Cancer. J Clin Oncol. 2016;34(20):2366 71.
3. Hurria A, Wong FL, Villaluna D, Bhatia S, Chung CT, Mortimer J, et al. Role of Age and Health in Treatment Recommendations for Older Adults With Breast Cancer: The Perspective of Oncologists and Primary Care Providers. JCO. 2008;26(33):5386 92.
4. Wildiers H, de Glas NA. Anticancer drugs are not well tolerated in all older patients with cancer. The Lancet Healthy Longevity. 2020;1(1):e43 7.
5. Pharmacology of Anticancer Drugs in the Elderly Population | SpringerLink [Internet]. [2023]. Disponible sur: https://link.springer.com/article/10.2165/ 00003088-200342140-00003
6. Flannery MA, Culakova E, Canin BE, Peppone L, Ramsdale E, Mohile SG. Understanding Treatment Tolerability in Older Adults With Cancer. JCO. 2021;39(19):2150 63.
7. Adjei A, Buckner JC, Cathcart-Rake E, Chen H, Cohen HJ, Dao D, et al. Arti Hurria, M.D.: A tribute to her shining legacy in the Alliance for Clinical Trials in Oncology. J Geriatr Oncol. 2020;11(2):179 83.
8. Extermann M, Boler I, Reich RR, Lyman GH, Brown RH, DeFelice J, et al. Predicting the risk of chemotherapy toxicity in older patients: the Chemotherapy Risk Assessment Scale for High-Age Patients (CRASH) score. Cancer. 2012;118(13):3377 86.
9. Lichtman SM, Wildiers H, Chatelut E, Steer C, Budman D, Morrison VA, et al. International Society of Geriatric Oncology Chemotherapy Taskforce: Evaluation of Chemotherapy in Older Patients—An Analysis of the Medical Literature. JCO. 2007;25(14):1832 43.
10. Wildiers H, Highley MS, de Bruijn EA, van Oosterom AT. Pharmacology of anticancer drugs in the elderly population. Clin Pharmacokinet. ;42(14):1213 42.
11. Grem JL, Takimoto CH, Multani P, Chu E, Ryan D, Chabner BA, et al. Antimetabolites. Cancer Chemother Biol Response Modif.;18:1 38.
12. Cassidy J, Twelves C, Cameron D, Steward W, O’Byrne K, Jodrell D, et al. Bioequivalence of two tablet formulations of capecitabine and exploration of age, gender, body surface area, and creatinine clearance as factors influencing systemic exposure in cancer patients. Cancer Chemother Pharmacol.;44(6):453 60.
13. Feliu J, Salud A, Escudero P, Lopez-Gómez L, Bolaños M, Galán A, et al. XELOX (capecitabine plus oxaliplatin) as first-line treatment for elderly patients over 70 years of age with advanced colorectal cancer. Br J Cancer. 2006;94(7):969 75.
14. Yamamoto N, Tamura T, Maeda M, Ando M, Shinkai T, Eguchi K, et al. The influence of ageing on cisplatin pharmacokinetics in lung cancer patients with normal organ function. Cancer Chemother Pharmacol. 1995;36(2):102 6.
15. Donahue A, McCune JS, Faucette S, Gillenwater HH, Kowalski RJ, Socinski MA, et al. Measured versus estimated glomerular filtration rate in the Calvert equation: influence on carboplatin dosing. Cancer Chemother Pharmacol. 2001;47(5):373 9.
16. Pinder MC, Duan Z, Goodwin JS, Hortobagyi GN, Giordano SH. Congestive heart failure in older women treated with adjuvant anthracycline chemotherapy for breast cancer. J Clin Oncol. 2007;25(25):3808 15.
17. Loadman PM, Bibby MC. Pharmacokinetic drug interactions with anticancer drugs. Clin Pharmacokinet. 1994;26(6):486 500.
18. Green MC, Buzdar AU, Smith T, Ibrahim NK, Valero V, Rosales MF, et al. Weekly paclitaxel improves pathologic complete remission in operable breast cancer when compared with paclitaxel once every 3 weeks. J Clin Oncol. 2005;23(25):5983 92.
19. Massacesi C, Marcucci F, Boccetti T, Battelli N, Pilone A, Rocchi MBL, et al. Low dose-intensity docetaxel in the treatment of pre-treated elderly patients with metastatic breast cancer. J Exp Clin Cancer Res. 2005;24(1):43 8.
20. Shepherd FA, Abratt RP, Anderson H, Gatzemeier U, Anglin G, Iglesias J. Gemcitabine in the treatment of elderly patients with advanced non-small cell lung cancer. Semin Oncol. avr 1997;24(2 Suppl 7):S7-50-S7-55.
21. Mislang AR, Wildes TM, Kanesvaran R, Baldini C, Holmes HM, Nightingale G, et al. Adherence to oral cancer therapy in older adults: The International Society of Geriatric Oncology (SIOG) taskforce recommendations. Cancer Treat Rev. 2017;57:58 66.
22. Rhyner Agocs G, Dougoud-Chauvin V, Betticher D. Immunothérapie: aussi chez le patient âgé ? Rev Med Suisse. 2019;660:1512 5.
23. Extermann M. Interaction between comorbidity and cancer. Cancer Control. 2007;14(1):13 22.
24. Haanen J, Obeid M, Spain L, Carbonnel F, Wang Y, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-upI. Annals of Oncology. 2022;33(12):1217 38.