Quelle: Shanafelt T D, et al. Ibrutinib–Rituximab or Chemoimmunotherapyfor Chronic Lymphocytic Leukemia. N Engl J Med 2019;381:432-43
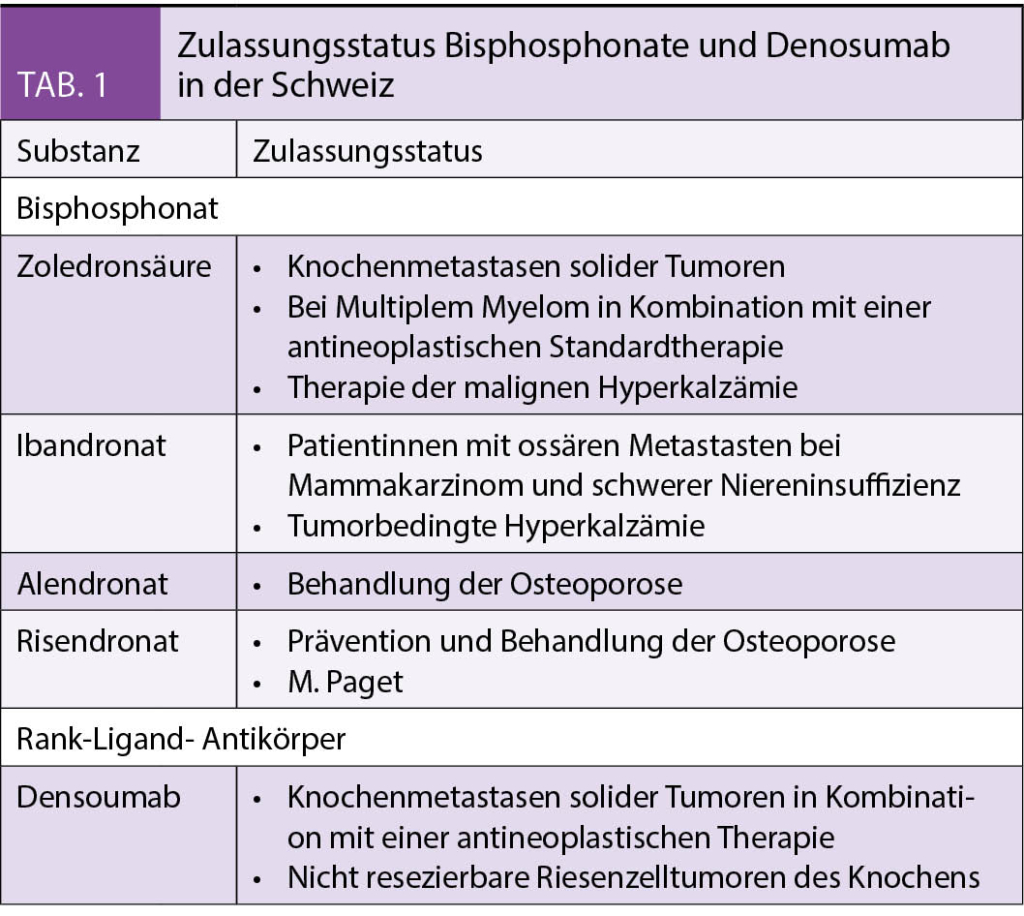
Daten zur Wirksamkeit der Behandlung mit Ibrutinib-Rituximab im Vergleich zur Standard-Immunchemotherapie mit Fludarabin, Cyclophosphamid und Rituximab bei Patienten mit bisher unbehandelter chronischer lymphatischer Leukämie (CLL) sind begrenzt.
In einer Phase-3-Studie wurden nach dem Zufallsprinzip (im Verhältnis 2:1) Patienten im Alter von 70 Jahren oder jünger mit zuvor unbehandelter CLL entweder zu Ibrutinib und Rituximab für sechs Zyklen (erster Zyklus mit Ibrutinib allein), gefolgt von Ibrutinib bis zum Fortschreiten der Erkrankung, oder sechs Zyklen Immunchemotherapie mit Fludarabin, Cyclophosphamid und Rituximab (FCR) zugewiesen. Der primäre Endpunkt war das progressionsfreie Überleben. Das Gesamtüberleben war ein sekundärer Endpunkt. Es wird über die Ergebnisse einer geplanten Zwischenanalyse berichtet.
Insgesamt wurden 529 Patienten randomisiert (354 Patienten in die Ibrutinib-Rituximab-Gruppe und 175 in die FCR-Gruppe), bei einem medianen Follow-up von 33,6 Monaten.
Das progressionsfreie Überleben (PFS) begünstigte Ibrutinib-Rituximab gegenüber FCR (89,4% vs. 72,9% nach 3 Jahren; Hazard Ratio für Progression oder Tod, 0,35 (95% Konfidenzintervall [CI], 0,22 bis 0,56; P< 0,001). Die Ergebnisse entsprachen dem protokolldefinierten Endpunkt für die Zwischenanalyse. Auch die Anaylse des Gesamtüberlebensbevorzugte Ibrutinib-Rituximab gegenüber FCR (98,8% vs. 91,5% nach 3 Jahren; Todesfallrate 0,17; 95% CI, 0,05 bis 0,54; P < 0,001). In einer Untergruppenanalyse von Patienten ohne IGHV-Mutation führte Ibrutinib-Rituximab zu einem besseren PFS als FCR (90,7% gegenüber 62,5% nach 3 Jahren; Hazard Ratio für Progression oder Tod, 0,26; 95% CI, 0,14 bis 0,50). Das progressionsfreie 3-Jahres-Überleben bei Patienten mit IGHV-Mutation betrug 87,7% in der Ibrutinib-Rituximab-Gruppe und 88,0% in der FCR-Gruppe (Hazard Ratio für Progression oder Tod, 0,44; 95% CI, 0,14 bis 1,36). Die Häufigkeit Grad 3 oder höher Nebenwirkungen (unabhängig von der Zuordnung) war in den beiden Gruppen ähnlich (bei 282 von 352 Patienten [80,1%], die Ibrutinib-Rituximab erhielten und bei 126 von 158 [79,7%], die FCR erhielten), während infektiöse Komplikationen Grad 3 oder höher bei der Ibrutinib-Rituximab-Therapie weniger häufig waren als bei der FCR-Therapie (bei 37 Patienten[10,5%] vs. 32[20,3%], P < 0.001).
Schlussfolgerungen
Das Ibrutinib-Rituximab-Regime führte zu einem besseren progressionsfreien Überleben und Gesamtüberleben als FCR bei unbehandelten CLL-Patienten, die 70 Jahre oder jünger waren.
Tagraxofusp bei blastischer plasmazytoider dendritische Zellneoplasie
Quelle: Pemmaraju N et al. Tagraxofusp in blastic plasmacytoid dendritic-cell neoplasm. N Engl J Med 2019 ;380 :1628-1637
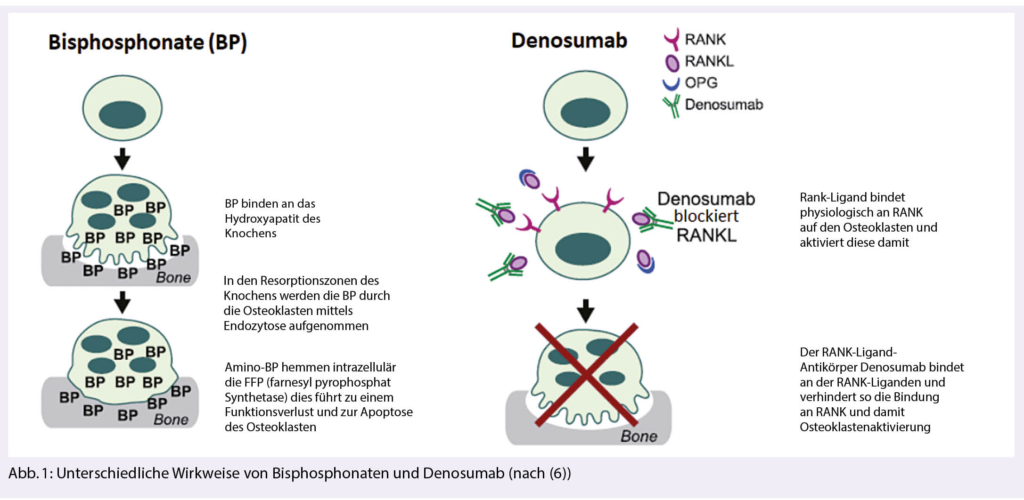
Die blastische plasmazytoide dendritische Zellneoplasie (Blastic Plasmacytoid Dendritic Cell Neoplasm, BPDCN) ist eine aggressive hämatologische Neoplasie, die durch transformierte plasmazytoide dendritische Zellen verursacht wird, die die Alpha Untereinheit des Interleukin-3 Rezeptors (IL3RA oder CD123) überexprimieren. Tagraxofusp (SL-401) ist ein gegen CD123 gerichtetes Zytotoxin, bestehend aus humanem Interleukin-3, das mit einem trunkierten Diphtherietoxin fusioniert ist.
In einer Multikohorten-Studie wurden 47 Patienten mit unbehandelter oder rezidivierter BPDCN mit einer intravenösen Infusion von Tagraxofusp in einer Dosis von 7μg oder 12 μg pro Kilogramm Körpergewicht an den Tagen 1 bis 5 eines jeden 21-Tage-Zyklus behandelt. Die Behandlung wurde bis zum Fortschreiten der Erkrankung oder bis zu unannehmbaren toxischen Nebenwirkungen fortgesetzt. Der primäre Endpunkt war die Kombination aus kompletter Remission und klinischer kompletter Remission bei Patienten ohne vorbehandelte BPDCN. Der sekundäre Endpunkt war die Dauer des Ansprechens.
Von den 47 Patienten erhielten 32 Tagraxofusp als Erstlinientherapie, 15 Patienten hatten eine Behandlung davor erhalten. Das mittlere Alter der Patienten betrug 70 Jahre (22 bis 84 Jahre). Unter den 29 bisher unbehandelten Patienten, die Tagraxofusp in einer Dosis von 12 μg pro Kilogramm erhielten, wurde der primäre Endpunkt in 21 Fällen (72%) erreicht, die Gesamtansprechrate betrug 90%. Von diesen Patienten wurden 45% mit einer Stammzelltransplantation konsolidiert. Die Überlebensrate nach 18 und 24 Monaten betrug 59% bzw. 52%. Unter den 15 zuvor behandelten Patienten war die Ansprechrate 67%, und das mediane Gesamtüberleben betrug 8,5 Monate. Die häufigsten Nebenwirkungen waren erhöhte Alanin-Aminotransferase (64%) und Aspartat-Aminotransferase (60%), Hypalbuminämie (55%), periphere Ödem (51%), und Thrombozytopenie (49%). Ein «Capillary leak syndrome» trat in 19% der Fälle auf. In jeder Dosisgruppe trat ein Todesfall auf.
Schlussfolgerungen
Bei erwachsenen Patienten mit unbehandelter oder rezidivierter BPDCN führte die Behandlung mit Tagraxofusp zu einem klinischem Ansprechen. Eine schwerwiegende Nebenwirkungen war das «Capillary leak syndrome»; Hepatische Dysfunktion und Thrombozytopenie waren häufig.
Multizenter-Analyse bei blastischer plasmazytoider dendritische Zellneoplasie als Benchmark für zielgerichteten Therapie.
Quelle: Taylor J et al. Multicenter Analysis of Outcomes in Blastic Plasmacytoid Dendritic Cell Neoplasm Offers a PreTargeted Therapy Benchmark. Blood First Edition Paper, prepublished online July 2, 2019; DOI 10.1182/blood.2019001144
Das blastische plasmazytoide dendritische Zellneoplasie (blastic plasmacytoid denritic cell neoplasm, BPDCN) ist eine seltene hämatologische Malignität mit ungünstiger Prognose. Daten zum klinischen Verhalten von BPDCN sind limitiert, da die berichteten Ergebnisse aus kleinen retrospektiven Serien stammen und keine standardisierten Behandlungsrichtlinien vorliegen.
Das IL-3-Zytotoxinkonjugat Tagraxofusp wurde kürzlich in Phase-1/2-Studien getestet, die zur Zulassung durch die U.S. Food and Drug Administration führten; Die erste Zulassung für BPDCN überhaupt. Da es jedoch weder in dieser oder noch in einer anderen klinischen Studie bisher einen passenden internen Vergleich gab, sind die Ergebnisse von BPDCN-Studien, in denen neue Medikamente getestet werden, schwer mit alternativen Therapien vergleichbar. Es wurden deshalb die klinischen Merkmale und Outcome einer Gruppe von Patienten mit BPCDN zusammengefasst, die an 3 US-Krebszentren in der modernen Ära (vor Tagraxofusp-Zulassung) behandelt wurden.
Bei 59 Patienten mit BPDCN betrug das mediane Gesamtüberleben ab Diagnose 24 Monate und das Outcome war ähnlich bei Patienten mit rein kutaner Manifestation der BPDCN oder mit systemischer Erkrankung. Eine intensive Erstlinientherapie und eine Chemotherapie vom «lymphoiden» Typ waren mit einem besseren Outcome verbunden. Nur 55% der Patienten erhielten eine intensive Chemotherapie und 42% wurden mit einer Stammzelltransplantaton konsolidiert. Ungünstige prognostische Parameter waren: Alter über 60 Jahre, abnormaler Karyotyp und TdT-Negativität in den BPDCN-Zellen. Ein Ansprechen auf Pralatrexat und Enasidenib wurde bei einzelnen Patienten festgestellt. Diese Studie zeigt, dass das Outcome für BPDCN-Patienten in der modernen Ära ungünstig ist und dass neue Therapieansätze notwendig sind. Die Ergebnisse laufender klinischen Studien bei BPDCN können im Kontext dieser kontemporären Kohorte interpretiert werden.
Zentrum für Hämatologie und Onkologie
UniversitätsSpital Zürich
Zentrum für Hämatologie und Onkologie
UniversitätsSpital Zürich
Alexandre.Theocharides@usz.ch