Bariatrische Patienten benötigen regelmässige Nachkontrollen, um Komplikationen und ungünstige Verläufe frühzeitig erkennen und behandeln zu können. Da die Zahl von Patienten, welche einen bariatrischen Eingriff zur Behandlung der Adipositas und ihrer Komorbiditäten erhalten, rasch ansteigt, ist es zunehmend wichtig, dass auch Ärzte in der Praxis Kenntnis der wichtigsten Folgen von bariatrischen Operationen haben. Die Themen in der Nachsorge sind der Gewichtsverlauf, das frühzeitige Erkennen eines ungünstigen Verlaufes, Erkennen und Behandeln von Makro- und Mikronährstoffmängeln, gastrointestinale Symptome wie Schmerzen, Dumping usw. Der folgende Artikel gibt einen Überblick über diese Themen und beschreibt die Behandlungsmöglichkeiten.
Die Zunahme der Adipositas in den letzten Jahrzehnten hat unter anderem auch zu einer vermehrten Anwendung von bariatrischen Operationen geführt. In der SOS (Swedish Obese Subjects) Studie (1) wurden die anhaltenden Erfolge bezüglich Gewichtsverlauf, die Verbesserung der Komorbiditäten und die Reduktion der Mortalität von operierten Patienten eindrücklich dokumentiert, was zu einer nochmals breiteren Anwendung dieser Operationen geführt hat. Somit ist es zunehmend wichtig, dass auch Ärzte in der Praxis mit den Themen der Nachsorge und Problemen nach bariatrischen Operationen vertraut werden. Der folgende Artikel bietet einen Überblick über praxisrelevante Fragestellungen und möchte Hilfestellungen für das Vorgehen in typischen Situationen geben.
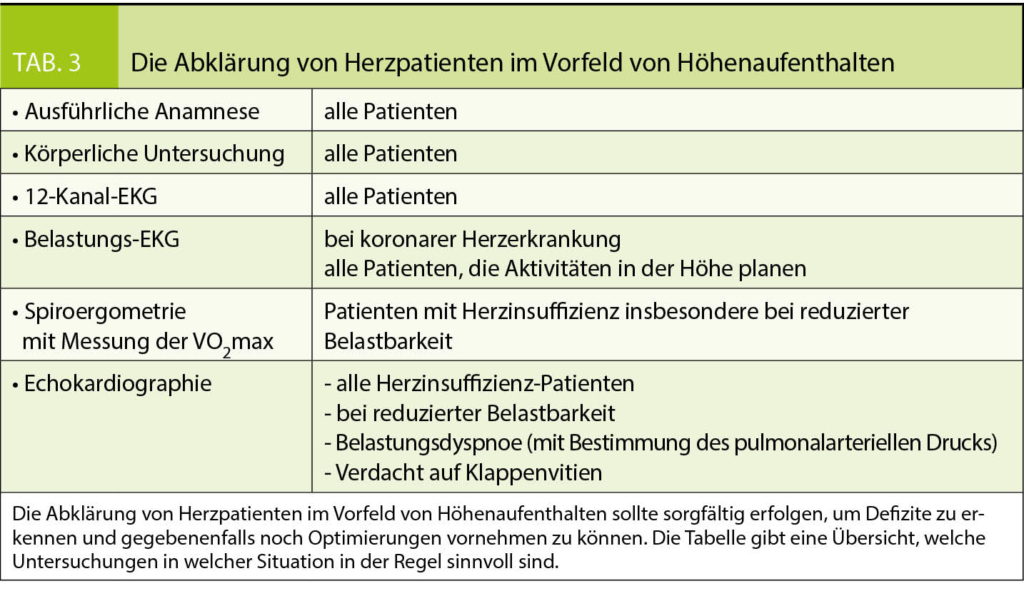
In der Schweiz wurden Guidelines für die operative Behandlung der Adipositas und die Nachsorge nach bariatrischen Operationen von der SMOB (Swiss Society for the Study of Morbid Obesity and Metabolic Disorders) erstellt und sind auf der Homepage www.smob.ch einsehbar und werden regelmässig aktualisiert. Gemäss diesen Guidelines sind die bariatrischen Zentren verpflichtet, die lebenslange Nachsorge für ihre Patienten sicherzustellen. Die Nachsorge erfolgt durch die bariatrischen Zentren in Zusammenarbeit mit den Hausärzten. Entsprechend den SMOB Richtlinien müssen die Zentren in den ersten 5 postoperativen Jahren eine Nachkontrollrate von mindestens 75% nachweisen können. Die Nachkontrollen sollen bei problemlosem Verlauf zwei, vier, acht und 12 Wochen postoperativ, dann drei-monatlich, im zweiten postoperativen Jahre alle sechs Monate, dann jährlich, jeweils mit Laborkontrolle der Mikronährstoffsituation erfolgen, bei Problemen häufiger. Die Konsultationen müssen ein Assessment und Beratung bezüglich des Gewichtsverlaufes, eine Erfassung der Ernährungs- und Bewegungssituation, sowie der Komorbiditäten beinhalten, weitere individuelle Fragestellungen sind zu thematisieren.
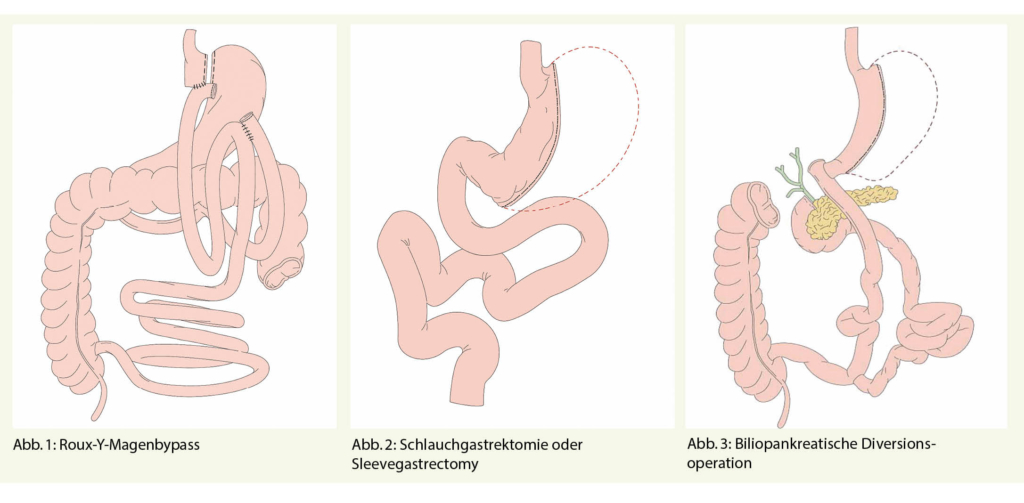
Die am häufigsten durchgeführte Operation ist der Magenbypass, meist in Form des proximalen Roux-Y-Magenbypasses (Abb. 1), welcher sowohl restriktiv wie auch malabsorptiv wirkt. Vor allem restriktiv wirkt die Schlauchgastrektomie oder Sleevegastrectomy (Abb. 2), sowie das Magenband, welches bis 2005 die Standardoperation darstellte, heute aber wegen Intoleranz, im Sinne von Oesophagusdysmotilität und Refluxsymptomen nicht mehr eingelegt wird. Die stärkste Gewichtsabnahme erfolgt nach der biliopankreatischen Diversionsoperation (Abb. 3). Diese Operation führt zu einer starken Malabsorption. Alle Operationen wirken auch über eine Veränderung der neuro-enterohumoralen Komponenten, d.h. über eine Veränderung der gastrointestinalen Peptidhormone und über eine Beeinflussung von zentralen Regelkreisen zur Regulierung von Sättigung und Belohnung. Auch die Veränderung der Microbiota nach den Operationen spielt eine Rolle in der Gewichtsreduktion.
Gewichtsverlauf und ungünstige Entwicklungen
Die durchschnittliche Gewichtsabnahme 5 Jahre nach Magenbypass beträgt 70% des Übergewichts (excessive weight loss, EWL), nach Schlauchgastrektomie ca. 60% und nach biliopankreatischer Diversion ca. 80%, wobei der Nadir 12-18 Monate nach der Operation erreicht ist. Im weiteren Verlauf ist eine Gewichtsstabilisierung anzustreben. Eine sekundäre Gewichtszunahme von ca. 5% bis 10% ist als normal anzuschauen und multifaktoriell bedingt. Es gilt aber festzuhalten, dass es keine klare Grenze gibt, was eine genügende Gewichtsabnahme darstellt. Das Gewichtsresultat muss auch im Kontext der Komorbiditäten betrachtet werden.
Eine Übersicht über die Faktoren und Behandlungsansätze bei ungenügender Abnahme oder verstärkter sekundärer Gewichtszunahme gibt die Tabelle 1.
Ein erhöhtes Risiko für eine überdurchschnittliche Gewichtsabnahme mit Verschlechterung des Allgemeinzustandes, Muskelmassen- und Kraftverlust besteht bei depressiver Stimmung, ungenügendem Einhalten der Ernährungsempfehlungen, vor allem ungenügender Proteinzufuhr, Entwicklung einer sekundären anorektischen Essstörung, Alkoholabusus, Suchterkrankungen, Tumoren oder chronischen Krankheiten, vor allem COPD. Ein erhöhtes Risiko für Malnutrition und Entwicklung von Untergewicht besteht vor allem nach den stark malabsorptiv wirkenden Eingriffen, vor allem nach biliopankreatischer Diversion.
Mikronährstoffmängel
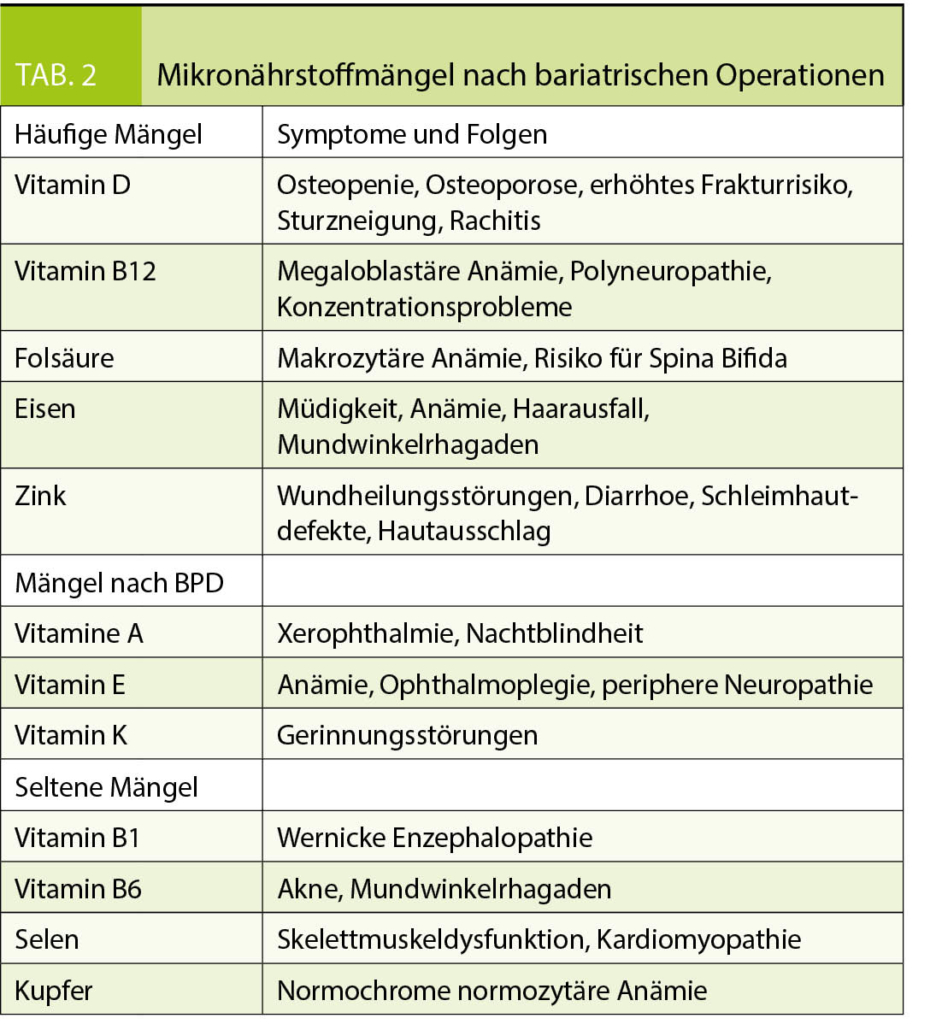
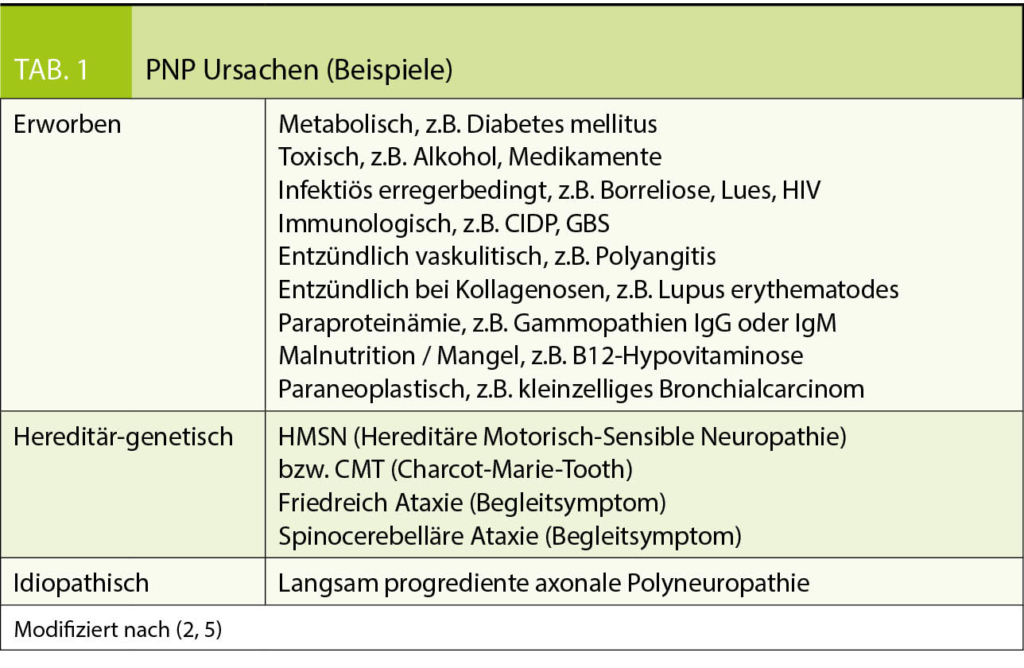
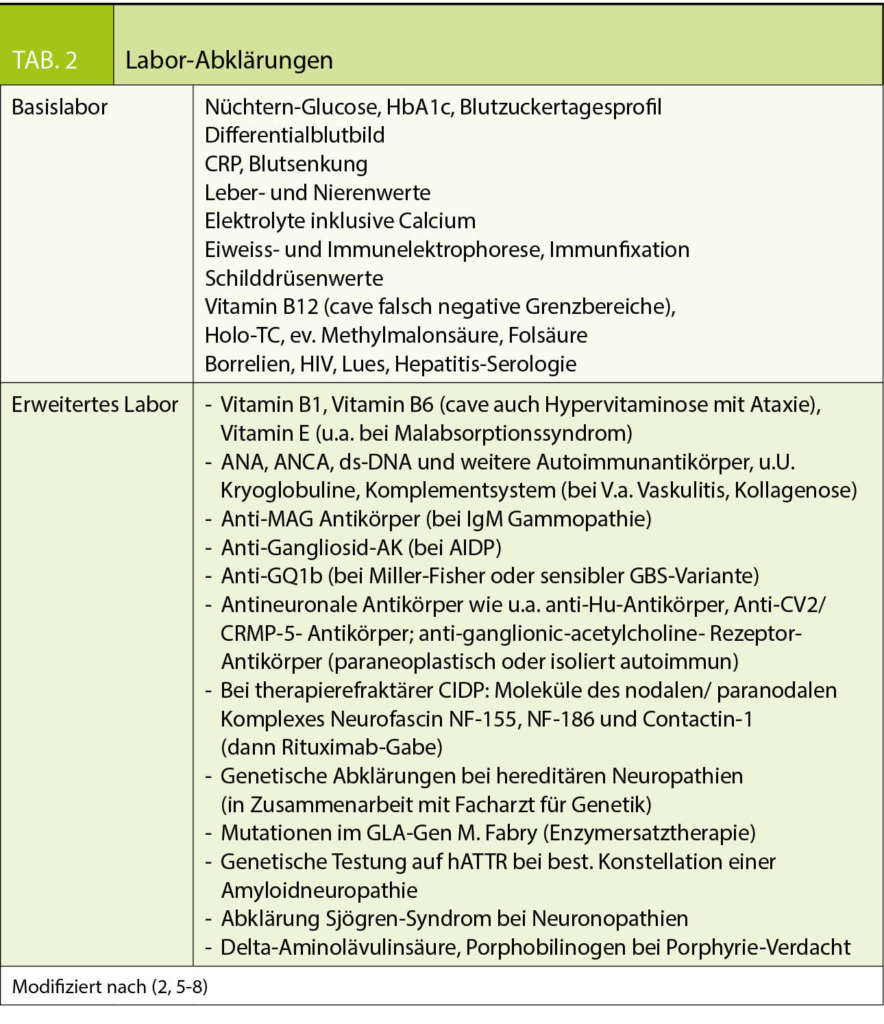
Nach bariatrischen Operationen besteht wegen kleiner Essmenge und Malabsorption das Risiko für Mikronährstoffmängel, weshalb eine lebenslange Mikronährstoffsupplementation unerlässlich ist (2, 3, 4). Zur Bedarfsdeckung können speziell für bariatrische Patienten entwickelte Präparate (z.B. WLS forte® von FitForMe oder Multi® von Bariatric Advantage) oder ein Multivitaminpräparat, wie z.B. Supradyn® alternierend mit einem B-Komplex-Vitamin eingenommen werden. Regelmässige Laborkontrollen sind immer indiziert, um Mängel frühzeitig erkennen und behandeln zu können. Es ist wichtig zu beachten, dass das Risiko für Mangelerscheinungen abhängig ist von der Art der Operation, d.h. Operationen mit starker malabsorptiver Komponente, vor allem die biliopankreatische Diversionsoperation, aber auch Bypassoperationen mit längeren von der Nahrung ausgeschalteten Dünndarmabschnitten (OAGB, RYGB mit extra-langer bilio-pankreatischer Schlinge) haben ein stark erhöhtes Risiko für Mikronährstoffmängel. Dabei steigt insbesondere das Risiko für einen Mangel an fettlöslichen Vitaminen (Vitamin A, D, E, K) und für die sonst seltenen Mängel an Selen oder Kupfer stark an. Nach Operationen mit rein restriktiver Komponente, z.B. Schlauchgastrektomie oder Magenband, ist das Risiko deutlich kleiner aber weiterhin vorhanden.
Weitere Gründe, wieso Mängel häufig nach bariatrischen Operationen auftreten, sind Geschmacksaversionen, Malcompliance der Patienten zur Einnahme der Supplemente, ungenügende Information der Patienten, ev. auch erhöhter Bedarf aus anderer Ursache, z.B. bei zusätzlichem Eisenverlust durch Hypermenorrhoe. Problematisch ist auch die fehlende Kassenpflichtigkeit der Supplemente. Mikronährstoffmängel sind auch schon vor bariatrischen Operationen häufig und sollen bereits präoperativ behandelt werden.
Die wichtigsten Mängel nach bariatrischen Operationen, inklusive Symptomen und Folgen sind in Tabelle 2 zusammengestellt.
Adipositas ist per se mit Vitamin-D-Mangel assoziiert, sodass ein Mangel schon präoperativ gesucht und behandelt werden muss. Die Calciumabsorption sinkt nach Magenbypass stark ab. Zur Osteoporoseprophylaxe ist deshalb nach Magenbypass- und biliopankreatischer Diversionsoperation auch eine Calcium-D3 Supplementation notwendig, um den erhöhten Bedarf zu decken und das Entstehen eines sekundären Hyperparathyreoidismus zu vermeiden. Gemäss den Guidelines der American Society of Metabolic and Bariatric Surgery (ASMBS) ist eine totale Calciumzufuhr von 1500 mg/Tag nach Sleevegastrectomy, 1500 – 2000 mg/Tag nach Magenbypass und 1800 – 2400 mg nach biliopankreatischer Diversion zu empfehlen, wobei so viel wie möglich durch alimentäre Zufuhr abzudecken ist (2, 3). Es ist wichtig, dass die Calcium-D3 Supplementation zeitlich versetzt zu den übrigen Supplementen einzunehmen ist, da sonst eine gegenseitige Absorptionshemmung auftritt.
Ein Zinkmangel ist nach bariatrischen Operationen häufig. In einer Studie hatten von 324 Patienten 9 % bereits präoperativ einen Zinkmangel, 12 Monate postoperativ wurde ein Zinkmangel in 42.5% der Patienten beobachtet. Gründe hierfür waren einerseits Malcompliance zu der Supplementation, andererseits aber auch eine stark reduzierte Zinkabsorption. Die fraktionierte Zinkabsorption nimmt nach Bypass von 32.3% präoperativ auf 13.6 % 6 Monate postoperativ und 21% 12 Monate postoperativ ab. Bei den regelmässigen Laborkontrollen ist aus diesem Grund auch ein Zinkspiegel als Marker für die Versorgung an Spurenelementen zu bestimmen. Es bleibt zu beachten, dass der Zinkspiegel im Serum eine unzuverlässige Methode zur Diagnose eines Zinkmangels ist, da nur 0.1% des gesamten Zinkgehaltes im Serum gelöst vorkommen und die Zinkserumkonzentration auch von einer Akute-Phase-Reaktion beeinflusst werden kann (5).
Ein besonderes Augenmerk verdient der Vitamin-B1-Mangel. Die Speicher an Vitamin B1 sind klein, weshalb bei ungenügender Zufuhr und rezidivierendem Erbrechen bereits nach ca. 2 Wochen ein Vitamin-B1-Mangel vorliegen kann. Die klassische Wernicke Trias mit Gangataxie, Augenmuskelparesen und Verwirrtheit ist nicht immer vollständig vorhanden, ein unbehandelter Vitamin-B1-Mangel kann aber irreversible neurologische Ausfälle verursachen. Bei Verdacht auf das Vorliegen eines Vitamin-B1-Mangels ist deshalb die entsprechende Behandlung (Thiamin 100 mg iv) bereits vor Vorliegen des Laborresultates einzuleiten (6).
Makronährstoffmängel
Eine ausführliche Ernährungsinstruktion nach bariatrischer Operation ist unerlässlich, wobei die Proteinzufuhr besonders zu beachten ist, da bei ungenügender Zufuhr ein überdurchschnittlicher Muskelmassenverlust zu befürchten ist. Ziel ist eine Proteinzufuhr von 1 g Protein/KG Normalgewicht. Die Einnahme von Protein-
shakes ist in den ersten Monaten postoperativ meist notwendig, um dieses Ziel zu erreichen und den Bedarf decken zu können. Vor allem nach Operationen mit verstärkter Malabsorption kann auch Jahre nach der Operation eine schwere Proteinmangelernährung mit Kraftverlust, chronischer Diarrhoe und generalisierten Ödemen auftreten. Im Labor findet sich häufig eine Hypalbuminämie. Therapeutisch ist eine hochdosierte Proteingabe indiziert, was je nach klinischer Situation durch Anreicherung der Speisen, Proteinsupplemente, in schweren Fällen auch durch Sondengabe oder ggf. parenteral erfolgen muss (4).
Gastrointestinale Symptome nach bariatrischen Operationen
Gastrointestinale Symptome nach bariatrischen Operationen sind häufig, am häufigsten sind mit Auftreten mehr als 1x/Woche Diarrhoe bei 23% der Patienten, Dumping bei 13%, Abdominalschmerzen bei 10%, Dysphagie bei 5%, Erbrechen bei 4%. Eine Häufigkeit von > 1x Monat wird angegeben für Diarrhoe bei 24% der Patienten, Dumping bei 27%, Abdominalschmerzen bei 15%, Erbrechen bei 15%, Dysphagie bei 7% (7).
Spezielle Ursachen für Schmerzen nach bariatrischen Operationen und das Dumpingsyndrom werden im Folgenden kurz erläutert.
Schmerzen
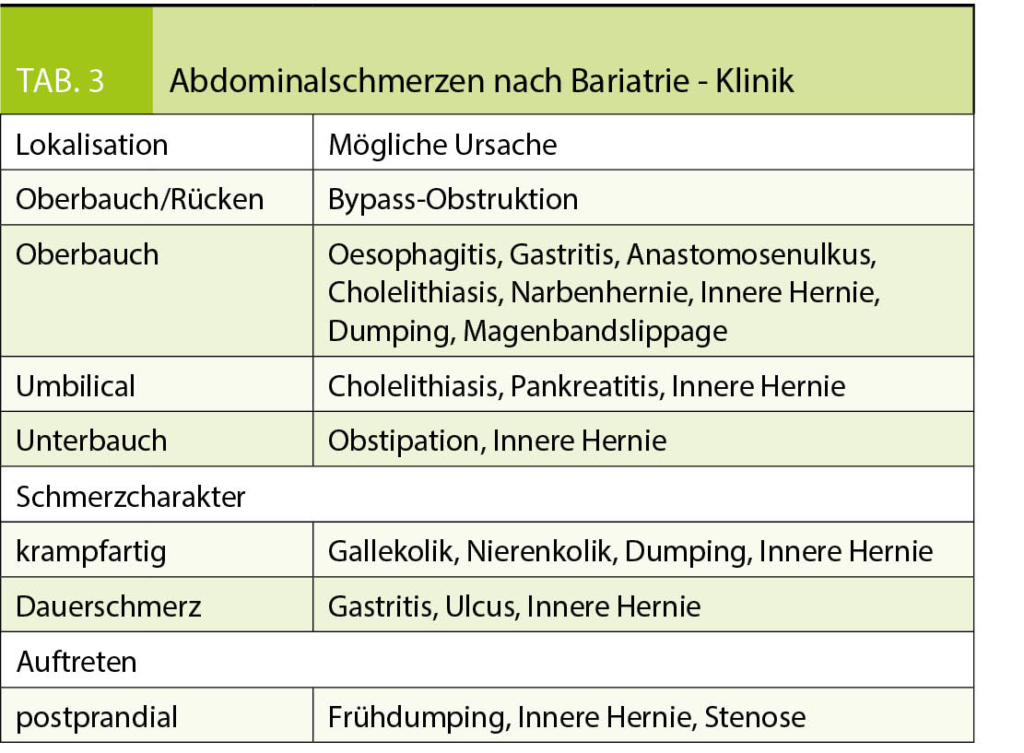
Die Ursache von Schmerzen ist vielfältig, in der Regel sind eine genaue Anamnese und die klinische Untersuchung hilfreich und richtungsweisend. Eine genaue Abklärung ist wichtig, um mögliche gravierende Komplikationen nicht zu verpassen. Tabelle 3 zeigt die Differentialdiagnose von Abdominalschmerzen nach bariatrischen Operationen.
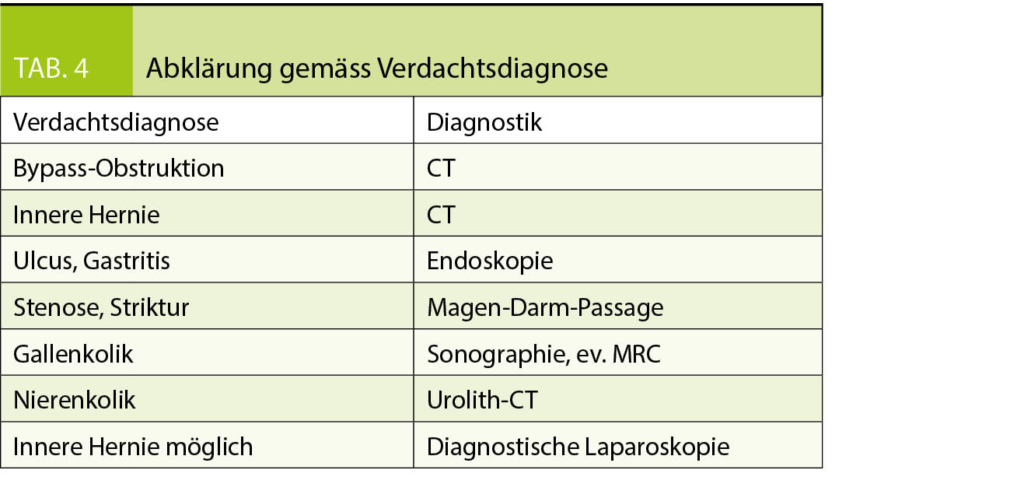
Aufgrund von Klinik und Anamnese ergibt sich eine Verdachtsdiagnose, welche den weiteren Abklärungsgang bestimmt (Tab 4).
Die gefährlichste Ursache für Abdominalschmerzen ist das Auftreten einer Obstruktion der ausgeschlossenen Dünndarmabschnitte mit Aufstau in den blind verschlossenen Magen, der sogenannten Bypass-Obstruktion. Dabei verspüren die Patienten starke Übelkeit, können aber nicht erbrechen, dazu Oberbauch- oder Rückenschmerzen. Die Patienten sind extrem unter Stress und entsprechend tachykard. Die Diagnose wird mittels CT Abdomen gestellt, ein unauffälliges, konventionelles Abdomen-Röntgenbild kann wegen z.T. fehlender Luft-Flüssigkeitsspiegel falsch negativ ausfallen. Rasches chirurgisches Handeln ist hier angesagt. Eine viel häufigere Ursache für Abdominalschmerzen sind innere Hernien. Diese Komplikation wird durch Abnahme des mesenterialen Fettes begünstigt und tritt deshalb meist erst nach relevanter Gewichtsabnahme auf. Eine Dünndarmschlinge herniert durch Mesenteriallücken, entweder zwischen Mesocolon Transversum und dem Meso der hochgezogenen Jejunalschlinge, dem sogenannten «Petersen» Space, oder auf Höhe der Fusspunktanastomose, was zu Dünndarmobstruktion und Dünndarmischämie führen kann. Die typische Klinik sind starke Schmerzen im Epigastrium oder Mittelbauch mit Exazerbation postprandial, z.T. Erbrechen, initial häufig krampfartig, im Verlauf kann ein Dauerschmerz auftreten. Eine innere Hernie kann sich aber auch atypisch, d.h. lediglich mit intermittierenden Schmerzen präsentieren. Die Häufigkeit wird in der Literatur mit ca. 2.5 – 10% angegeben (8). Zur Abklärung ist das CT Abdomen hilfreich, wobei hier besonders auf eine Rotationskomponente der Mesenterialgefässe («whirl sign») zu achten ist. Eine zeitnahe chirurgische Sanierung durch einen in Bariatrie erfahrenen Chirurgen ist indiziert.
Magenschleimhautulcera werden in Früh- und Spätulcera eingeteilt (9). Meist sind die Ulcera im Bereich der Anastomose lokalisiert. Die Frühulcera treten bis 10 Monate postoperativ auf. Ursächlich liegt am ehesten eine Ischämie oder Entzündung vor. Risikofaktoren für die Entwicklung eines Spätulcus sind Säurekontakt im Jejunum, z.B. durch eine Pouchvergrösserung, Nikotin-
abusus, die Einnahme von NSAR und ein Diabetes mellitus. Die typische Klinik der Ulcera besteht in starken epigastrisch lokalisierten Schmerzen während dem Essen. Zur Abklärung ist eine Endoskopie durchzuführen, die Therapie besteht in der Behandlung mit Protonenpumpeninhibitor (PPI) über Monate. In einer Studie wurde gezeigt, dass lösliche Formulierungen, d.h. geöffnete Kapseln, bzw. lösliche Formulierungen zu einer rascheren Abheilung der Ulcera führen als ungeöffnete Kapseln (10). Ein Helicobacter-
pylori-Befall, ev. auch eine Persistenz trotz präoperativer Eradikation, soll gesucht und bei Vorliegen behandelt werden. Nikotinabstinenz ist dringend zu empfehlen.
Dumping
Ein häufiges Symptom nach Magenbypass ist das Auftreten einer Dumpingsymptomatik. Wir unterscheiden Früh- und Spätdumping. Die pathophysiologischen Mechanismen des Dumpingsyndroms sind nicht abschliessend geklärt. Ein möglicher Mechanismus für das Auftreten ist aber eine rasche Entleerung der Magenpouch. Das schnelle Übertreten von hochosmolaren Speisen, insbesondere isolierten Kohlehydraten in die hochgezogene Jejunalschlinge löst einen Einstrom von Flüssigkeit ins Darmlumen und somit Hypotonie, z.T. bis zum Kollaps, Schwindel, Müdigkeit, auch Krämpfe und Diarrhoe aus. Dieses Frühdumping tritt 0 – 30 Minuten postprandial auf. Das Spätdumping manifestiert sich 90 – 120 Minuten nach einer kohlehydrathaltigen Mahlzeit und entsteht durch eine überschiessende Insulinantwort auf die hohe Konzentration von Kohlehydraten im Dünndarm, was zu einer Hypoglykämie mit den klassischen Symptomen, nämlich Schwitzen, Zittern, Sehstörungen und Konzentrationsstörungen führt.
Bei unklaren Symptomen ist das Führen eines Ess- und Beschwerde protokolls mit Blutzuckermessung hilfreich. Bei Unklarheit kann auch eine CGM (continuous glucose monitoring) hilfreich sein. Therapeutisch ist in erster Linie das Einhalten der Ernährungsempfehlungen sehr wichtig (keine reinen Kohlehydratmahlzeiten, Essen-Trinkabstand von 30 Minuten einhalten, regelmässige kleine Mahlzeiten, Steigerung der Faserzufuhr, ev. lösliche Fasern, z.B. Optifiber®). Besteht die Symptomatik dennoch weiter, so kann eine medikamentöse Therapie mit Acarbose zur Stabilisierung des Blutzuckers versucht werden, in therapieresistenten Fällen wird auch die Anwendung von Liraglutid oder Octreotid empfohlen. Bei ungenügender Gewichtsreduktion und Dumpingsymptomatik kann die Einlage eines Silikon-Ringes um den Magenpouch herum, eines sog. Fobi-Ringes, diskutiert werden. Dieser führt zu vermehrter Restriktion, langsamerer Entleerung des Pouches und somit zu einer Verbesserung der Dumpingsymptome. Bei therapieresistentem Dumping und überdurchschnittlicher Gewichtsabnahme ist gemäss Expertenmeinung die Gabe von kontinuierlicher Sondennahrung via Gastrostomie-Katheter in den ausgeschlossenen Magen eine therapeutische Option. Als letzte therapeutische Option kommt eine Reversion der Bypassoperation in Frage, allerdings sollten zuvor seltene Differentialdiagnosen für Hypoglykämien, wie das Vorliegen eines Insulinoms oder eine Nebenniereninsuffizienz, ausgeschlossen werden. Auch Medikamente, vor allem Venlafaxin können das Auftreten von Hypoglykämien verstärken.
Leitende Ärztin Innere Medizin / Endokrinologie
Ernährungszentrum St. Claraspital/Bariatrisches Referenzzentrum Clarunis
Lukas Legrand-Strasse 4
4058 Basel
martina.gebhart@claraspital.ch
Die Autorin hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Sjöström L. A Review of the key results from the Swedish Obese Subjects (SOS) trial – a prospective controlled intervention study of bariatric surgery. J Intern Med 2013;273:219-234.
2. Mechanick JI, Kushner RF, Sugerman HJ et al, American Association of Clinical Endocrinologists, Obesity Society, American Society for Metabolic and Bariatric Surgery, American Association of Clinical Endocrinologists, The Obesity Society, American Society for Metabolic and Bariatric Surgery. Medical guidelines for clinical practice for the perioperative nutritional, metabolic, and nonsurgical support of the bariatric surgery patient. Obesity 2009;17(Suppl 1):1-70.
3. Mechanick JI et al. Clinical practice guidelines for the perioperative nutritional, metabolic and nonsurgical support of the bariatric surgery patient – 2013 update: Cosponsored by american association of clinical endocrinologists, the obesity society and American society for metabolic & bariatric surgery. Endo Pract 2013;19:337-72.
4. Busetto L, Dicker D, Azran C. Practical recommendations of the Obesity Management Task Force of the European Association for the Study of Obesity for the post-bariatric surgery medical management. Obes Facts 2017;10:597-632.
5. Sallé A, Demarsy D, Poirier AL. Zinc deficiency: a frequent and underestimated complication of bariatric surgery. Obes Surg 2010;20:1660-70
6. Aasheim ET. Wernicke encephalopathy after bariatric surgery: a systematic review. Ann Surg 2008; 248: 714.
7. Edholm et al. Long-term results 11 years after primary gastric bypass in 384 patients. Surg Obes Rel Dis 2013;9:708-713.
8. Iannelli A, Facchiano E, Gugenheim J. Internal hernia after laparoscopic Roux-en-Y gastric bypass for morbid obesity. Obes Surg. 2006;16:1265-71.
9. Csendes A, Burgos AM, Altuve J et all. Incidence of marginal ulcer 1 month and 1 to 2 years after gastric bypass: A prospective consecutive endoscopic evaluation of 442 patients with morbid obesity. Obes Surg 2009;19:135-138.
10. Schulman AR, Chan WW, Devery A et all. Opened proton pump inhibitor capsules reduce time to healing for marginal ulcer after Roux-en-Y-Gastric Bypass. Clin Gastrol and Hepatol 2017;15:494-500.