Langzeitergebnisse der ASAP-Studie: Nicht der Remissionsstatus, sondern das Krankheitsrisiko bestimmt die Transplantationsergebnisse bei AML
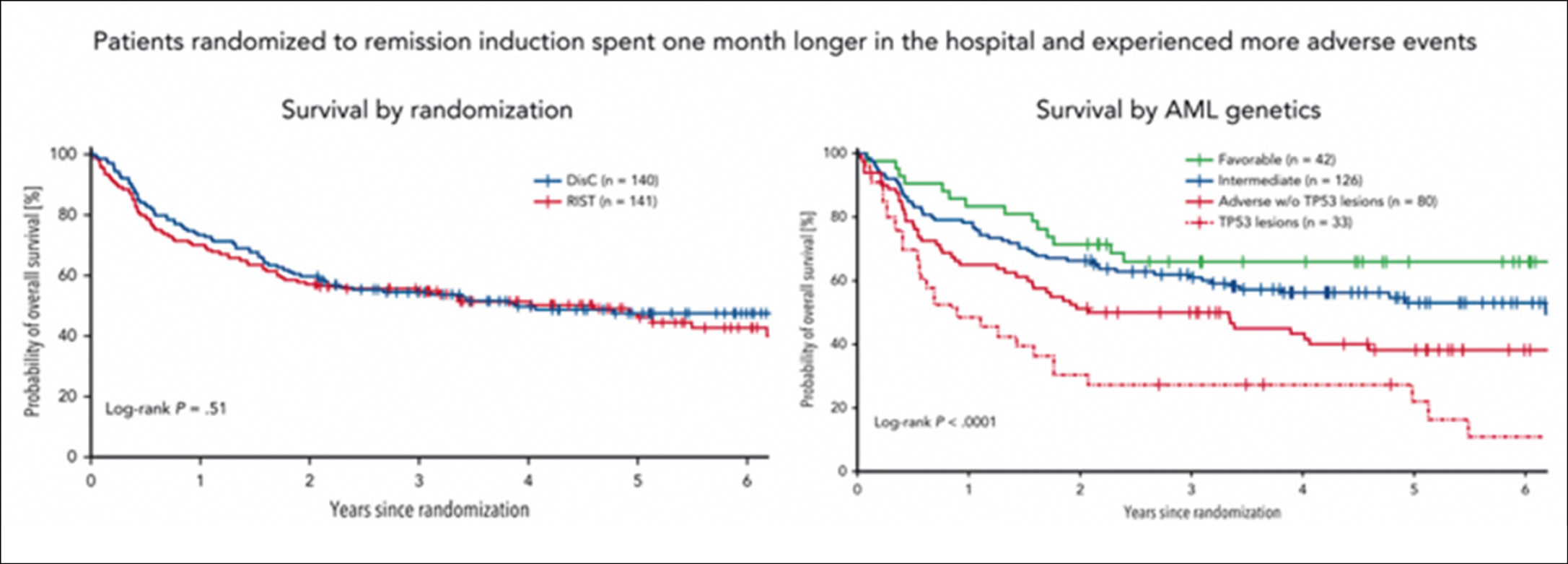
Bislang galt, dass eine allogene Stammzelltransplantation bei Patienten mit akuter myeloischer Leukämie (AML) kurativ sein kann – aber nur, wenn die AML zuvor in Remission gebracht werden konnte. Oft werden Patienten abgelehnt, wenn diese Remission nicht erreicht werden kann. In der vorliegenden Studie wurden Patienten mit AML, bei denen keine Remission erreicht werden konnte oder die ein Rezidiv hatten, randomisiert zwischen RIST (Remissions induzierendes Salvage-Treatment) und einer sofortigen allogenen Stammzelltransplantation mit sequenzieller Konditionierung, d. h. einer aplasierenden Chemotherapie, gefolgt von einer Stammzelltransplantation. Insgesamt wurden 281 Patienten multizentrisch eingeschlossen. Das 5-Jahres-Überleben betrug 46,1 % (Soforttherapie) vs. 47,5 % (RIST) in beiden Gruppen. In dieser Langzeitanalyse wurde gezeigt, dass die genetische ELN-Risikogruppe (European Leukemia Net) und in geringerem Umfang Komorbiditäten, jedoch nicht die Studienarmallokation, mit dem Langzeitüberleben assoziiert waren.
Quelle
Matthias Stelljes, et al. on behalf of the Study Alliance Leukemia and the German Cooperative Transplant Study Group
BLOOD 2025; 146(19):2293-2305
Allogene CD19-CAR-T-Zellen bei Erwachsenen mit B-ALL: Wirksamkeit, Toxizität und Stellenwert der Lymphodepletionschemotherapie
Bei der akuten lymphoblastischen Leukämie vom B-Zell-Typ haben sich CD19-gerichtete CAR-T-Zelltherapien etabliert. Dabei handelt es sich um autologe Produkte, die aus den T-Lymphozyten des Patienten gewonnen werden. Ihre Wirksamkeit ist gut, aber nicht hervorragend. In dieser Studie wurden allogene CD19-CAR-T-Zellen untersucht. Diese wurden bei Patienten mit Rückfall nach allogener Stammzelltransplantation im Sinne einer Spenderlymphozytentransfusion angewendet, jedoch mit dem zusätzlichen, transfizierten CD19-chimären Antigenrezeptor. Es wurden zwei Fragen untersucht: die Wertigkeit einer präinfusionellen lymphodepletierenden Therapie und die wiederholte Gabe der CAR-T-Zellen. 14 Patienten (im Durchschnitt 43 Jahre alt) wurden behandelt. Die Blastenlast betrug 50,5 %. Die ersten sieben Patienten erhielten CAR-T-Zellen allein, die Patienten 8–14 erhielten vor der CAR-T-Verabreichung eine lymphodepletierende Therapie mit Fludarabin und Cyclophosphamid. Das Ansprechen und die Expansion der CAR-T-Zellen waren wesentlich höher (ca. 20-fach) nach der lymphodepletierenden Therapie und die CAR-T-Persistenz war länger (197 vs. 32 Tage). Die Patienten nach der lymphodepletierenden Therapie hatten ein besseres PFS und OS (57 % vs. 29 %; 83 % vs. 29 %). Eine Wiederholung der CAR-T-Therapie war nicht wirksam.
Quelle
Claire Roddie, et al. Blood. 2025 Oct 2;146(14):1664-1676
Ibrutinib in der Erstlinie der CLL/SLL: Ergebnisse nach bis zu zehn Jahren Follow-up aus RESONATE-2
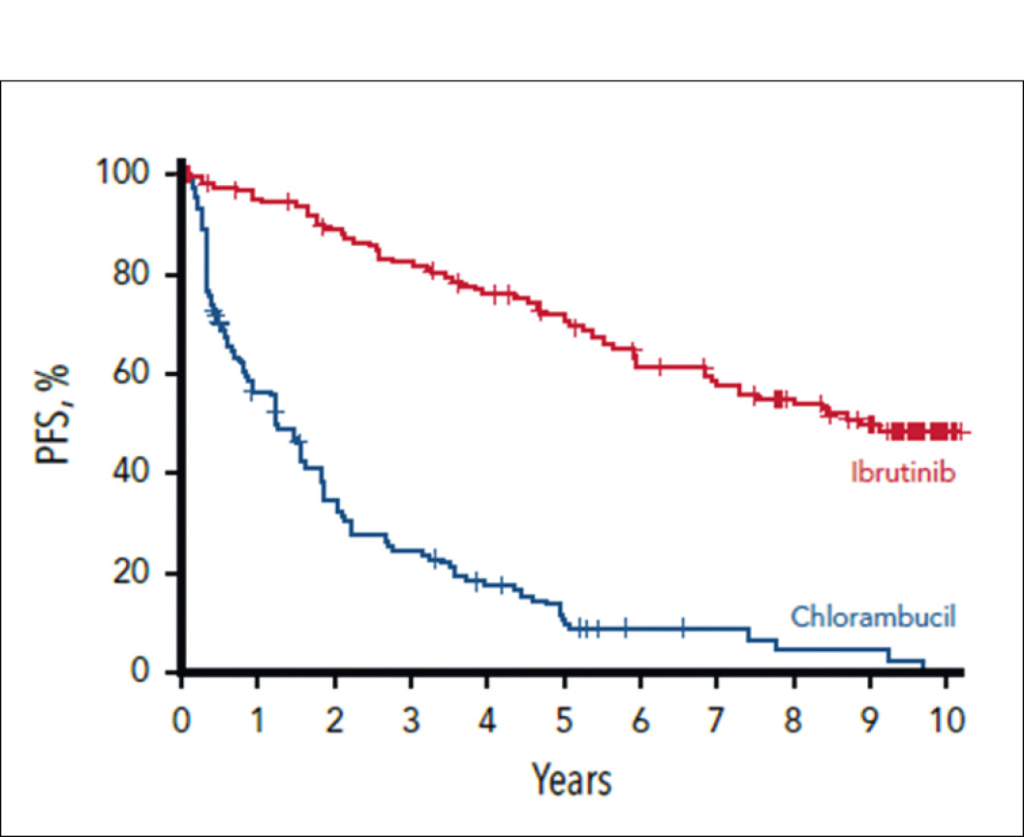
Die RESONATE-2-Studie verglich bei Patienten mit chronisch lymphatischer Leukämie (CLL) den BTK-Inhibitor der ersten Generation Ibrutinib mit Chlorambucil. Über diese Studie wurde erstmals 2017 berichtet. Die finale Analyse dieser Daten zeigt einen anhaltenden PFS- und Überlebensvorteil von Ibrutinib. Von besonderem Interesse an dieser Langzeitstudie sind die Langzeitverträglichkeit, die durch Dosisreduktion (25 % der Patienten) verbessert werden konnte, sowie die Langzeitwirksamkeit. Ursprünglich wurden Patienten, die älter als 65 Jahre waren und an bisher unbehandelter CLL litten, in die Studie eingeschlossen. Das progressionsfreie Überleben (PFS) betrug 8,9 Jahre im Ibrutinib-Arm vs. 1,3 Jahre im Chlorambucil-Arm. Das 9-Jahres-Überleben (OS) betrug 68 %. Die häufigsten Nebenwirkungen waren Diarrhö, Husten, Nausea, Arthralgien, Ödeme und Hypertonie. Zum Studienende nahmen 27 % der Patienten immer noch Ibrutinib ein. Diese Daten stellen Ibrutinib ein gutes Langzeitzeugnis aus. Neue BTK-Inhibitoren, nichtkovalente BTK-Inhibitoren und die noch neuere Generation der BTK-degradierenden Substanzen werden sich daran messen lassen müssen.
Quelle
JA Burger et al. BLOOD 2025; 146 (18): 2169-76
Ropeginterferon alfa-2b als wirksame Zweitlinie bei Hydroxyurearefraktärer Essentieller Thrombozythämie (ET): Ergebnisse der SURPASS-ET-Studie
Zu den myeloproliferativen Neoplasien gehören die essenzielle Thrombozythämie (ET), die Polyzythämie vera (PV) und die primäre Myelofibrose (PMF). Pegyliertes Interferon ist bereits für die Behandlung der PV zugelassen. In der SURPASS-ET-Studie wurde Ropeginterferon alfa-2b bei Patientinnen und Patienten mit behandlungsbedürftiger, hochrisikobewerteter ET untersucht, die auf Hydroxyurea nicht angesprochen hatten oder diese nicht vertrugen. Eingeschlossen wurden ET-Patienten mit begleitender Leukozytose nach Versagen oder Intoleranz gegenüber Hydroxyurea. In der randomisierten, offenen Phase-III-Studie erhielten sie entweder Ropeginterferon alfa-2b (subkutan alle zwei Wochen) oder Anagrelid (oral). Primäres Ziel war das Erreichen einer ELN-Response nach 9 und 12 Monaten Therapie.
Von 245 gescreenten Patienten wurden 174 in die Studie aufgenommen. Die Ansprechrate, definiert nach ELN-Kriterien, betrug 43 % im Ropeginterferon-alfa-2b-Arm gegenüber 6 % im Anagrelid-Arm. Nebenwirkungen ≥ Grad III traten bei 34 % der mit Anagrelid und bei 23 % der mit Interferon behandelten Personen auf. Die häufigsten unerwünschten Ereignisse waren Infektionen. Ropeginterferon alfa-2b erwies sich damit in dieser Studie als wirksame und besser verträgliche Zweitlinientherapie im Vergleich zu Anagrelid.
Quelle
Lancet Hematology 12(11): e862-e875 November 2025
Ruben Mesa et al the SURPASS-ET Study Group
Sequenzielle Therapie beim Multiplen Myelom: Talquetamab als Brückentherapie vor BCMA-CAR-T-Zellen
Für Patienten mit fortgeschrittenem Plasmazellmyelom stehen verschiedene Therapien zur Verfügung. Von einer BCMA-gerichteten CAR-T-Therapie verspricht man sich besonders langfristige Remissionen. Nach dem Versagen verschiedener Therapielinien können bispezifische Antikörper als Brücke zur CAR-T-Therapie dienen. Von Interesse sind zwei bispezifische Antikörper: Teclistamab adressiert ebenfalls BCMA und Talquetamab GPRC5D. Hier stellt sich die Frage, ob für die Überbrückung eine gleiche oder eine unterschiedliche Zielstruktur verwendet werden soll, bevor anschliessend eine CAR-T-Therapie erfolgt. Dies ist eine Beobachtungsstudie, die Daten von 20 Zentren ausgewertet hat. Von den 134 mit Talquetamab behandelten Patienten erhielten 119 anschliessend eine BCMA-CAR-T-Behandlung. 15 Patienten erhielten keine CAR-T-Therapie aufgrund von Progression, Herstellungsversagen oder Patientenentscheid. Die Patienten waren im Median 65 Jahre alt und hatten fünf Behandlungslinien hinter sich. Die CRS- und ICANS-Nebenwirkungen nach CAR-T waren meist mild. Unter Talquetamab erreichten 71 % der Patienten ein Ansprechen, nach CAR-T waren es 88 %. Die Autoren schliessen daraus, dass Talquetamab eine wirksame Überbrückungstherapie vor CAR-T ist.
Quelle
Binod Dhakal et al, Blood. 2025 Oct 23;146(17):2063-2072
Klinik für Hämatologie
Hämatologische Diagnostik Labormedizin
Universitätsspital Basel und Blutspendezentrum beider Basel SRK
Petersgraben 4
4031 Basel