Hypertensive Notfälle (HN) sind durch einen deutlichen Anstieg des Blutdrucks (BD) in Verbindung mit einer akuten Zielorganschädigung (ZOS) gekennzeichnet, die eine schnelle und kontrollierte Blutdrucksenkung erfordern. Sie müssen von schwerer arterieller Hypertonie (AHT) ohne ZOS unterschieden werden, die in akuten Situationen häufig auftritt und oft kontextabhängig ist und keine sofortige intravenöse Behandlung erfordert. Die Erstuntersuchung basiert auf der Bestätigung der AHT, der Identifizierung klinischer oder paraklinischer Anzeichen einer ZOS und der Suche nach einem auslösenden Faktor. Die Behandlung der HN umfasst eine titrierbare intravenöse Therapie, die an den klinischen Kontext angepasst ist, sowie eine kontinuierliche hämodynamische Überwachung. Im Gegensatz dazu wird eine schwere, unkomplizierte AHT meist ambulant mit oraler Medikation und engmaschiger Überwachung behandelt. Dieser Artikel bietet eine praktische Zusammenfassung der aktuellen europäischen und nordamerikanischen Empfehlungen.
Hypertensive emergencies (HE) are characterized by a significant increase in blood pressure (BP) in conjunction with acute target organ damage (AOTD), which requires rapid and controlled BP reduction. They must be distinguished from severe arterial hypertension (AH) without ZOS, which often occurs in acute situations and is often context-dependent and does not require immediate intravenous treatment. The initial examination is based on confirmation of AH, identification of clinical or paraclinical signs of ZOS, and search for a triggering factor. Treatment of HN includes titratable intravenous therapy tailored to the clinical context and continuous hemodynamic monitoring. In contrast, severe uncomplicated AH is usually treated on an outpatient basis with oral medication and close monitoring. This article provides a practical summary of current European and North American recommendations.
Keywords: Hypertensiver Notfall, Schwere Hypertonie, Zielorganschädigung (ZOS), Intravenöse Blutdrucksenkung
Einführung
Arterielle Hypertonie (AHT) ist weltweit der wichtigste veränderbare Risikofaktor für kardiovaskuläre Morbidität und Mortalität (1). In akuten Situationen kann ein starker Anstieg des Blutdrucks (BD) zu einer Schädigung von Zielorganen (ZOS) – Gehirn, Herz, Nieren, Augen, Gefässe oder Blut – führen oder diese verschlimmern, was kurzfristig lebensbedrohlich sein kann.
Diese Situationen, die unter dem Begriff hypertensive Notfälle (HN) zusammengefasst werden, erfordern eine sofortige Behandlung im Krankenhaus mit einer intravenösen blutdrucksenkenden Therapie, die auf die Ätiologie und den klinischen Kontext abgestimmt ist. Sie müssen von schweren Blutdruckanstiegen ohne ZOS unterschieden werden, die eine nicht dringende Therapieoptimierung erfordern und nicht unbedingt einen längeren Krankenhausaufenthalt notwendig machen. Die schnelle Erkennung eines akuten Koronarsyndroms, die Interpretation des Kontextes und die Beherrschung der Empfehlungen sind unerlässlich, um sowohl Behandlungsverzögerungen als auch potenziell schädliche, unangebrachte Eingriffe zu vermeiden.
Definition
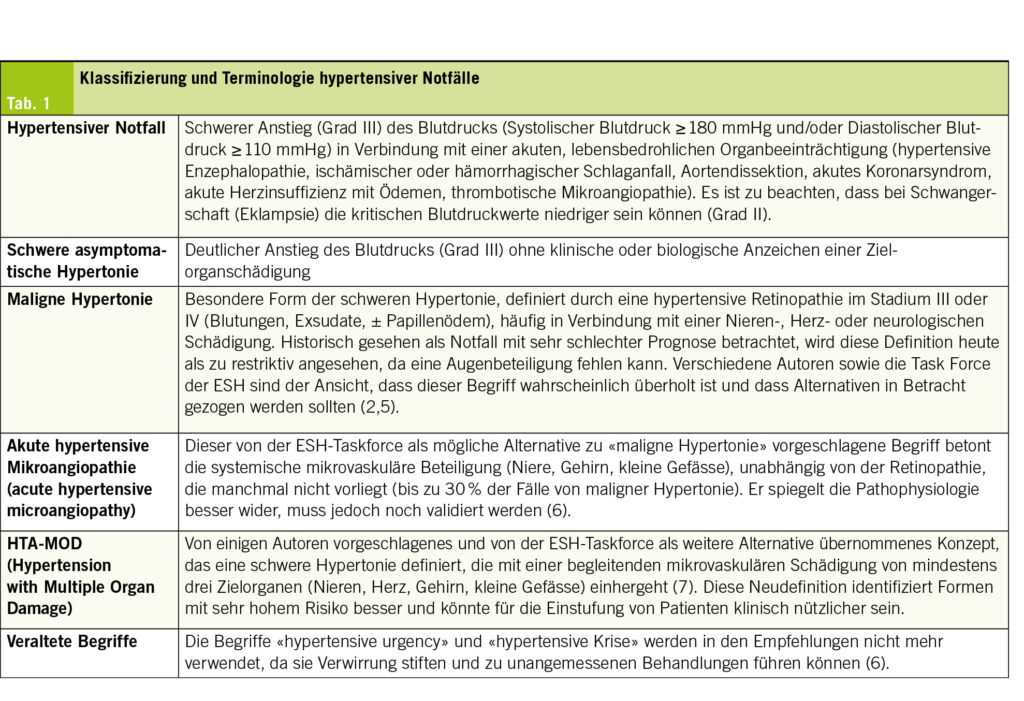
Die Klassifizierung schwerer Blutdruckanstiege basiert auf dem Vorliegen oder Nichtvorliegen einer organischen Schädigung. Die aktuellen Empfehlungen verschiedener Fachgesellschaften betonen die Abschaffung bestimmter historischer Begriffe, die zu Verwirrung führen, und die Einführung einer standardisierten Terminologie, die in Tab. 1 dargestellt ist (2–4).
Epidemiologie
Weltweit sind etwa 1.3 Milliarden Erwachsene von Bluthochdruck betroffen, wobei die Blutdruckkontrolle insgesamt sehr unzureichend ist: Fast die Hälfte der Patienten weiss nichts von ihrer Erkrankung, weniger als jeder Zweite wird behandelt und nur 20 % erreichen die therapeutischen Ziele (8). Diese ohnehin schon hohe Prävalenz dürfte mit der Alterung der Bevölkerung und der Veränderung der Lebensgewohnheiten weiter zunehmen.
In der klinischen Praxis machen schwere Blutdruckerhöhungen 4 bis 5 % der Gründe für Notaufnahmen aus (9). Echte Notfälle, die bei bekannten Bluthochdruckpatienten häufiger auftreten, sind jedoch selten und machen nur etwa 0.6 % der Notaufnahmen aus (10). Im Laufe ihres Lebens erleben etwa 1–2 % der hypertensiven Patienten eine Episode von hypertensiver Krise (11). Dieser Anteil scheint seit mehreren Jahrzehnten stabil zu sein oder sogar zu steigen, während die Krankenhaussterblichkeit zurückgegangen ist, was die Fortschritte in der Patientenversorgung widerspiegelt und heute je nach Serie zwischen 0.2 % und 11 % liegt (11–13). Der eingeschränkte Zugang zur Gesundheitsversorgung, anhaltende und unkontrollierte Hypertonie (sehr oft verbunden mit einer mangelnden Therapietreue) sowie bestimmte klinische Faktoren wie fortgeschrittenes Alter, männliches Geschlecht, chronische Niereninsuffizienz und vorbestehende kardiovaskuläre Erkrankungen sind die wichtigsten Risikofaktoren oder Faktoren für eine schlechte Prognose im Zusammenhang mit einer HN (14–16).
Pathophysiologie
Die Pathophysiologie der HN ist nach wie vor unzureichend charakterisiert. Sie ist das Ergebnis einer komplexen, multifaktoriellen Kette von Ereignissen, deren Hauptelemente wie folgt lauten: Die am weitesten verbreitete Hypothese basiert auf einem akuten Versagen der vaskulären Autoregulationsmechanismen, was zu einem plötzlichen Anstieg des systemischen Gefässwiderstands führt. Diese Kaskade führt zu diffusen mikrozirkulatorischen Läsionen, einer übermässigen Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS), einer ausgeprägten Vasokonstriktion sowie einer druckinduzierten Natriurese, was zu einem Volumenmangel führt. All dies ist Teil eines sich selbst verstärkenden Teufelskreises, der für einen raschen und anhaltenden Anstieg des Blutdrucks verantwortlich ist (17).
Im Gehirn führt eine längere Exposition gegenüber unkontrollierter Hypertonie zu einer strukturellen und funktionellen Umgestaltung der arteriellen Gefässwände, wodurch die obere Schwelle der Autoregulation auf höhere Werte verschoben wird. So können bestimmte Patienten einen deutlich über den physiologischen Werten liegenden mittleren Blutdruck ohne unmittelbare klinische Symptome tolerieren. Diese Anpassung, die mittelfristig unter Behandlung reversibel ist, stellt ein grosses Problem dar, da sie das Risiko einer Hypoperfusion und Ischämie bei einer zu schnellen Blutdrucksenkung, insbesondere im Gehirn und im Herzen, erklärt (18–21).
Diagnostische Beurteilung bei Vermutung eines hypertensiven Notfalls
Die Untersuchung eines Patienten mit stark erhöhtem Blutdruck (Hypertonie Grad III), sei es in der Arztpraxis oder in der Notaufnahme, muss unbedingt mit der Bestätigung beginnen, dass es sich tatsächlich um eine echte Hypertonie handelt. Tatsächlich kann ein schwerer Blutdruckanstieg aufgrund verschiedener kontextbezogener Faktoren wie technische Fehler bei der Blutdruckmessung, einer stressigen Umgebung, Schmerzen oder dem Weisskittel-Effekt häufig in akuten Situationen beobachtet werden (3). In der Notaufnahme treten solche Blutdruckanstiege häufig auf, und obwohl sie mit einem erhöhten langfristigen kardiovaskulären Risiko verbunden sind, stellen sie in den meisten Fällen keinen echten lebensbedrohlichen Notfall dar (22). Daten zeigen sogar, dass ein erheblicher Teil der in der Notaufnahme festgestellten Blutdruckerhöhungen nach 30 Minuten Ruhe spontan abklingt (23). Eine randomisierte Studie hat sogar gezeigt, dass eine zweistündige Ruhepause den Blutdruck um etwa 30 mmHg senkt, ein Ergebnis, das mit einer blutdrucksenkenden Behandlung vergleichbar ist (24). In Übereinstimmung damit haben kleinere Studien gezeigt, dass Anxiolytika wie Diazepam, aber auch Entspannungsmassnahmen (Achtsamkeit, langsame Atmung) ebenfalls den Blutdruck senken, was die Rolle von Stress und kontextbezogener Angst bei diesen Blutdruckanstiegen unterstreicht, obwohl dieses Thema weiterhin umstritten ist (25).
Aus diesen Gründen betonen die aktuellen Empfehlungen nachdrücklich die Notwendigkeit, die Messungen nach einer Ruhephase zu wiederholen, eine standardisierte Methodik (angepasste Manschette, korrekte Position, Patient seit ≥ 15 min in Ruhe) und, wenn möglich, eine automatisierte, unbeaufsichtigte Messung zu verwenden, um den Einfluss des Pflegepersonals zu begrenzen (2).
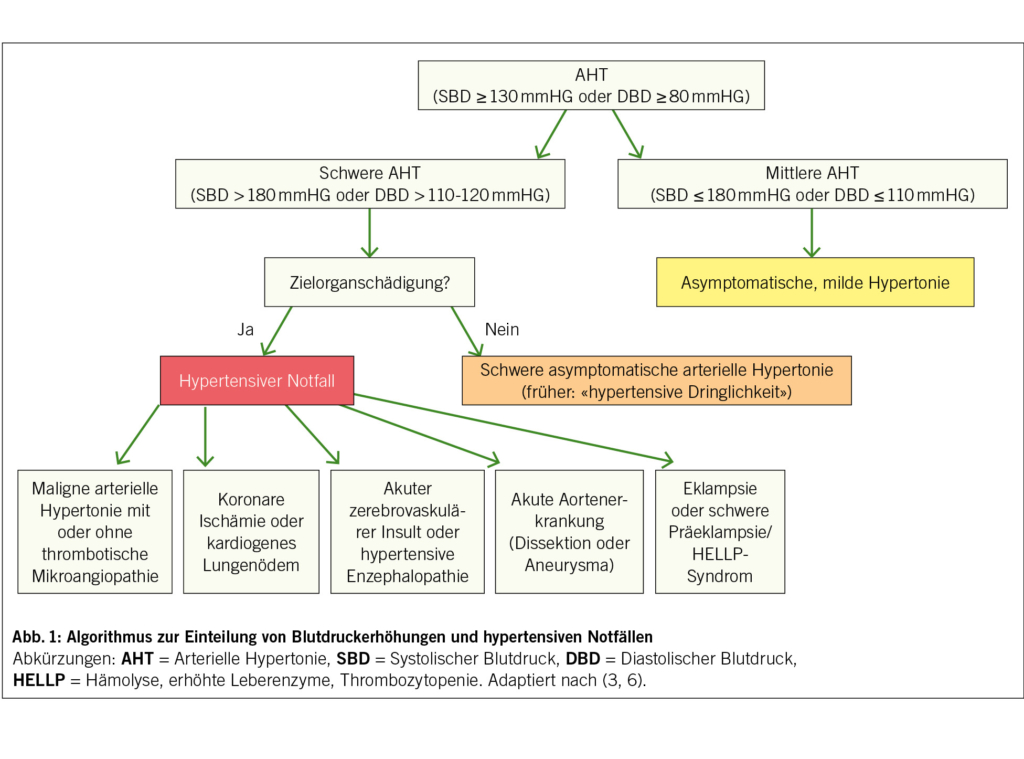
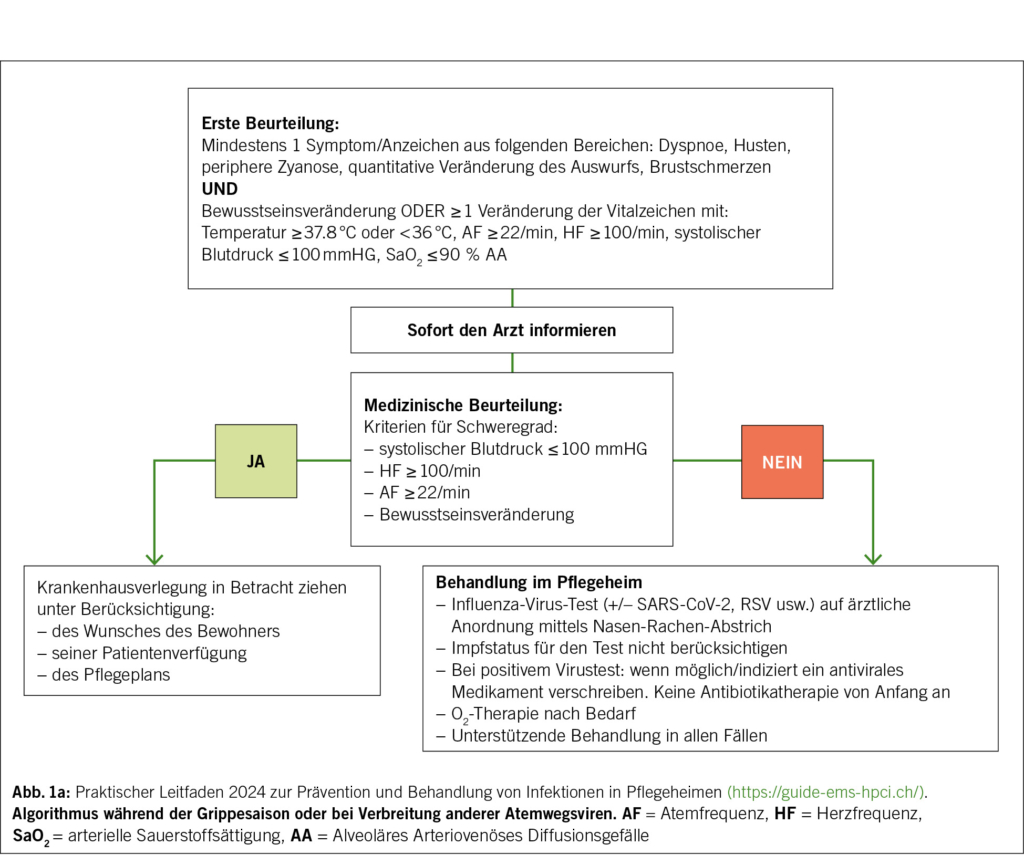
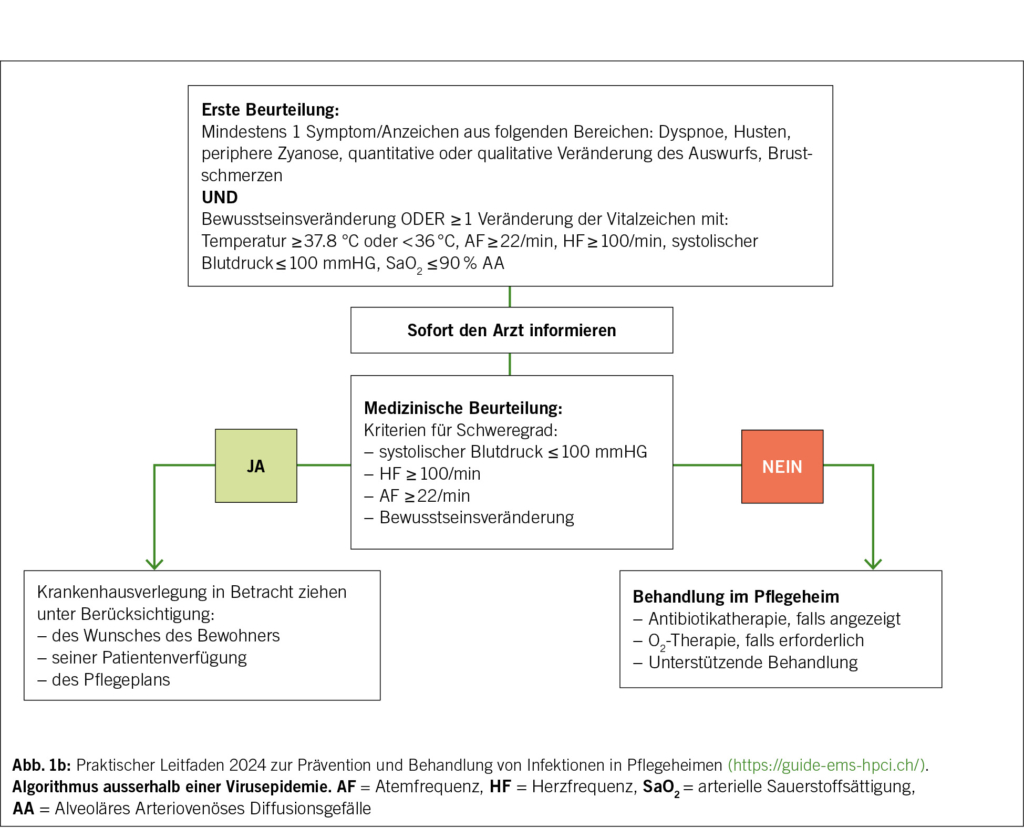
Sobald eine schwere und anhaltende Hypertonie bestätigt ist, besteht der zweite Schritt darin, eine echte HN von einer schweren Hypertonie ohne ZOS zu unterscheiden, was für die Behandlungsstrategie und die Prognose entscheidend ist (Abb. 1). Eine hypertensive Krise erfordert nämlich eine sofortige Krankenhausaufnahme, die Einleitung einer titrierbaren intravenösen blutdrucksenkenden Behandlung, die an die Art der hypertensiven Krise angepasst ist, sowie eine kontinuierliche hämodynamische Überwachung. Eine schwere Hypertonie ohne ZOS kann hingegen in den meisten Fällen ambulant behandelt werden, mit einer schrittweisen Senkung des Blutdrucks durch orale Medikation und einer engen Überwachung durch den behandelnden Arzt.
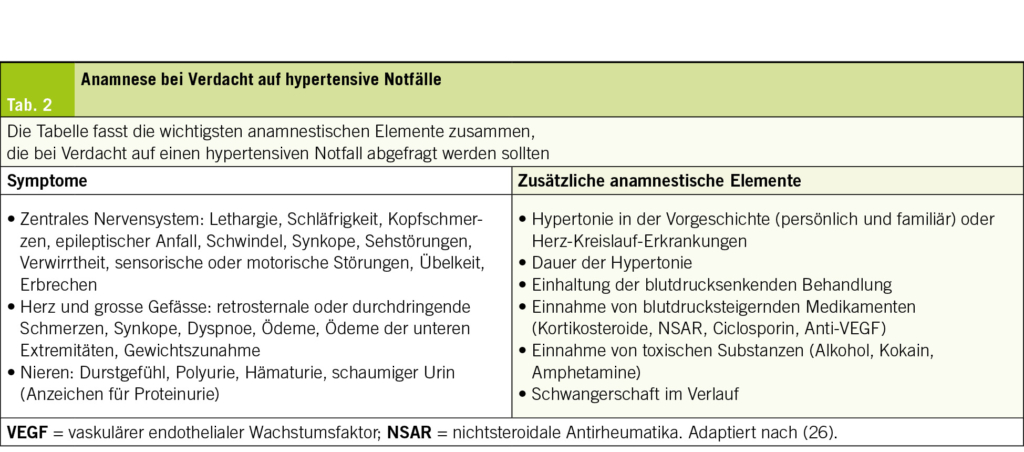
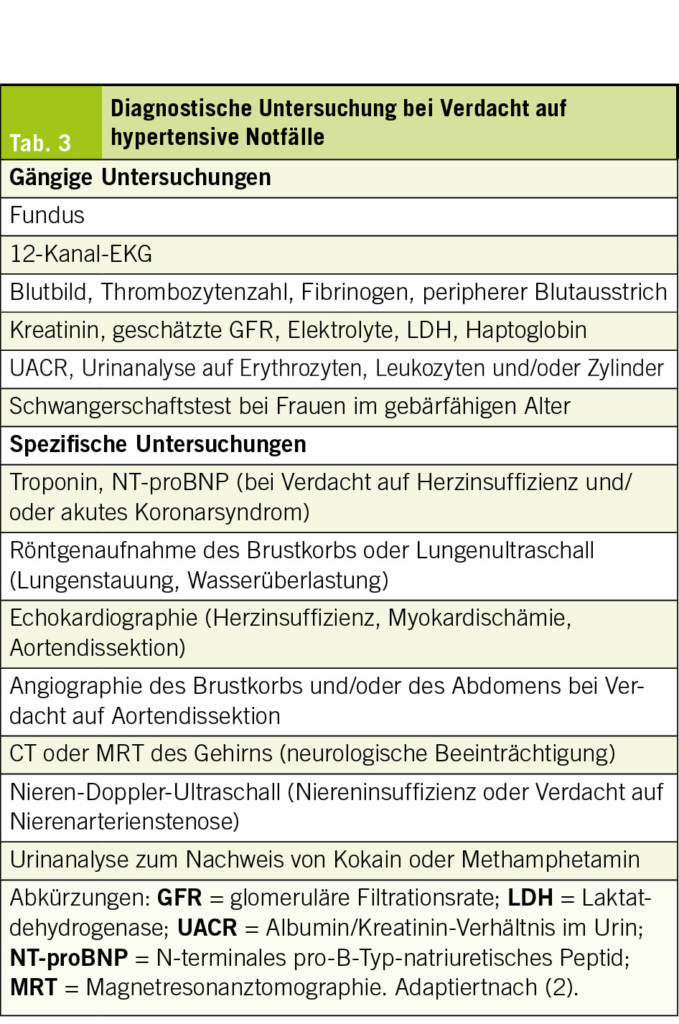
Zu diesem Zweck muss ein diagnostischer Ansatz verfolgt werden, der auf einer gezielten Befragung und einer systematischen klinischen Untersuchung basiert, um Anzeichen oder Symptome zu identifizieren, die auf eine neurologische, kardiovaskuläre, renale oder ophthalmologische Beeinträchtigung hindeuten. Die wichtigsten Elemente sind in Tab. 2 zusammengefasst. Es müssen auch dringende, dem Kontext angepasste Zusatzuntersuchungen durchgeführt werden, um eine ZOS zu bestätigen und eine auslösende Ursache zu identifizieren, deren Details in Tab. 3 dargestellt sind.
Behandlung von hypertensiven Notfällen
Allgemeine Grundsätze
Bei Vorliegen einer ZOS muss der Blutdruck in den meisten Fällen (ausser bei ischämischem Schlaganfall) schnell gesenkt werden, vorzugsweise intravenös mit titrierbaren Wirkstoffen (z. B. Labetalol, Nicardipin) und unter kontinuierlicher hämodynamischer Überwachung (Notaufnahme, Intermediate Care oder Intensivstation). Die Geschwindigkeit und das Ausmass der Senkung hängen vom Kontext ab: schnelle Senkung bei Lungenödem oder Aortendissektion, äusserste Vorsicht bei ischämischem Schlaganfall, individueller Ansatz bei intrakranieller Blutung (27). Wie oben erwähnt, muss bei diesen Behandlungen stets das Risiko einer Hypoperfusion aufgrund einer übermässigen Senkung berücksichtigt werden, was die Einhaltung der Prinzipien der zerebralen und renalen Autoregulation erfordert (19). Tatsächlich zeigen mehrere Studien, dass eine übermässige (> 50 % des mittleren Blutdrucks) und/oder zu schnelle Senkung des Blutdrucks, insbesondere in Situationen mit zentraler Beeinträchtigung (hypertensive Enzephalopathie oder ischämischer Schlaganfall), mit einem erhöhten Risiko für ischämischen Schlaganfall, Erblindung und Mortalität korreliert (28, 29).
Spezifische Behandlung je nach Art des hypertensiven Notfalls
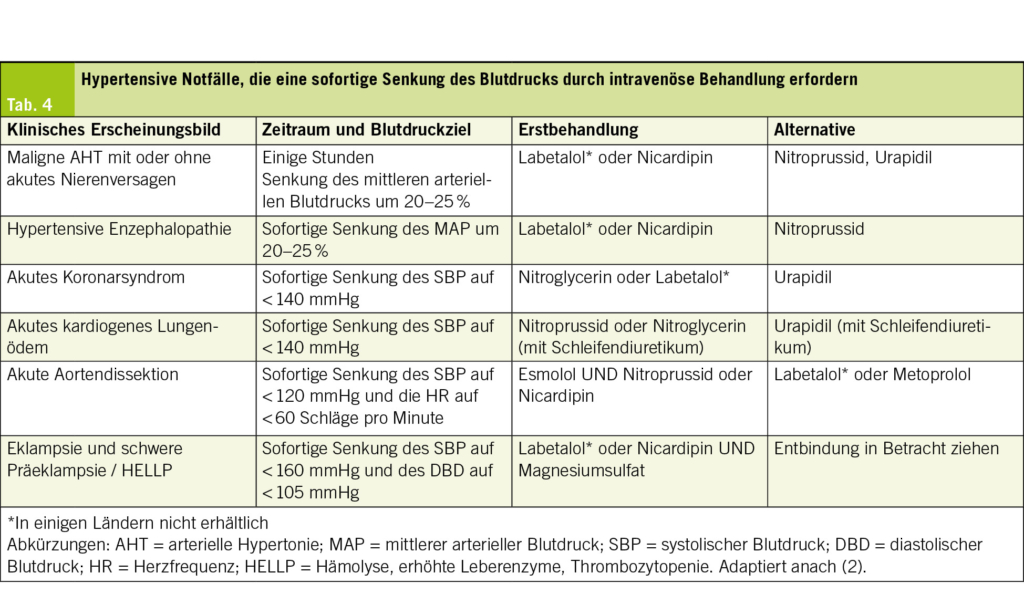
Tab. 4 fasst die empfohlenen Blutdruckziele und die Geschwindigkeit der Blutdrucksenkung je nach Art des hypertensiven Notfalls sowie die Erstlinienbehandlungen auf der Grundlage der neuesten Empfehlungen der Europäischen Gesellschaft für Hypertonie aus dem Jahr 2023 zusammen (2). Diese Elemente bilden die Grundlage für die Behandlung und ermöglichen es, die Therapie an jeden klinischen Kontext anzupassen.
Auswahl des Therapeutikums
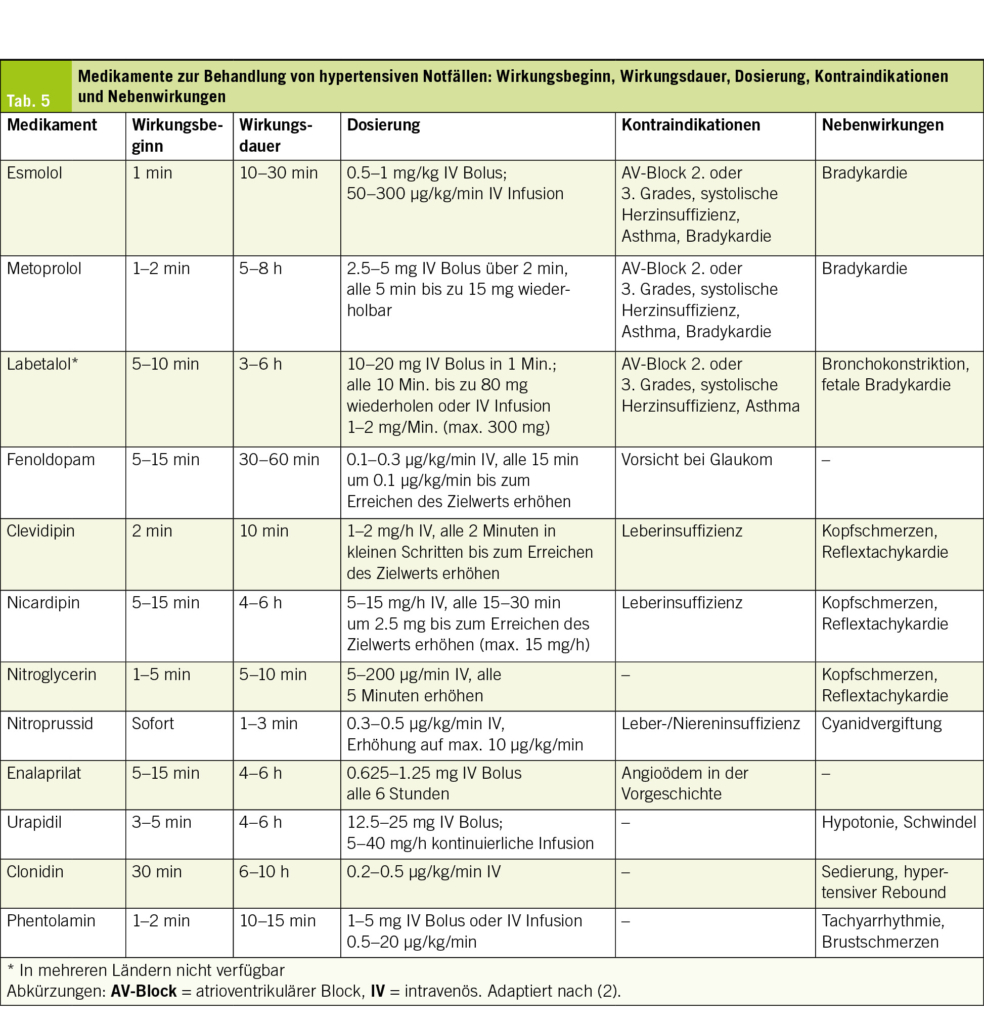
Die Wahl der blutdrucksenkenden Mittel hängt stark vom klinischen Kontext und der lokalen Verfügbarkeit ab. Am häufigsten wird Labetalol (α- und β-Blocker) verwendet, das oft als erste Wahl bevorzugt wird, insbesondere bei neurologischen Notfällen und Aortendissektionen, sowie Nicardipin, ein weit verbreiteter und gut verträglicher Kalziumkanalblocker, der auch bei Niereninsuffizienz eingesetzt werden kann. Weitere Optionen sind Esmolol (ein sehr kurz wirksamer β-Blocker), Nitroglycerin (insbesondere bei Lungenödem oder akutem Koronarsyndrom) oder Natriumnitroprussid, dessen Verwendung bei intrakranieller Hypertonie vermieden werden sollte, können je nach Indikation in Betracht gezogen werden. In der Praxis hängt die Auswahl des Wirkstoffs von der klinischen Situation, den Begleiterkrankungen, der Fachkompetenz des behandelnden Teams und den Überwachungsmöglichkeiten ab. Die pharmakologischen und praktischen Eigenschaften der einzelnen Wirkstoffe sind Tab. 5 zu entnehmen.
Behandlung von schwerer arterieller Hypertonie ohne akute Zielorganbeschwerden
Es ist wichtig, sich daran zu erinnern, dass unabhängig von einer akuten Schädigung eines Zielorgans eine Episode schwerer Hypertonie mit einer erhöhten langfristigen kardiovaskulären Mortalität einhergeht und nicht bagatellisiert werden darf (30). Darüber hinaus sind schwere Blutdruckerhöhungen in der Notaufnahme oder in der Arztpraxis sehr häufig und bieten eine einzigartige Gelegenheit, eine bisher unerkannte chronische Hypertonie zu erkennen, die bei fast der Hälfte der Patienten auftritt, die wegen eines schweren Blutdruckanstiegs die Notaufnahme aufsuchen (31). Nachdem eine hypertensive Krise ausgeschlossen wurde (siehe oben), besteht der zweite Schritt darin, die Wahrscheinlichkeit einer zugrunde liegenden chronischen Hypertonie zu beurteilen: Diese ist umso wahrscheinlicher, je länger der Blutdruckanstieg bei wiederholten Messungen in Ruhe, mit einer geeigneten Manschette und korrekter Positionierung, anhält. Es ist zu beachten, dass die Nichteinhaltung der verschriebenen blutdrucksenkenden Behandlung eine sehr häufige Ursache für schweren Bluthochdruck ist. Bei hoher Wahrscheinlichkeit einer chronischen zugrunde liegenden Hypertonie, insbesondere bei Patienten, bei denen eine Nachsorge unwahrscheinlich ist oder die keinen Hausarzt haben, sollte die Einleitung einer blutdrucksenkenden Behandlung in Betracht gezogen und eine engmaschige ambulante Nachsorge organisiert werden (17). Bei Patienten, die sich nicht an die Therapie halten, kann die Behandlung unter Berücksichtigung der Gründe für die Nicht-Compliance (Nebenwirkungen, Unverträglichkeit usw.) erneut begonnen werden. Eine enge Zusammenarbeit mit dem behandelnden Arzt innerhalb eines relativ kurzen Zeitraums ist dabei unerlässlich.
Wie oben erwähnt, gibt es in solchen Situationen in der Literatur keinen klar definierten Blutdruckgrenzwert, ab dem eine sofortige Senkung des Blutdrucks erforderlich wäre. Es scheint jedoch klar zu sein, dass eine schnelle Senkung des Blutdrucks in der Notaufnahme ohne akutes Koronarsyndrom keinen klinischen Nutzen hat und sogar schädliche Auswirkungen haben kann, indem sie die Durchblutung der Organe beeinträchtigt (32, 33). Dies wurde insbesondere mit sublingualem Nifedipin nachgewiesen, dessen Anwendung zu unvorhersehbaren, manchmal gefährlichen Blutdruckabfällen (Schlaganfall oder akute Erblindung) führt, ohne dass ein dokumentierter prognostischer Nutzen vorliegt. Ausserhalb geburtshilflicher Situationen (Präeklampsie/Eklampsie) wird seine Verwendung von wissenschaftlichen Gesellschaften mittlerweile nicht mehr empfohlen, obwohl es immer noch zu oft als Erstbehandlung eingesetzt wird (34). Gleiches gilt für schnell wirkende Antihypertensiva wie bestimmte Vasodilatatoren.
Es stellt sich daher die Frage nach der Wahl der Therapie in der Notaufnahme. Derzeit gibt es keine klar festgelegten Empfehlungen speziell für diesen Kontext. Dennoch scheint die Einleitung oder Anpassung einer Behandlung in der Notaufnahme sicher und wirksam zu sein: In der Studie von Brody et al. ist die Verschreibung in der Notaufnahme mit einem signifikanten Rückgang des systolischen Blutdrucks bei der kurzfristigen ambulanten Nachsorge verbunden, ohne dass es zu einer Zunahme von Nebenwirkungen oder zu einer Blutdrucksenkung über potenziell schädliche Schwellenwerte hinaus kommt (35). In Ermangelung spezifischer Empfehlungen werden die Behandlungsprinzipien aus der Behandlung der chronischen Hypertonie in Übereinstimmung mit den aktuellen Empfehlungen abgeleitet (2).
Diesen Empfehlungen zufolge müssen diese Patienten in der Regel nicht stationär aufgenommen werden. Die Senkung des Blutdrucks muss oral, schrittweise über 24–48 Stunden erfolgen, entweder durch die Wiedereinführung oder Intensivierung der vorherigen Behandlung oder durch die Einführung eines neuen Behandlungsschemas. Bei einem unbehandelten Patienten wird ein langwirksamer Kalziumkanalblocker vom Dihydropyridin-Typ als Erstbehandlung empfohlen (wenig Kontraindikationen, beeinträchtigt die Untersuchung auf sekundäre Hypertonie nicht). Es ist auch möglich, andere langwirksame orale Kombinationen zu verabreichen, beispielsweise einen Renin-Angiotensin-Aldosteron-System-Blocker mit einem langwirksamen Kalziumkanalblocker und/oder einem Thiaziddiuretikum. Wie bereits erwähnt, sollten intravenöse Behandlungen oder schnell wirkende orale Wirkstoffe in diesem Zusammenhang nicht angewendet werden. Eine kurze Überwachungsphase auf der Beobachtungsstation vor der Entlassung ist in der Regel angezeigt. Da der Blutdruck nach der Entlassung aus der Notaufnahme weiterhin erhöht sein kann, sind weitere Messungen in der Praxis und ausserhalb der Praxis (ABPM) erforderlich. Eine engmaschige ambulante Nachsorge ist daher von grundlegender Bedeutung, um die Wirksamkeit, Verträglichkeit und Therapietreue zu beurteilen. Da es sich um eine schwere Hypertonie handelt, sollte schliesslich auch eine Untersuchung auf sekundäre Hypertonie gemäss den aktuellen Empfehlungen organisiert werden.
Fazit
Die unverzügliche Unterscheidung zwischen einer echten HN und einer schweren Hypertonie ohne ZOS bleibt entscheidend. Ersteres erfordert eine schnelle, kontrollierte und titrierbare intravenöse Blutdrucksenkung mit auf den klinischen Kontext abgestimmten Zielen. Letzteres erfordert eine vorsichtige und strukturierte Strategie: Bestätigung des Blutdruckanstiegs, Bewertung des Risikos einer chronischen zugrunde liegenden Hypertonie, schrittweise Senkung des Blutdrucks mit langwirksamen oralen Medikamenten. Notfälle bieten daher eine hervorragende Gelegenheit, eine unerkannte chronische Hypertonie zu erkennen, eine Behandlung einzuleiten oder zu optimieren und die Kontinuität der Versorgung im ambulanten Bereich sicherzustellen. Schliesslich gibt es nur wenige randomisierte Studien zur Behandlung schwerer Hypertonie in der Notaufnahme, was die Notwendigkeit zusätzlicher Daten zur Orientierung in der klinischen Praxis unterstreicht.
Copyright
Aerzteverlag medinfo AG
Abteilung für Innere Medizin
Ensemble Hospitalier de La Côte
Hôpital de Morges
Chem. du Crêt 2
1110 Morges
Fakultät für Biologie und Medizin,
Universität Lausanne
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Zhou B, Carrillo-Larco RM, Danaei G, Riley LM, Paciorek CJ, Stevens GA, et al. Weltweite Trends bei der Prävalenz von Bluthochdruck und Fortschritte bei der Behandlung und Kontrolle von 1990 bis 2019: eine gepoolte Analyse von 1201 bevölkerungsrepräsentativen Studien mit 104 Millionen Teilnehmern. The Lancet. Sept. 2021;398(10304):957‑80.
2. Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, et al. 2023 ESH-Leitlinien für die Behandlung von arterieller Hypertonie Die Task Force für die Behandlung von arterieller Hypertonie der Europäischen Gesellschaft für Hypertonie: Unterstützt von der Internationalen Gesellschaft für Hypertonie (ISH) und der Europäischen Nierenvereinigung (ERA). J Hypertens. Dez. 2023;41(12):1874‑2071.
3. Bress AP, Anderson TS, Flack JM, Ghazi L, Hall ME, Laffer CL, et al. Die Behandlung von erhöhtem Blutdruck in der Akutversorgung: Eine wissenschaftliche Stellungnahme der American Heart Association. Hypertension [Internet]. August 2024 [zitiert am 25. August 2025];81(8). Verfügbar unter: https://www.ahajournals.org/doi/10.1161/HYP.0000000000000238
4. Kulkarni S, Glover M, Kapil V, Abrams SML, Partridge S, McCormack T, et al. Management of hypertensive crisis: British and Irish Hypertension Society Position document. J Hum Hypertens. 22. November 2022;37(10):863‑79.
5. Domek M, Gumprecht J, Lip GYH, Shantsila A. Maligne Hypertonie: Gibt es sie noch? J Hum Hypertens. Jan. 2020;34(1):1‑4.
6. van den Born BJH, Lip GYH, Brguljan-Hitij J, Cremer A, Segura J, Morales E, et al. ESC Council on hypertension position document on the management of hypertensive emergencies. Eur Heart J Cardiovasc Pharmacother. 1. Jan. 2019;5(1):37‑46.
7. Cremer A, Amraoui F, Lip GYH, Morales E, Rubin S, Segura J, et al. Von der malignen Hypertonie zur Hypertonie-MOD: eine moderne Definition für einen alten, aber immer noch gefährlichen Notfall. J Hum Hypertens. Aug. 2016;30(8):463‑6.
8. Weltgesundheitsorganisation. Bluthochdruck. 2025; Verfügbar unter: https://www.who.int/news-room/fact-sheets/detail/hypertension
9. Patel KK, Young L, Howell EH, Hu B, Rutecki G, Thomas G, et al. Merkmale und Ergebnisse von Patienten mit hypertensiver Notfallbehandlung in der Arztpraxis. JAMA Intern Med. 1. Juli 2016;176(7):981.
10. Janke AT, McNaughton CD, Brody AM, Welch RD, Levy PD. Trends in der Häufigkeit von hypertensiven Notfällen in US-Notaufnahmen von 2006 bis 2013. J Am Heart Assoc. Dez. 2016;5(12):e004511.
11. Katz JN, Gore JM, Amin A, Anderson FA, Dasta JF, Ferguson JJ, et al. Behandlungsmuster, Ergebnisse und Endorgandysfunktion bei Patienten mit akuter schwerer Hypertonie: Das Register zur Untersuchung der Behandlung von akuter Hypertonie (STAT). Am Heart J. Okt. 2009;158(4):599-606.e1.
12. Shah M, Patil S, Patel B, Arora S, Patel N, Garg L, et al. Trends bei Krankenhausaufenthalten aufgrund hypertensiver Notfälle und Zusammenhang zwischen Endorganschäden und Krankenhaussterblichkeit. Am J Hypertens. 1. Juli 2017;30(7):700‑6.
13. Polgreen LA, Suneja M, Tang F, Carter BL, Polgreen PM. Zunehmender Trend bei Einweisungen wegen maligner Hypertonie und hypertensiver Enzephalopathie in den Vereinigten Staaten. Hypertension. Mai 2015;65(5):1002‑7.
14. Lip GY, Beevers M, Beevers G. The failure of malignant hypertension to decline: a survey of 24 years’ experience in a multiracial population in England. J Hypertens. 1994;12(11):1297-1305.
15. Shantsila A, Shantsila E, Beevers DG, Lip GYH. Prädiktoren für 5-Jahres-Ergebnisse bei malignem Bluthochdruck: das West Birmingham Malignant Hypertension Registry. J Hypertens. Nov. 2017;35(11):2310‑4.
16. Alshami A, Romero C, Avila A, Varon J. Management von hypertensiven Krisen bei älteren Menschen. J Geriatr Cardiol JGC. Juli 2018;15(7):504‑12.
17. Miller JB, Hrabec D, Krishnamoorthy V, Kinni H, Brook RD. Evaluation and management of hypertensive emergency. BMJ. 26. Juli 2024;e077205.
18. Paulson OB, Waldemar G, Schmidt JF, Strandgaard S. Zerebrale Durchblutung unter normalen und pathologischen Bedingungen. Am J Cardiol. Februar 1989;63(6):C2‑5.
19. Strandgaard S, Olesen J, Skinhoj E, Lassen NA. Autoregulation der Hirndurchblutung bei schwerer arterieller Hypertonie. BMJ. 3. März 1973;1(5852):507‑10.
20. Lavin P. Management von Bluthochdruck bei Patienten mit akutem Schlaganfall. Arch Intern Med. 1. Januar 1986;146(1):66.
21. Strandgaard S. Cerebral ischaemia caused by overzealous blood pressure lowering. Dan Med Bull. Dez. 1987;34 Suppl 1:5‑7.
22. Oras P, Häbel H, Skoglund PH, Svensson P. Erhöhter Blutdruck in der Notaufnahme: Ein Risikofaktor für Herz-Kreislauf-Erkrankungen. Hypertens Dallas Tex 1979. Jan. 2020;75(1):229‑36.
23. Grassi D, O’Flaherty M, Pellizzari M, Bendersky M, Rodriguez P, Turri D, et al. Hypertensive Notfälle in der Notaufnahme: Bewertung der Blutdruckreaktion auf Ruhe und auf blutdrucksenkende Medikamente mit unterschiedlichen Profilen. J Clin Hypertens. Sept. 2008;10(9):662‑7.
24. Park SK, Lee DY, Kim WJ, Lee SY, Park HS, Kim HW, et al. Vergleich der klinischen Wirksamkeit von Ruhe und blutdrucksenkenden Medikamenten bei Patienten mit hypertensiver Notfallsituation: eine randomisierte Kontrollstudie. J Hypertens. Juli 2017;35(7):1474‑80.
25. Mitsungnern T, Srimookda N, Imoun S, Wansupong S, Kotruchin P. Die Wirkung von Lippenbremsatmung in Kombination mit Zählen auf Blutdruck und Herzfrequenz bei Patienten mit hypertensiver Notfall: Eine randomisierte kontrollierte Studie. J Clin Hypertens. März 2021;23(3):672‑9.
26. Berney M, Fakhouri F, Wuerzner G. [Schwere asymptomatische Hypertonie und hypertensive Notfälle: Von der ambulanten Versorgung bis zur Notaufnahme]. Rev Med Suisse. 15. September 2021;17(750):1549‑55.
27. Ahmed N, Näsman P, Wahlgren NG. Wirkung von intravenös verabreichtem Nimodipin auf den Blutdruck und den Verlauf nach einem akuten Schlaganfall. Stroke. Juni 2000;31(6):1250‑5.
28. Ledingham JG, Rajagopalan B. Zerebrale Komplikationen bei der Behandlung von beschleunigter Hypertonie. Q J Med. Jan. 1979;48(189):25‑41.
29. Sandset EC, Bath PM, Boysen G, Jatuzis D, Kõrv J, Lüders S, et al. Der Angiotensin-Rezeptorblocker Candesartan zur Behandlung des akuten Schlaganfalls (SCAST): eine randomisierte, placebokontrollierte Doppelblindstudie. The Lancet. Februar 2011;377(9767):741‑50.
30. Vlcek M, Bur A, Woisetschläger C, Herkner H, Laggner AN, Hirschl MM. Zusammenhang zwischen hypertensiven Notfällen und nachfolgenden kardiovaskulären Ereignissen bei Patienten mit Bluthochdruck. J Hypertens. Apr. 2008;26(4):657‑62.
31. Goldberg EM, Wilson T, Jambhekar B, Marks SJ, Boyajian M, Merchant RC. Von der Notaufnahme bereitgestellte Blutdruckmessgeräte für zu Hause können helfen, nicht diagnostizierten Bluthochdruck zu erkennen. High Blood Press Cardiovasc Prev. Feb. 2019;26(1):45‑53.
32. Wachter RM. Symptomatische Hypotonie, ausgelöst durch Nifedipin bei der Akutbehandlung von schwerem Bluthochdruck. Arch Intern Med. März 1987;147(3):556‑8.
33. O’Mailia JJ, Sander GE, Giles TD. Nifedipin-assoziierte Myokardischämie oder -infarkt bei der Behandlung von hypertensiven Notfällen. Ann Intern Med. August 1987;107(2):185‑6.
34. Grossman E, Messerli FH, Grodzicki T, Kowey P. Sollte ein Moratorium für sublinguale Nifedipin-Kapseln bei hypertensiven Notfällen und Pseudo-Notfällen verhängt werden? JAMA. 23. Oktober 1996;276(16):1328‑31.
35. Brody A, Rahman T, Reed B, Millis S, Ference B, Flack JM, et al. Sicherheit und Wirksamkeit von blutdrucksenkenden Medikamenten bei der Entlassung aus der Notaufnahme. Acad Emerg Med Off J Soc Acad Emerg Med. Mai 2015;22(5):632‑5.