Les crises épileptiques comptent parmi les symptômes principaux neurologiques les plus impressionnants et constituent un défi diagnostique, en particulier lors de la première crise. La différenciation entre crises provoquées, non provoquées et épilepsie (épilepsie-maladie) est essentielle pour les décisions thérapeutiques. Une anamnèse minutieuse, complétée par un EEG, une IRM et des examens de laboratoire, permet généralement une classification fondée et aide à exclure des diagnostics différentiels pertinents tels que syncopes ou crises psychogènes. La Ligue internationale contre l’ épilepsie (ILAE) classe les crises selon leur lieu d’ origine en crises focales, crises généralisées et crises d’ origine indéterminée, ce qui facilite la classification thérapeutique. Des mesures d’ urgence sont particulièrement indiquées en cas de crises en série ou d’ état de mal épileptique. La décision d’ un traitement à long terme visant à supprimer les crises doit être prise au cas par cas et dépend du type de crise, de l’ étiologie, du risque de récidive, des comorbidités et de la situation de vie individuelle du patient. L’ éducation des patients en ce qui concerne les facteurs déclenchants, l’ observance du traitement, les risques quotidiens et l’ aptitude à conduire est un élément central de la prise en charge. Un diagnostic précoce et différencié avec une approche personnalisée peut améliorer considérablement le pronostic: environ deux tiers des personnes concernées n’ auront plus de crises sous traitement suppresseur antiépileptique.
Epileptic seizures rank among the most striking neurological key symptoms and pose a particular diagnostic challenge, especially when occurring for the first time. Differentiating between provoked, unprovoked seizures and epilepsy is essential for making appropriate therapeutic decisions. A thorough medical history, supported by EEG, MRI, and laboratory tests, usually allow a well-founded classification and helps exclude important differential diagnoses such as syncope or psychogenic non-epileptic seizures. The International League Against Epilepsy (ILAE) classifies seizures based on their origin into focal, generalized, and seizures of unknown onset, which facilitates therapeutic categorization. Acute management is particularly indicated in cases of seizure clusters or status epilepticus. The decision to initiate long-term antiseizure therapy should be made on an individual basis and depends on seizure type, etiology, risk of recurrence, comorbidities, and the patient’ s individual life circumstances. Patient education is a central aspect of the management and should cover trigger factors, therapy adherence, everyday safety risks, and driving eligibility. Early and differentiated diagnostics combined with an individually tailored treatment approach can significantly improve the prognosis – around two-thirds of affected individuals achieve seizure freedom with antiseizure therapy.
Keywords: Epilepsy, Seizures, Status Epilepticus, Electroencephalography, Magnetic Resonance Imaging
Introduction
La crise épileptique est l’ un des symptômes principaux neurologiques les plus marquants et souvent les plus dramatiques. En tant que perturbation soudaine et temporaire du fonctionnement cérébral due à une activité électrique anormale dans le cortex, elle peut se manifester par une multitude de symptômes, allant de sensations sensorielles discrètes à des convulsions tonico-cloniques généralisées. La première crise représente souvent un défi diagnostique pour le patient et les médecins traitants. À cela s’ ajoute la nécessité de différencier un épisode isolé d’ une épilepsie sous-jacente, avec des implications considérables pour la suite du traitement.
Madame K., 32 ans, est en train de faire ses courses, lorsqu’ au rayon fromagerie elle se sent mal, elle a une sensation étrange qui remonte de l’ estomac. Elle essaie de demander de l’ aide à une employée du magasin, mais n’ arrive pas à prononcer un mot. Par la suite, elle ne se souvient plus de rien. Elle reprend conscience seulement dans l’ ambulance qui la conduit à l’ Hôpital. L’ employée du rayon fromagerie raconte que Mme K. se tenait devant elle, le regard fixe et elle aurait fait des gestes automatiques-répétitifs. Elle aurait ensuite commencé à avoir des «convulsions», serait tombée et devenue bleue avec de la mousse à la bouche, puis restée couchée au sol, apathique. L’ employée dit ne plus se souvenir avec précision, le tout s’ étant déroulé tellement rapidement.
Définition
Une crise épileptique est définie comme l’ apparition transitoire de signes objectifs et/ou subjectifs, en tant qu’ expression clinique d’ une activité neuronale cérébrale excessive ou synchronisée (1).
Les crises épileptiques peuvent être classées en crises provoquées, crises isolées non provoquées et crises dans le cadre d’ une épilepsie:
• Les crises provoquées surviennent en relation temporelle avec un déclencheur spécifique. Les crises symptomatiques aiguës représentent jusqu’ à 40 % des premières crises et sont associées à un risque moindre de développer une épilepsie que les crises non provoquées (2, 3, 4). Les causes fréquentes sont les troubles métaboliques, le sevrage alcoolique ou médicamenteux, ainsi que les événements neurologiques aigus tels les accidents vasculaires cérébraux, l’ encéphalite ou les traumatismes crâniens. Le délai pour les définir en tant que crise symptomatique aiguë varie en fonction de la cause. Une recommandation consensuelle propose les délais suivants (3):
– dans la semaine après un accident vasculaire cérébral, un traumatisme crânio-cérébral, une encéphalopathie anoxique ou une opération intracrânienne
– lors du diagnostic initial d’ un hématome sous-dural
– pendant la phase active d’ une infection du système nerveux central
– dans les 24 heures suivant un dérèglement métabolique majeur
• Les crises non provoquées surviennent sans facteur déclenchant identifiable. Dans le cas de crises isolées non provoquées, le risque de survenue d’ une nouvelle crise au cours des 10 prochaines années est inférieur à 60 %. Si le risque est plus élevé, une crise non provoquée doit être considérée comme la première manifestation d’ une épilepsie.
• Par définition, on parle d’ épilepsie (épilepsie-maladie) lorsqu’ au moins deux crises non provoquées se sont produites à plus de 24 heures d’ intervalle ou lorsque, après une seule crise non provoquée, le risque d’ une nouvelle crise au cours des 10 prochaines années est supérieur à 60 %. Ce cas de figure est présent notamment lorsque des potentiels typiques d’ épilepsie sont détectables à l’ EEG ou qu’ à l’ IRMc des lésions potentiellement épileptogènes sont visibles (5).
Manifestations cliniques et classification
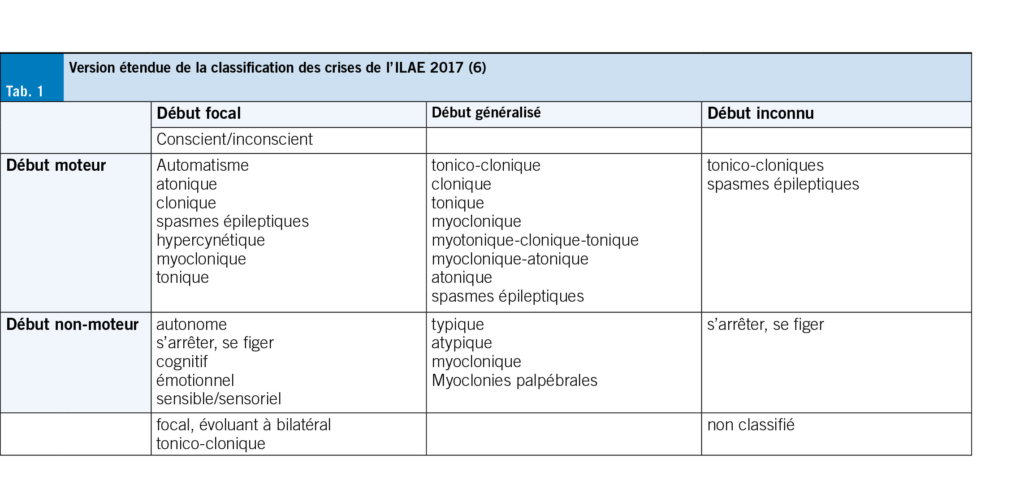
La symptomatologie des crises épileptiques est extrêmement variable et dépend à la fois du type de crise et de la région du cerveau touchée. Pour améliorer la classification, la Ligue internationale contre l’ épilepsie a développé en 2017 un système qui distingue les crises principalement en fonction de leur lieu d’ origine: origine focale, généralisée ou inconnue (6).
Crises focales:
Les crises focales commencent dans une zone délimitée d’ un hémisphère cérébral. Elles peuvent être motrices ou non motrices. Elles peuvent également être classées en fonction de l’ état de conscience. La classification des crises se fait en fonction de leur symptôme précoce le plus marquant.
Crises focales motrices
Elles se manifestent par des symptômes tels que des secousses cloniques, des contractions toniques ou des automatismes gestuels (p. ex. tripoter, mâcher).
Crises focales non motrices (anciennement en partie appelées «auras»)
• Sensorielles: en font partie des symptômes tels que des paresthésies, des hallucinations visuelles ou auditives.
• Végétatives: l’ un des exemples les plus connus est «l’ aura épigastrique». Elle est vécue comme une vague sensation de malaise dans l’ estomac, ou sensation épigastrique ascendante.
• Cognitives: il s’ agit ici de troubles du langage ou d’ altérations d’ autres fonctions cognitives. Des symptômes positifs tels que le déjà-vu, le jamais-vu ou des altérations de la perception peuvent également apparaître.
• Les crises émotionnelles se manifestent par des sentiments soudains tels que la peur, l’ angoisse ou la joie. On peut également observer un comportement affectif sans émotions vécues de façon consciente.
État de conscience lors de crises focales
• Conscience préservée (anciennement: «simple focal»): le patient est conscient de lui-même et de son environnement, même s’ il ne peut pas bouger. Cela correspond à l’ ancienne notion de «crise partielle simple».
• Conscience non préservée (anciennement: «focal complexe»): le patient présente une altération de la conscience, souvent accompagnée d’ amnésie et de mouvements automatiques. Cela correspondait autrefois à la «crise partielle complexe».
• L’ état de conscience. Ce critère, pour décrire la crise, peut être facultatif, en particulier s’ il est inconnu ou non applicable.
• Les crises focales peuvent évoluer vers des crises généralisées. Elles sont alors classées comme crises focales évoluant vers des crises bilatérales tonico-cloniques (anciennement: crises tonico-cloniques secondaires généralisées).
Crises généralisées:
Elles commencent simultanément dans les deux hémisphères cérébraux et s’ accompagnent généralement de troubles de la conscience. Aussi dans ce domaine, on distingue primairement les crises motrices et non motrices (absences):
Crises motrices
• Crises tonico-cloniques bilatérales (anciennement «crises tonico-cloniques généralisées»): raidissement tonique initial suivi de secousses cloniques rythmiques
• Myoclonies: contractions musculaires soudaines et brèves, souvent bilatérales et symétriques.
• Crises atoniques: perte soudaine du tonus musculaire pouvant entraîner la chute.
Absences
• Une absence typique se caractérise par une perte de conscience soudaine et brève, sans phénomènes associés significatifs.
• Une absence atypique se distingue par un début ou une fin plus lents, une durée plus longue ou des modifications significatives du tonus musculaire. Elle est associée à une activité lente et généralisée de type «spike-wave» à l’ EEG.
• Les absences s’ accompagnent parfois de myoclonies (palpébrales).
Crises non classifiées
Une crise peut rester non classée en raison d’ un manque d’ informations ou d’ une impossibilité de la classer. C’ est souvent le cas pour des événements non observés (tableau 1).
À l’ Hôpital, Mme K. rapporte, lorsqu’ on lui pose la question, avoir déjà remarqué par le passé cette sensation épigastrique ascendante qui dure moins d’ une minute, parfois accompagnée d’ une sorte de déjà-vu; mais elle avait toujours pensé que cela venait de l’ estomac. Même après des questions ciblées, aucun autre symptôme de type crise n’ est signalé. La patiente est par ailleurs en bonne santé et personne dans sa famille ne souffre de crises d’ épilepsie.
Selon la classification de l’ ILAE, la patiente présente donc les types de crises suivants:
• crises focales avec conscience préservée, non motrices, végétatives et cognitives
• crise focale évoluant vers une crise tonico-clonique généralisée
Diagnostic
Le diagnostic d’ une crise épileptique repose principalement sur les antécédents médicaux, corroborés par une électroencéphalographie (EEG), une imagerie cérébrale et des analyses de laboratoire. Les questions principales à se poser lors du diagnostic d’ une première crise sont les suivantes:
• S’ agissait-il d’ une crise épileptique ou d’ un événement non- épileptique?
• S’ il s’ agissait d’ une crise épileptique: était-elle due à un processus systémique traitable (crise provoquée ou symptomatique aiguë) ou à un dysfonctionnement intrinsèque du système nerveux central (crise non provoquée)?
• Si la crise était non provoquée: quel type de pathologie cérébrale sous-jacente est présent?
• Quel est le risque de récidive de la crise?
• Peut-on poser un diagnostic d’ épilepsie?
Cette évaluation est déterminante pour décider s’ il convient d’ instaurer un traitement médicamenteux visant à supprimer les crises et pour choisir un traitement adapté à la cause sous-jacente, pour autant qu’ elle soit connue. Cette évaluation est également importante pour la situation personnelle du patient, par exemple en ce qui concerne l’ aptitude à la conduite ou des restrictions professionnelles.
Anamnèse
Idéalement, l’ anamnèse devrait inclure à la fois l’ anamnèse personnelle et l’ anamnèse par des tiers. Une attention particulière doit être accordée à des détails spécifiques tels que des prodromes, la durée de la crise, des symptômes de latéralisation, les yeux ouverts ou fermés pendant la crise, l’ état de conscience et une phase post-critique. Comme les proches ont souvent du mal à recenser tous les symptômes pertinents dans une situation aiguë, il peut être utile, chez les patients souffrant de crises répétées, d’ instruire les proches à enregistrer les crises sur leur smartphone (7).
En outre, il convient d’ explorer de manière ciblée des symptômes du passé que les patients n’ associent pas immédiatement à des crises épileptiques. Citons notamment des crises non motrices ou des indices indirects de crises nocturnes, tels que le réveil avec morsure de la langue, l’ énurésie ou des douleurs musculaires. Chez plus de 40 % des patients examinés à la suite d’ une première crise, un interrogatoire plus approfondi révèle qu’ ils ont déjà eu des crises dans le passé (8).
Il convient également de tenir compte du développement de la petite enfance et des antécédents familiaux, car des facteurs tels que les complications périnatales, les convulsions fébriles ou les prédispositions génétiques peuvent jouer un rôle. Il est essentiel de recueillir les antécédents médicamenteux complets et de poser des questions ciblées sur la consommation d’ alcool et de drogues, qui peuvent être des déclencheurs potentiels de crises.
Enfin, il convient de recueillir les antécédents sociaux afin d’ identifier les facteurs de stress psychosocial comme cause possible de crises non-épileptiques. Les aspects professionnels doivent également être pris en compte, car un diagnostic d’ épilepsie peut avoir des répercussions considérables sur l’ activité professionnelle et l’ aptitude à conduire.
Examen neurologique
L’ examen clinique vise principalement à détecter des déficits ou des indices pouvant indiquer des lésions cérébrales structurelles. Il convient notamment de prendre en compte des anomalies neuropsychologiques et également vérifier la présence d’ une morsure de langue.
EEG
Étant donné que les potentiels épileptiformes (PEP) ne surviennent que dans 0.5 % chez des personnes non-épileptiques (9), leur détection déjà après une première crise épileptique peut contribuer au diagnostic de l’ épilepsie (5). Cependant, un EEG normal n’ exclut pas l’ épilepsie. La sensibilité d’ un premier EEG de routine pour la détection des PEP après une première crise se situe initialement entre 12 % et 55 %. Elle peut toutefois être considérablement augmentée par l’ utilisation d’ EEG répétitifs, d’ EEG après privation de sommeil et d’ EEG de longue durée (10, 11, 12). Une amélioration supplémentaire du taux de détection peut être obtenue en passant de 19 à 25 électrodes avec 6 électrodes supplémentaires temporobasales (13). La sensibilité est particulièrement élevée lorsque l’ EEG est réalisé dans les 24 heures suivant la crise (51 % contre 34 %) (14).
Imagerie
En principe, une imagerie cérébrale doit être réalisée chez chaque patient présentant une première crise épileptique. En raison de sa sensibilité supérieure, la méthode de choix est l’ IRM, qui ne doit pas nécessairement être réalisée le jour même chez les patients cliniquement en bonne santé. Il est toutefois important de choisir des séquences appropriées, comme celles du protocole IRM HARNESS (Harmonized Neuroimaging of Epilepsy Structural Sequences) (15).
Une imagerie immédiate est toutefois indiquée chez les patients présentant un nouveau déficit focal après la crise, en particulier en cas de troubles qualitatifs ou quantitatifs de la conscience, de maux de tête persistants, d’ antécédents de traumatisme crânien aigu, de maladie maligne ou d’ anticoagulation. Dans de tels cas, le CT scan est souvent l’ examen initial le plus approprié pour exclure des résultats critiques, car il est souvent disponible plus rapidement et plus facile à utiliser chez les patients présentant des troubles de la conscience (16).
Examens de laboratoire
Les examens de laboratoire sont nécessaires en premier lieu pour exclure des causes métaboliques, toxiques ou inflammatoires. Il convient donc de déterminer le taux de glucose, la formule sanguine, les valeurs hépatiques et rénales et les électrolytes.
Pour le diagnostic différentiel des crises psychogènes non-épileptiques (CPNE), la détermination de la créatine kinase, du lactate et de la prolactine s’ avère être utile. La créatine kinase augmente chez 45 % des patients après une crise tonico-clonique bilatérale, atteint un maximum après 24 à 48 heures et reste normale en cas de CPNE ou de syncope (17). Le lactate augmente dans les 1 à 2 heures suivant la crise et, avec un seuil de 4.75 mmol/l, il présente une sensibilité (79 %) et une spécificité (89 %) élevées pour distinguer les syncopes et les CPNE (18). La prolactine peut également être utile pour distinguer les CPNE si elle est mesurée tôt (maximum 10 à 20 minutes après la crise, normalisation après 2 à 6 heures). On observe une augmentation dans environ 60 % des crises tonico-cloniques bilatérales et 46 % des crises focales non conscientes, dans 60 à 80 % des syncopes, mais pas dans les CPNE (19, 20).
En cas de suspicion individuelle, un dépistage toxicologique complémentaire doit être effectué. Une analyse du liquide céphalo-rachidien est indiquée en cas de suspicion de méningite ou d’ encéphalite auto-immune, un examen génétique n’ est généralement pas indiqué après une première crise.
Sur le plan clinique et neurologique, la patiente ne présente plus aucun signe particulier 30 minutes après l’ événement, et les résultats des analyses de laboratoire ne révèlent rien de particulier. Le jour même, un EEG est réalisé pour préciser le diagnostic. Il relève une activité focale intermittente de faible intensité dans le lobe temporal gauche, avec des pics isolés indiquant une prédisposition accrue aux crises. L’ IRM réalisée le lendemain ne montre rien de particulier.
Diagnostics différentiels
Les crises épileptiques doivent être distinguées des épisodes non-épileptiques tels que les syncopes, les crises psychogènes, les accidents ischémiques transitoires (AIT) et les migraines. Les caractéristiques cliniques jouent ici un rôle central:
Caractéristiques des crises épileptiques
Les crises épileptiques durent généralement deux minutes au maximum, sont stéréotypées et paroxystiques et se manifestent par des symptômes moteurs, sensoriels, cognitifs ou compor- tementaux soudains et transitoires. Les yeux sont généralement ouverts et, en cas de manifestations motrices généralisées, les mouvements des bras et des jambes sont synchrones (21). Une morsure latérale de la langue est très spécifique, mais ne survient que dans 22 % des cas, même lors de crises généralisées (22, 23). Une crise peut être suivie d’ une phase post-critique pouvant durer de quelques minutes à plusieurs heures, qui se caractérise le plus souvent par un trouble de la conscience (24). Dans environ 6 % des cas apparaît dans la phase post-critique également une paralysie de Todd qui doit être distinguée d’ une parésie en cas d’ accident vasculaire cérébral (25).
Syncopes
Elles se caractérisent par des symptômes prodromiques tels que des vertiges, des nausées et une pâleur et surviennent souvent dans un contexte particulier (p. ex. en cas de station debout prolongée, de chaleur, après une stimulation douloureuse). Une caractéristique typique est la perte de conscience généralement brève suivie d’ un rétablissement immédiat. Contrairement aux crises d’ épilepsie, les morsures de langue ou la confusion post-critique sont rares. L’ énurésie est également atypique (26). Des manifestations motrices sous forme de myoclonies lors de syncopes convulsivantes peuvent conduire au diagnostic erroné de crise épileptique (27). En général, celles-ci durent en moyenne 4 secondes, soit nettement moins longtemps que lors de crises généralisées (29 secondes) (28).
Crises psychogènes
Celles-ci présentent souvent un schéma de mouvements incongru et discontinu qui n’ est pas compatible avec les mécanismes neurologiques, en particulier des mouvements asynchrones, des mouvements pelviens saccadés et des mouvements latéraux de la tête et du corps. Contrairement aux crises épileptiques, les yeux sont souvent fermés ou plissés pendant l’ événement (29). Les épisodes durent souvent plus de deux minutes, soit plus longtemps que les crises épileptiques typiques (30).
Accidents ischémiques transitoires (AIT)
Contrairement aux crises d’ épilepsie, les AIT se caractérisent principalement par des symptômes négatifs tels qu’ une faiblesse ou une perte de sensibilité.
Migraine
Les auras migraineuses sont généralement progressives et durent plus longtemps (5 à 60 minutes). Elles s’ accompagnent souvent de symptômes positifs tels que des scotomes scintillants ou des paresthésies, mais rarement d’ une perte de conscience (31).
Étant donné que Mme K. avait probablement déjà souffert de crises focales non motrices dans le passé et que, dans l’ EEG, se trouvait un résultat spécifique à gauche correspondant à la sémiologie clinique, le diagnostic d’ épilepsie est posé.
Prise en charge
Le traitement dépend du type de la crise, de la cause sous-jacente et de la fréquence des crises. On distingue le traitement aigu, le traitement à long terme et l’ éducation du patient.
Traitement aigu
L’ administration de benzodiazépines n’ est pas recommandée lors de crises isolées, car le traitement ne fait généralement effet qu’ après la fin de la crise (midazolam buccal/intranasal après 10 minutes, lorazépam sublingual après 20 minutes). En plus, la phase post-critique est prolongée par les effets secondaires de ces médicaments (32, 33, 34). En cas de crises en série, les benzodiazépines jouent un rôle important dans la prévention de la crise suivante. En cas d’ état de mal épileptique, le lorazépam i.v. compte comme le traitement primaire le plus efficace (35).
Traitement à long terme
Les recommandations relatives à un traitement à long terme doivent être considérées sous l’ angle du risque de développement d’ autres crises.
En cas de crise symptomatique aiguë, le risque de développer d’ autres crises non provoquées dans les dix prochaines années est généralement de 19 % (36), de sorte qu’ un traitement à long terme n’ est en général pas recommandé. Dans le cas de crises symptomatiques aiguës survenant dans la semaine suivant un AVC, le risque de crises ultérieures est parfois supérieur à 60 % en tenant compte de facteurs tels que la hauteur du score NIHSS, l’ étiologie, l’ atteinte corticale et la zone touchée, ce qui répond formellement aux critères de l’ épilepsie et justifie donc un traitement (37). Le risque individuel peut être calculé à l’ aide du score SeLECT, pour lequel il existe également une application.
En cas de crises non provoquées, la mise en place d’ un traitement antiépileptique peut réduire le risque de récidive des crises après un an de 38.9 % à 19.1 % et de 46.9 % à 36.6 % après cinq ans. Toutefois, le pronostic à long terme en termes de taux de rémission après 3 à 5 ans et de mortalité n’ est pas influencé par le fait que le traitement est instauré immédiatement ou plus tard. Dans le même temps, le risque d’ effets secondaires des médicaments antiépileptiques est accru en cas d’ instauration immédiate du traitement (38). Dans cette situation, la décision d’ instaurer ou non un traitement médicamenteux doit être prise individuellement avec le/la patient/e.
En cas de première crise non provoquée avec détection de potentiels typiques de l’ épilepsie à l’ EEG ou de lésions épileptogènes à l’ imagerie crânienne, en raison du risque accru de récidive le diagnostic d’ épilepsie est justifié (5). Dans cette situation, un traitement antiépileptique est recommandé.
Lors du choix individuel du médicament antiépileptique parmi les plus de 30 substances disponibles à l’ heure actuelle, différents facteurs tels que la tolérance, le syndrome épileptique, la comédication, l’ âge et le désir d’ avoir des enfants doivent être pris en compte. En cas d’ épilepsies focales, la lamotrigine est considérée le traitement de première intention, les alternatives de deuxième intention étant le lévétiracétam et le lacosamide (39, 40, 41).
En cas d’ épilepsies génétiques, l’ acide valproïque est par principe le traitement de choix en raison de sa meilleure efficacité, mais son utilisation est limitée en raison de sa tératogénicité importante. Le lévétiracétam et la lamotrigine sont des alternatives de deuxième choix (42).
Formation/éducation des patients
Après une première crise d’ épilepsie, les personnes concernées doivent être informées en détail sur le tableau clinique et les aspects liés à la vie quotidienne. Les points essentiels à cet égard sont les suivants:
Facteurs déclenchants
Les risques de développer une crise en raison de facteurs déclenchants tels que le manque de sommeil, la consommation d’ alcool ou les stimuli lumineux doivent être expliqués au patient en tenant compte du syndrome épileptique. Un manque de sommeil de < 4 heures par nuit est pertinent pour les patients atteints d’ épilepsie génétique (43), mais pas en cas de crises focales (44). Une consommation modérée d’ alcool n’ est pas associée à un risque clairement accru de crises épileptiques (45, 46). Par contre, une consommation épisodique élevée ou un sevrage alcoolique sont pertinents (47).
À l’ ère de la numérisation croissante, la question de la photosensibilité est souvent posée. En général, la photosensibilité est très faible, avec une prévalence de 0.03. Elle se manifeste principalement dans les cas d’ épilepsie génétique ou d’ épilepsie du lobe occipital (48). La photosensibilité concerne principalement les fréquences entre 15 et 25 Hz (49), ce qui ne correspond pas aux fréquences des écrans modernes. Dans l’ ensemble, le risque peut être considéré comme faible.
Prise de médicaments
Si la prise de médicaments s’ avère nécessaire, l’ importance de l’ observance thérapeutique doit être expliquée. Il faut établir pour les patients un schéma thérapeutique clair et compréhensible et leur fournir des informations sur la marche à suivre en cas d’ oubli de prise.
Risque d’ événements dangereux
Le sujet de la mort subite et inattendue dans l’ épilepsie doit être expliqué aux patients et à leurs proches en tenant compte de la situation de risque individuelle (en particulier la fréquence des crises généralisées pendant le sommeil). Le risque de mort par noyade doit également être expliqué. Celui-ci est multiplié par 18 chez les patients épileptiques, 60 à 70 % des cas survenant dans la baignoire (50, 51). La situation professionnelle individuelle des patients doit également être évaluée (p. ex. les risques liés au travail sur des échelles hautes, des échafaudages ou avec des machines lourdes).
Aptitude à la conduite
Après une première crise, l’ aptitude à la conduite n’ est provisoirement pas donnée, la durée variant selon le type de crise (provoquée, non provoquée, épilepsie nouvellement diagnostiquée) et selon les directives du pays concerné (52, 53, 54). Le patient doit en être informé et cette information doit être documentée.
Mme K. a commencé un traitement à la lamotrigine, qu’ elle a bien toléré. Heureusement, elle n’ a pas eu d’ autres crises depuis. Conformément aux directives de la Ligue suisse contre l’ épilepsie, une interdiction de conduire d’ une durée d’ un an lui a d’ abord été imposée, mais celle-ci a depuis été levée.
Pronostic et suivi
Le pronostic dépend de la cause de la crise et de l’ efficacité du traitement. Environ 60 à 70 % des patients épileptiques ne présentent plus de crises lorsqu’ ils suivent un traitement adéquat. Un suivi régulier est essentiel pour optimiser le traitement et évaluer les charges psycho-sociales.
Conclusion
La crise d’ épilepsie est un symptôme directeur neurologique complexe. Elle peut être provoquée ou non, isolée ou constituer le premier symptôme d’ une épilepsie. Une anamnèse minutieuse et des examens complémentaires, parmi lesquels un EEG réalisé si possible dans les 24 heures et une IRM de haute qualité sont les plus importants, permettent en général une classification et de déterminer correctement les diagnostics différentiels pertinents tels que les syncopes et les crises psychogènes non-épileptiques. Un diagnostic précoce et correct ainsi qu’ une prise en charge personnalisée sont essentiels pour améliorer la qualité de vie des personnes concernées.
Copyright
Aerzteverlag medinfo AG
Réimpression tirée de Therapeutische Umschau 03/2025
Neurologie FMH
Neurologisch Aarau
Schanzweg 7
5000 Aarau
L’ autrice n’ a déclaré aucun conflit d’ intérêts en rapport avec cet article.
1. Fisher RS, van Emde Boas W, Blume W, Elger C, Genton P, Lee P, et al. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and theInternational Bureau for Epilepsy (IBE). Epilepsia 2005;46:470-472.
2. Mauritz M, Hirsch LJ, Camfield P, Chin R, Nardone R, Lattanzi S et al. Acute symptomatic seizures: an educational, evidence-based review. Epileptic Disord. 2022 Feb 1;24(1):26-49.
3. Beghi E, Carpio A, Forsgren L, Hesdorffer DC, Malmgren K, Sander JW et al. Recommendation for a definition of acute symptomatic seizure. Epilepsia. 2010 Apr;51(4):671-5.
4. Herzig-Nichtweiss J, Salih F, Berning S, Malter MP, Pelz JO, Lochner P et al. Prognosis and management of acute symptomatic seizures: a prospective, multicenter, observational study. Ann Intensive Care. 2023 Sep 15;13(1):85.
5. Fisher RS, Acevedo C, Arzimanoglou A, Bogacz A, Cross JH, Elger CE, et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014;55:475-482.
6. Fisher RS, Cross JH, French JA, Higurashi N, Hirsch E, Jansen FE, et al. Operational classification of seizure types by the International League Against Epilepsy: Position Paper of the ILAE Commission for Classification and Terminology. Epilepsia 2017;58:522-530.
7. Tatum WO, Hirsch LJ, Gelfand MA, Acton EK, LaFrance WC, Duckrow RB, et al. Video quality using outpatient smartphone videos in epilepsy: Results from the OSmartViE study. Eur J Neurol 2021;28:1.453-1.462.
8. Firkin AL, Marco DJ, Saya S, Newton MR, O’ Brien TJ, Berkovic SF et al.. Mind the gap: Multiple events and lengthy delays before presentation with a «first seizure». Epilepsia. 2015 Oct;56(10):1534-41
9. Gregory RP, Oates T, Merry RT. Electroencephalogram epileptiform abnormalities in candidates for aircrew training. Electroencephalogr Clin Neurophysiol 1993;86:75-77.
10. Goodin DS, Aminoff MJ. Does the interictal EEG have a role in the diagnosis of epilepsy? Lancet 1984;1:837-839.
11. Salinsky M, Kanter R, Dasheiff RM. Effectiveness of multiple EEGs in supporting the diagnosis of epilepsy: an operational curve. Epilepsia 1987;28:331-334.
12. Baldin E, Hauser WA, Buchhalter JR, Hesdorffer DC, Ottman R. Yield of epileptiform electroencephalogram abnormalities in incident unprovoked seizures: a population-based study. Epilepsia. 2014 Sep;55(9):1389-98.
13. Seeck M, Koessler L, Bast T, Leijten F, Michel C, Baumgartner C et al. The standardized EEG electrode array of the IFCN. Clin Neurophysiol. 2017 Oct;128(10):2070-2077.
14. King MA, Newton MR, Jackson GD, Fitt GJ, Mitchell LA, Silvapulle MJ, et al. Epileptology of the first-seizure presentation: a clinical, electroencephalographic and magnetic resonanceimaging study of 300 consecutive patients. Lancet 1998;352:1.007-1.011.
15. Bernasconi A, Cendes F, Theodore WH, Gill RS, Koepp MJ, Hogan RE, et al. Recommendations for the use of structural magnetic resonance imaging in the care of patients with epilepsy: A consensus report from the International League Against Epilepsy Neuroimaging Task Force.Epilepsia 2019;60:1.054-1.068.
16. Wirrell E. Evaluation of First Seizure and Newly Diagnosed Epilepsy. Continuum (Minneap Minn). 2022 Apr 1;28(2):230-260.
17. Brigo F, Igwe SC, Erro R, Bongiovanni LG, Marangi A, Nardone R, et al. Postictal serum creatine kinase for the differential diagnosis of epileptic seizures and psychogenic non-epileptic seizures: a systematic review. J Neurol 2015;262: 251-257.
18. Magnusson C, Herlitz J, Höglind R, Wennberg P, Edelvik Tranberg A, Axelsson C et al. Prehospital lactate levels in blood as a seizure biomarker: A multi-center observational study. Epilepsia. 2021 Feb;62(2):408-415.
19. Nass RD, Sassen R, Elger CE, Surges R. The role of postictal laboratory blood analyses in the diagnosis and prognosis of seizures. Seizure 2017;47:51-65.
20. Oribe E, Amini R, Nissenbaum E, Boal B. Serum prolactin concentrations are elevated after syncope. Neurology 1996;47:60-62.
21. Aybek S, Perez DL. Diagnosis and management of functional neurological disorder. BMJ 2022;376:64.
22. Benbadis SR, Wolgamuth BR, Goren H, Brener S, Fouad-Tarazi F. Value of tongue biting in the diagnosis of seizures. Arch Intern Med. 1995 Nov 27;155(21):2346-9.
23 Oliva M, Pattison C, Carino J, Roten A, Matkovic Z, O’ Brien TJ. The diagnostic value of oral lacerations and incontinence during convulsive «seizures». Epilepsia. 2008 Jun;49(6):962-7.
24 Pottkämper JCM, Hofmeijer J, van Waarde JA, van Putten MJAM. The postictal state – What do we know? Epilepsia. 2020 Jun;61(6):1045-1061.
25. Rolak LA, Rutecki P, Ashizawa T, Harati Y. Clinical features of Todd’ s post-epileptic paralysis. J Neurol Neurosurg Psychiatry.1992;55:63–4.
26. Sheldon R, Rose S, Ritchie D, Connolly SJ, Koshman ML, Lee MA et al.. Historical criteria that distinguish syncope from seizures. J Am Coll Cardiol. 2002 Jul 3;40(1):142-8.
27. Passman R, Horvath G, Thomas J, Kruse J, Shah A, Goldberger J, Kadish A. Clinical spectrum and prevalence of neurowlogic events provoked by tilt table testing. Arch Intern Med. 2003 Sep 8;163(16):1945-8.
28. Shmuely S, Bauer PR, van Zwet EW, van Dijk JG, Thijs RD. Differentiating motor phenomena in tilt-induced syncope and convulsive seizures. Neurology 2018;90: e1.339-e1.346.
29. Chung SS, Gerber P, Kirlin KA. Ictal eye closure is a reliable indicator for psychogenic nonepileptic seizures. Neurology 2006;66:1.730-1.731.
30. Reuber M, Elger CE. Psychogenic nonepileptic seizures: review and update. Epilepsy Behav 2003;4:205-216.
31. Headache Classification Committee of the International Headache Society (IHS) The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 2018 Jan;38(1):1-211.
32. von Blomberg A, Kay L, Knake S, Fuest S, Zöllner JP, Reif PS, et al. Efficacy, tolerability and safety of concentrated intranasal Midazolam spray as emergency medication in epilepsy patients during Video-EEG Monitoring. CNS Drugs 2020;34:545-553.
33. Scott RC, Besag FM, Neville BG. Buccal midazolam and rectal diazepam for treatment of prolonged seizures in childhood and adolescence: a randomised trial. Lancet 1999;353:623-626.
34. Greenblatt DJ, Divoll M, Harmatz JS, Shader RI. Pharmacokinetic comparison of sublingual lorazepam with intravenous, intramuscular, and oral lorazepam. J Pharm Sci 1982;71:248-252.
35. Treiman DM, Mayers PD, Walton NY, Collins JF, Colling C, Rowan AJ, et al. A comparison of four treatments for generalized convulsive status epilepticus. N Engl J Med 1998;339:792-798.
36. Hesdorffer DC, Benn EK, Cascino GD, Hauser WA. Is a first acute symptomatic seizure epilepsy? Mortality and risk for recurrent seizure. Epilepsia 2009;50:1.102-1.108.
37. Galovic M, Döhler N, Erdélyi-Canavese B, Felbecker A, Siebel P, Conrad J et al. Prediction of late seizures after ischaemic stroke with a novel prognostic model (the SeLECT score): a multivariable prediction model development and validation study. Lancet Neurol. 2018 Feb;17(2):143-152.
38. Leone MA, Giussani G, Nevitt SJ, Marson AG, Beghi E. Immediate antiepileptic drug treatment,versus placebo, deferred or no treatment for first unprovoked seizure. Cochrane Database Syst Rev 2021;5:CD007144.
39. Nevitt SJ, Sudell M, Cividini S, Marson AG, Tudur Smith C. Antiepileptic drug monotherapy for epilepsy: a network meta-analysis of individual participant data. Cochrane Database Syst Rev 2022;4:CD011412.
40. Marson AG, Al-Kharusi AM, Alwaidh M, Appleton R, Baker GA, Chadwick DW, et al. The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbazepine or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. Lancet 2007;369:1.000-1.015.
41. Marson A, Burnside G, Appleton R, Smith D, Leach JP, Sills G, et al. The SANAD II study of the effectiveness and cost-effectiveness of levetiracetam, zonisamide or lamotrigine for newly diagnosed focal epilepsy: an open-label, non-inferiority, multicentre, phase 4, randomized controlled trial. Lancet 2021;397:1.363-1.374.
42. Marson A, Burnside G, Appleton R, Smith D, Leach JP, Sills G, et al. The SANAD II study of the effectiveness and cost-effectiveness of valproate versus levetiracetam for newly diagnosed generalised and unclassifiable epilepsy: an open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet 2021;397:1.375-1.386.
43. Panayiotopoulos CP, Obeid T, Tahan AR. Juvenile myoclonic epilepsy: a 5-year prospective study. Epilepsia 1994;35:285-296.
44. Malow BA, Passaro E, Milling C, Minecan DN, Levy K. Sleep deprivation does not affect seizure frequency during inpatient video-EEG monitoring. Neurology 2002;59:1.371-1.374.
45. Bartolini E, Sander JW. Dealing with the storm: An overview of seizure precipitants and spontaneous seizure worsening in drug-resistant epilepsy. Epilepsy Behav 2019; 97:212-218.
46. Samsonsen C, Myklebust H, Strindler T, Bråthen G, Helde G, Brodtkorb E. The seizure precipitating effect of alcohol: A prospective observational cross-over study. Epilepsy Res 2018;143:82-89.
47. Samokhvalov A V., Irving H, Mohapatra S, Rehm J. Alcohol consumption, unprovoked seizures, and epilepsy: A systematic review and meta-analysis. Epilepsia 2010;51:1.177-1.184.
48. Tychsen L, Thio wLL. Concern of photosensitive seizures evoked by 3D video displays or virtual reality headsets in children: Current perspective. Eye Brain 2020;12:45–48.
49. Harding GFA, Harding PF. Photosensitive epilepsy and image safety. Appl Ergon 2010;41:504–508.
50. Chan E, Hesdorffer DC, Brandsoy M, et al. Dead in the water: Epilepsy related drowning or sudden unexpected death in epilepsy? Epilepsia 2018;59:1966–1972.
51. Ryan AC, Dowling G. Drowning deaths in people with epilepsy. Can Med Assoc J 1993,148:781–784.
52. Arnold P, Claudio C, Mathis J, Meyer K, Seeck, M, Seeger R et al. Fahreignung mit Epilepsie. Swiss medical Forum 2019;19(45–46):737–740
53. Bauer J, Neumann M. Fahreignung und Fahrsicherheit bei Epilepsie: Grundlagen, neue Leitlinien und Kommentar. Der Nervenarzt 2009; 80(12)
54. Arbeitsgruppe «Amtsärzte in Führerscheinangelegenheiten», Leitlinien für die gesundheitliche Eignung von Kraftfahrzeuglenkern – ein Handbuch für Amts- und Fachärzte und die Verwaltung, erstellt im Auftrag des BMVIT unter der Leitung des KFV 2019.