Kardiovaskuläre (cv) Erkrankungen sind weltweit die Haupttodesursache. Unter den cv Risikofaktoren hat der Diabetes mellitus Typ II (T2DM) wegen einer steigenden Prävalenz einen besonderen Stellenwert. 20-30% aller koronaren Patienten haben einen T2DM. Bei einem systematischen Screening dieses Kollektivs sind es mehr als 50%. Auch die Herzinsuffizienz (HI) ist hier deutlich erhöht, ebenso die chronische Niereninsuffizienz (CKD). Aus diesen Überlegungen und neuen bahnbrechenden kardio- und nephroprotektiven antidiabetischen Medikamenten mit überzeugenden Studienresultaten wurde diese ESC-Guideline aus dem Jahre 2019 bereits nach vier Jahren neu aufgelegt (1). Von der 98-seitigen Leitlinie können wir hier nur einige wichtige Punkte wiedergeben; es lohnt, sich mit dieser genauer auseinander zu setzen.
Cardiovascular disease (CVD) is the leading cause of death worldwide. Among cv risk factors, type II diabetes mellitus (T2DM) has a special place because of its increasing prevalence. 20-30% of all coronary patients have T2DM. With a systematic screening of this population, it increases to more than 50%. Heart failure is also significantly increased, as is chronic renal failure (CKD). Based on these considerations and new breakthrough cardio- and nephroprotective antidiabetic drugs with convincing trial results, this 2019 ESC guideline has been reissued after only four years (1). Of the 98-page guideline, we can only reproduce a few important points here; it is worth studying them in more detail.
Key words: ESC-Guidelines 2023 CVD + Diabetes; SGLT2-Inhibitor; GLP-1 RA ; cardio- + nephroprotective; CKD; eGFR+UACR; Finerenon; heart failure; “fantastic-four”; exercise training
Neben der erhöhten Prävalenz manifestiert sich der T2DM mit einer signifikant hohen Morbidität und Mortalität gegenüber Patienten ohne T2DM. Das Risiko für kardiovaskuläre (cv) Erkrankungen (CVD), wie eine koronare Herzkrankheit (CHK), koronarer Tod, nicht fataler Myokardinfarkt, Stroke, ist 2-fach erhöht. Es kommt zu einer früheren und rascheren Atherosklerose und Atherothrombose. Oft bestehen zusätzliche cv Risikofaktoren wie eine Dyslipidämie und/oder eine Hypertonie, welche alleine das cv Risiko ebenfalls erhöhen. Die Lebenserwartung ist bei beiden Geschlechtern wegen den vaskulären Erkrankungen deutlich vermindert. Bei einem T2DM mit einer CHK findet man häufiger eine Hauptstammstenose, eine Mehrgefässerkrankung und einen diffusen Befall der kleinen Gefässe. Zusätzlich häufig weitere vaskuläre Komorbiditäten wie eine CKD, eine PAVK und eine cerebrale Atherosklerose mit Apoplexie (2).
Screening
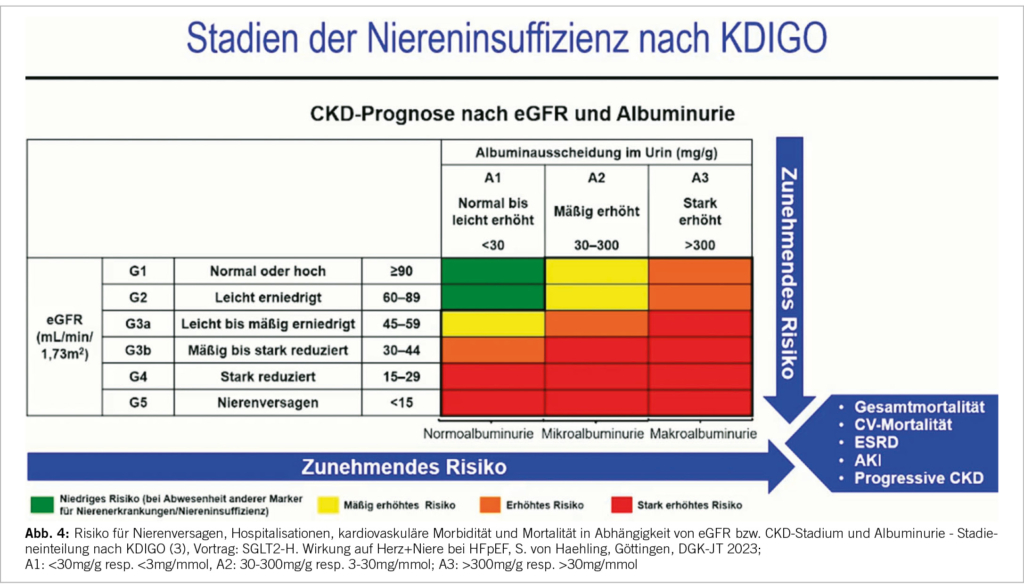
Bei einem T2DM hat das cv und renale Screening eine Klasse I-Indikation. So stellt sich immer die Frage nach einer ASCVD (athero-sklerotischen cv Erkrankung: u.a. Pulse, ABI, Plaques z.B. Carotis?) und einer Herzinsuffizienz (HI). Durch eine gute Anamnese mit Einordnung von Symptomen ergeben sich klare Erkennungsmerkmale; ebenso zur Erfassung der stark gehäuften HI. Es bedarf auch eines routinemässigen Screenings auf eine CKD (1). Diese wird mit einer eGFR (EPI) und einem morgendlichen Spontanurin mit Frage nach Mikro-/Albuminurie (UACR) nachgewiesen. Je schlechter die eGFR (<60ml/min/1.73m2 u./oder ≥ 30mg/g = 3mg/mmol Albuminurie) desto ausgeprägter die CKD und desto höher das cv Risiko – vgl. KDIGO 2013/2022 und Abbildung 4 (3, 4). Umgekehrt sollte bei einer cv Erkrankung auch ein T2DM mit einem Nüchtern-Blutzucker und einem HbA1c ausgeschlossen werden. Es bedarf einer Identifizierung der cv Risikofaktoren und der Komorbiditäten (HI, CHK, VHFLI, PAVK u.a.). Diese müssen Leitlinien gerecht behandelt werden.
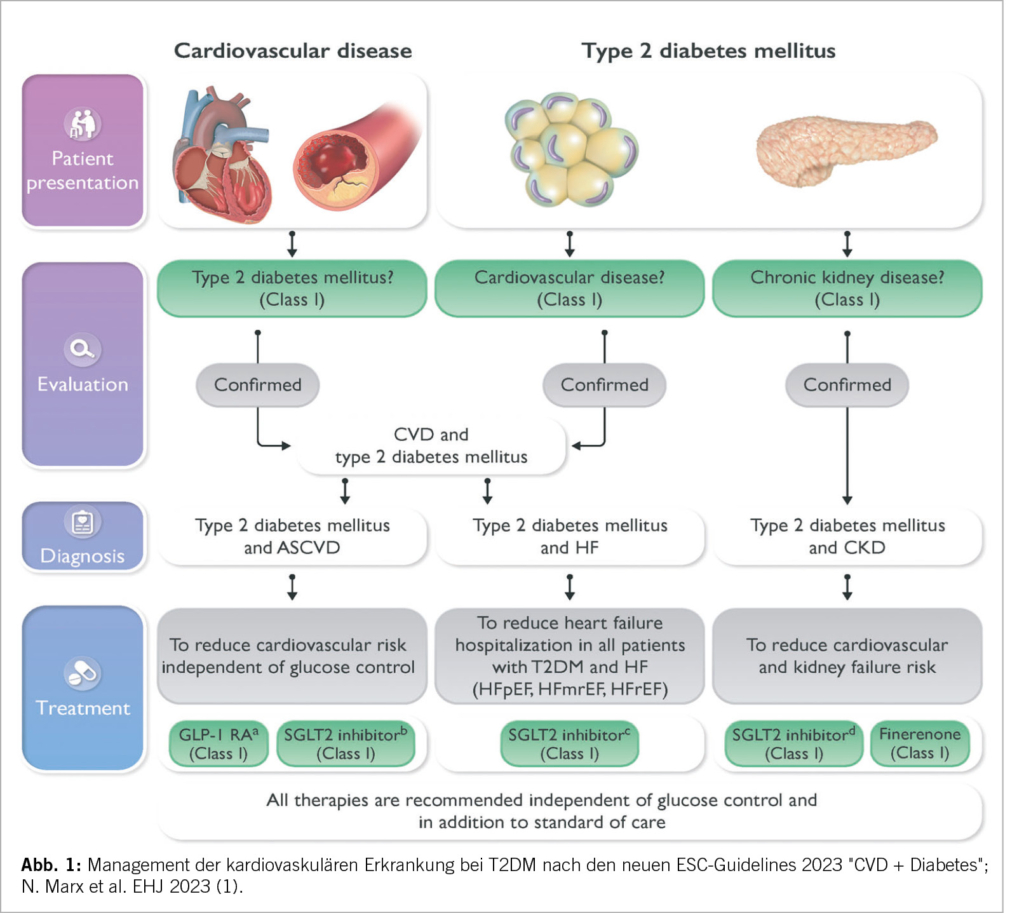
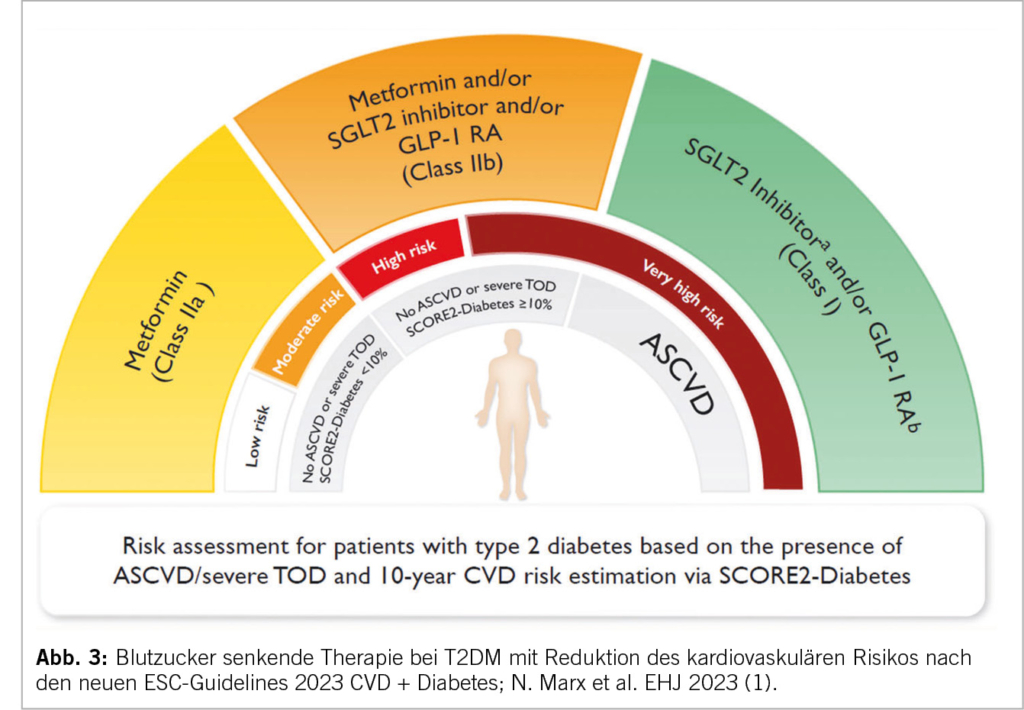
Bei Patienten mit einem T2DM und fehlender symptomatischer ASCVD oder schweren Endorganschäden (TOD), sollte der SCORE2-Diabetes, ein neuer ESC-Risikorechner, verwendet werden (IB). Berücksichtigt werden Alter, Geschlecht, Raucherstatus, systol. BD, Diabetes, HbA1c, wann Diagnose T2DM, Gesamtcholesterin, HDL und eGFR. Mit dieser mobilen ESC CVD Risk Calculation App (escardio.org) kann das cv 10-Jahres Krankheits-Risiko (fataler und nicht fataler CV events) bestimmt werden: <5% tief, 5%-<10% moderat, 10%-<20% hoch und ≥20% sehr hoch. Die Schweiz gehört zu den low risk Ländern wie z.B. Frankreich und Spanien. Bei einer ASCVD oder einem TOD wie einer CKD oder einer Retinopathie und Polyneuropathie kann der Score nicht verwendet werden; liegt hier doch bereits ein sehr hohes cv Risiko vor. Endorganschäden müssen bei T2DM gesucht resp. ausgeschlossen werden (IA). Die TOD sind definiert als: 1. eGFR <45ml/min/1.73m2 ± Albuminurie, 2. eGFR 45-59ml/min/1.73m2 u. Mikroalbuminurie (UACR: 30-300mg/g, Stad. A2), 3. Proteinurie (UACR: >300mg/g, Stad. A3) oder 4. mikrovaskuläre Schäden an drei Organen (Niere A2 u. Retino- u. Neuropathie). Bei CKD nach KDIGO Risikofaktoren Beurteilung alle 3-6 Monate.
Therapie
Bei einem T2DM bedarf es einer intensiven multimodalen Therapie, resp. einer konsequenten Sekundärprävention. Lifestyle-Massnahmen bleiben weiterhin sehr entscheidend. Sie beinhalten neben einer Gewichtsreduktion, eine gesunde mediterrane Ernährung reich an polyungesättigten und einfach gesättigten Fetten (Olivenöl, Nüsse) oder eine pflanzenbasierte Ernährung und weniger Zucker, Fleisch, Alkohol und Salz. Eine regelmässige körperliche Aktivität mit Ausdauer- und etwas Krafttraining und einen Verzicht auf Nikotin und andere Noxen (IA).
Bewegungstherapie: In einer ausgezeichneten Übersichtsarbeit aus Japan wird auf die entscheidende Bedeutung einer korrekten Bewegungstherapie bei T2DM hingewiesen. Durch eine regelmässige körperliche Aktivität kommt es zu einer signifikanten Verbesserung der glykämischen Kontrolle mit positiven Auswirkungen auf die Adipositas, den Fettstoffwechsel, den Blutdruck und auf eine Reduktion entzündlicher Zytokine. Die kardiorespiratorische Fitness wird gesteigert, ebenso die Muskelkraft. So kann auch einem T2DM vorgebeugt werden, die Gesamtmortalität und die cv Events werden vermindert, ebenso mikrovaskuläre diabetische Komplikationen (1,5). Die amerikanische Diabetes Association (ADA) empfiehlt: eine wöchentliche Aktivität von mindestens 150 min moderater (50-70% max. HF) aerober Intensität verteilt auf mind. 3 Tage/Woche mit nicht mehr als zwei aufeinanderfolgenden Tagen ohne Bewegung. 2-mal wöchentlich wird ein zusätzliches aufbauendes Krafttraining empfohlen. Diese Empfehlung gilt auch bei einer Adipositas.
Medikamentöse Therapie: Aufgrund verschiedener Metaanalysen inkl. grossen cv Outcomes Studien mit SGLT2-H. und GLP-1 RA geben die neuen Leitlinien separate Empfehlungen für Patienten mit und ohne ASCVD resp. TOD. Weitere cv medikamentöse Massnahmen werden beurteilt und gewichtet.
SGLT2-Hemmer
Über diese als orales Antidiabetikum entwickelte Medikamentenklasse mit kardio- und nephroprotektiven Eigenschaften und das praktische Vorgehen haben wir berichtet (6,7).
Die SGLT2-H. werden bei einer Herzinsuffizienz unabhängig von der LV-EF und auch bei einer chronischen Niereninsuffizienz (CKD) ± T2DM mit einer eGFR <60ml/min/1,73m2 mit oder ohne Albuminurie bis zu einer eGFR ≥20 ml/min/1,73m2 primär eingesetzt (IA). Es zeigt sich langfristig bei allen eine Stabilisierung der Nierenfunktion. Nach der DAPA-CKD- und der EMPA-Kidney-Studie kann eine Nierenersatztherapie um viele Jahre verzögert werden: dies in Relation zur basalen Nierenfunktion bei Beginn der Therapie. Bei einer CKD und bei einer HI, mit und ohne T2DM, sind sie erste Wahl (8-11). Sie reduzieren eine HI-Hospitalisation, den cv Tod und das Risiko einer MRA assoziierten Hyperkaliämie. Bei einer chronischen HI ist die Rate der cv Todesfälle mit beiden Medikamenten stärker reduziert als ohne MRAs.
In einer Metaanalyse von fünf cv Outcomes Studien (1) zeigen die SGLT2-H. eine überzeugende Wirkung einer Kardioprotektion mit Reduktion der cv Events bei einem T2DM und einer ASCVD. Die cv Events werden unabhängig vom HbA1c und weiteren Antidiabetika vermindert (IA). Es besteht ohne ASCVD resp. TOD eine IIb-Indikation (kann berücksichtigt werden) bei einem 10-Jahresrisko ≥10%. Als NW sind bei einem T2DM Genitalinfekte und selten eine euglykämische Ketoazidose zu beachten. Daher sollte bei schweren Erkrankungen, fieberhaften Infekten, perioperativ oder periinterventionell und bei Nahrungskarenz der SGLT2-H. pausiert werden.
GLP-1 RA
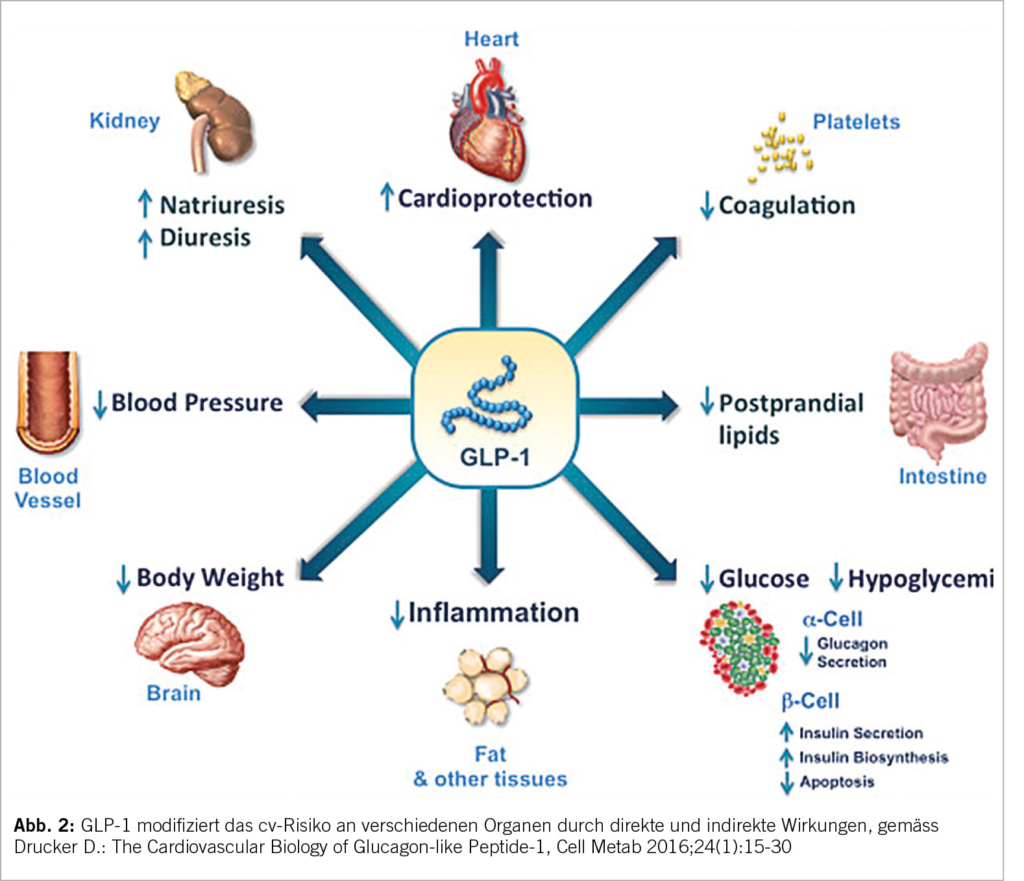
Bei GLP-1 Rezeptor-Agonisten handelt es sich um synthetisch hergestellte Polypeptide, die wie das natürliche Peptidhormon GLP-1 an den GLP-1 Rezeptor binden, aber eine verlängerte Halbwerts-zeit haben. Sie stimulieren die Sekretion von Insulin und hemmen die Ausschüttung von Glucagon. Darüber hinaus verlangsamen GLP-1 RA die Magenentleerung und erhöhen das Sättigungsgefühl. Sie haben wahrscheinlich einen zusätzlich antientzündlichen Effekt durch die Reduktion des Fettgewebes. Auch vermindern sie eine Makroalbuminurie. Die cv Schutzmechanismen durch eine Aktivierung von Rezeptoren am Herz, den Gefässen und am Hirn führt zu einer Reduktion der cv- und der Gesamtmortalität, einer Verminderung von tödlichen und nicht tödlichen Myokardinfarkten und Strokes und einer Reduktion der HI-Hospitalisationen. Dies zeigte eine grosse Metaanalyse. Bei einem T2DM und einer ASCVD wird das cv Risiko unabhängig von der Blutzuckerkontrolle und dem CKD-Stadium gesenkt (IA) (1). Die Abbildungen 1-3 ergeben klare Hinweise bez. Wirkung und Einsatz der GLP-1 RA (Lira-, Sema-, Dulaglutide) bei einem T2DM. Es besteht ohne ASCVD resp. TOD bei einem 10-Jahresrisko ≥10% eine IIb-Indikation. Bei einer CKD wird das cv Risiko und eine Makro-Albuminurie gesenkt; zusätzlich kann die diabetische Stoffwechsellage verbessert werden. Sie können auch bei einer eingeschränkten Nierenfunktion eingesetzt werden – eGFR >15ml/min/1.73m2. Nephroprotektiv bez. eGFR-Verlust sind Semaglutid/Liraglutid bei einem T2DM vor allem bei einer eGFR von 30-60ml/ min/1.73m2. Kaum Hypoglykämien. Keine Kombination mit einem DPP-4-Hemmer bei ähnlichem Wirkprinzip.
Ein sehr aktuelles Einsatzgebiet ist die Adipositas (IIa) bei einem BMI von 30 oder ≥27 kg/m2 mit gewichtsadaptierten Komorbiditäten. Sind doch von der Adipositas weltweit mehr als 50% der Menschen betroffen. Es kommt bei einem GLP-1 RA in hohen Dosen je nach Substanz zu einer signifikanten Gewichtsreduktion. Dieses Medikament soll wie der SGLT2-H. unabhängig vom HbA1c bei einem sehr hohen als auch bei einem hohen cv-Risiko eingesetzt werden: T2DM + ASCVD oder schwere TOD oder 10 Jahres Risiko ≥20% Score2-Diabetes; T2DM und ein 10 Jahres Risiko von 10-<20% (IA). Bei einem BMI ≥35 kann nach erfolglosen konservativen Massnahmen inkl. einem GLP-1 RA die bariatrische Chirurgie diskutiert werden.
Die gastrointestinalen Nebenwirkungen Übelkeit, Erbrechen, Völlegefühl, Obstipation und Durchfall sind zu beachten, daher muss die Dosierung langsam wöchentlich (Liraglutid 1x tgl. s.c.) oder monatlich (Semaglutid, Dulaglutide 1x wö s.c.) auftitriert werden. Seltene NW sind eine akute Pankreatitis, ein Darmverschluss und eine Gastroparese (cave Narkose: 7 Tage Pause) mit einer Wahrscheinlichkeit von <1-2%/pro Jahr Anwendung. Diese NW treten vor allem bei der Adipositastherapie auf, wo deutlich höhere Dosen verwendet werden, als bei der glykämischen Kontrolle. Auch werden mehr diabetische Retinopathie Komplikationen berichtet. Durch die Gewichtsreduktion mehr Gallensteine. Unklar ist heute noch eine evtl. erhöhte Depressionsrate resp. Suizidalität, welche in wenigen Fällen unter Semaglutid beobachtet wurde. Bei einer positiven Familienanamnese bezüglich medullärem Schilddrüsenkarzinom resp. MEN 2 ist eine Verordnung kontraindiziert.
In der STEP-HFpEF Studie konnte mit einem GLP-1 RA bei einer HI mit erhaltener EF (>50%) und einer Adipositas (BMI ≥30kg/m2) neben einer Gewichtsreduktion, eine Verbesserung der HI-Symptome und eine Verbesserung der körperlichen Einschränkung, der Lebensqualität und eine CRP-Senkung erzielt werden (12).
In der aktuellen SELECT-Studie, welche am diesjährigen AHA Kongress im November vorgestellt wurde, zeigte sich erstmals unter einer gewichtsreduzierenden Behandlung mit 2,4mg Semaglutid 1x wö s.c. bei 8803 kardiovaskulären übergewichtigen/adipösen (BMI ≥27) Risikopatienten (3/4 MI, 1/4 HI) ohne T2DM eine signifikante Reduktion des primären Endpunktes (cv Tod, nicht tödlicher Infarkt/Schlaganfall) von -20%, Gesamtsterblichkeit -19%, NNT: 67. Die kardio-metabolischen Parameter (KG -9,4%, BD, Taille, HbA1c, Lipide) wurden verbessert: das hs-CRP sank um 39,1% (13). Die Studie identifiziert erstmals Adipositas als einen behandelbaren kardiovaskulären Risikofaktor. Die Reduktion von Tod, Herzinfarkt und Schlaganfall durch Semaglutid wurde, zusätzlich zu einer guten leitliniengerechten Therapie, beobachtet. Interessant ist, dass diese MACE-Reduktion in der Sekundärprävention bereits vor der erheblichen Gewichtsreduktion einsetzte; dies könnte bedeuten, dass noch andere Mechanismen dafür verantwortlich sind. Dies zeigte sich auch bei tieferer Dosis in der SUSTAIN-6-Studie bei diabetischen Patienten mit hohem cv Risiko über 2 Jahre – cv Ereignisse -26%. Als NW traten gastro-intestinale Beschwerden in SELECT in 10% vs 2,0% auf. Die Follow-up-Dauer betrug im Mittel 40 Monate. Positive Wirkung in allen Subgruppen, auch auf den Nierenendpunkt.
GLP-1 RA + SGLT2-H. führen in der Kombination zu einer stärkeren Gewichts- und BD-Reduktion. Bezüglich renalem und cv Outcome gibt es keinen zusätzlichen Effekt. Ihr Einsatz ist unabhängig vom HbA1c und weiteren Antidiabetika.
Glukose senkende Medikamente mit cv Benefit
In den neuen Guidelines wird ein besonderes Augenmerk auf den Aspekt des nachgewiesenen cv Nutzens und/oder der Sicherheit von blutzuckersenkenden Medikamenten gelegt! Es wird empfohlen, die Therapie auf solche Medikamente umzustellen (IC). Vgl. Abbildung 3.
Metformin: sollte bei einem T2DM und einer ASCVD berücksichtigt werden (IIa). Die Nüchternglukose Produktion in der Leber wird gehemmt. Kaum Hypoglykämie-Risiko. Es kommt nach mehreren Studien zu einer nicht signifikanten Veränderung bez. cv Tod und Myokardinfarkt. Ohne ASCVD oder TOD hat das Medikament je nach cv Risiko eine IIa/IIb Indikation. Einschleichend dosieren wegen GI-NW. Kontraindiziert bei: einer CKD mit einer eGFR <30ml/min/1.73m2, perioperativ, periinterventionell bei i.v. Kontrastmittelgabe und bei ausgeprägter Gewebshypoxie. Neutraler Effekt bei HI.
Pioglitazon: kann als weiteres Antidiabetikum bei einem T2DM und einer ASCVD berücksichtigt werden (IIb). Es erhöht die Insulinsensitivität des Fett-, Muskel- und Lebergewebes. Cave Gewichts-anstieg, HI, Verminderung der Knochendichte.
Kardial sicher sind die Sulfonylharnstoffe Glimepirid und Gliclazid, die DPP-4-H. Sitagliptin und Linagliptin sowie die modernen langwirkenden Insuline (Glargine, Degludec). Bei einer HI kontraindiziert sind Pioglitazon, Rosiglitazon und der DDP-4-H. Saxagliptin. GLP-1 RA, haben einen neutralen Effekt bez. HI und dadurch eine IIa Indikation. HbA1c Ziel nach Komorbiditäten, Diabetes-Dauer, Lebenserwartung, prinzipiell <7%; Cave: Hypoglykämien.
Antithrombotische Therapie
Ein DM erhöht die Atherothrombose über folgende Mechanismen: Entzündung, oxidativer Stress, Eiweiss Glykation, Endotheldysfunktion und verminderte NO-Synthese, vermehrter Plättchenturnover und Aggregation und eine verstärkte Prokoagulation und verminderte Fibrinbildung. Das Blutungsrisiko ist bei einem T2DM unter Aspirin etwas tiefer, das Thromboserisiko dafür aber erhöht. Dies gilt auch bei Übergewicht und einem metabolischen Syndrom. Dieser Umstand muss in der Sekundärprävention berücksichtigt werden.
Primärprävention: Bei einem T2DM mit einer blanden Anamnese bez. ASCVD/ Revaskularisation besteht u.a. nach dem ASCEND-Trial (14) ohne KI für Aspirin (GI-Blutungen in Anamnese, Leberleiden, Allergie) ein leichter Vorteil in der Verhinderung eines vaskulären Events über 7,4 Jahre. Es zeigt sich aber in dieser Studie und in zwei Metaanalysen eine deutlich erhöhte Blutungsrate. Die absoluten Vorteile wurden durch die Blutungsgefahr weitgehend aufgewogen. Das erhöhte Blutungsrisiko (GI, intrazerebral) unter Aspirin muss gegen den kleinen Vorteil von etwas weniger Myokardinfarkte in der Abwägung berücksichtigt werden. Die Vorteile der Abgabe von Aspirin rechtfertigen aber meist nicht das Risiko einer Blutung. Daher in der Primärprävention eher kein Aspirin bei einem T2DM! Dies widerspiegelt sich auch in den neuen Guidelines mit einer IIb A Indikation – kann ohne eine KI erwogen werden (schwächster Empfehlungsgrad). Es sollte aber ein Statin nach individuellem Risikoprofil (z.B. Plaques) und entsprechendem LDL-Zielwert (≤1,8mmol/l) bei diesen Patienten eingesetzt werden.
Sekundärprävention: Hier hat Aspirin eine IA-, Clopidogrel eine IB-Indikation. Dies bei einem T2DM und Status nach Infarkt, CCS oder Revaskularisation, bei einer CKD mit ASCVD und bei einem T2DM und einer PAVK ohne Indikation für eine OAK.
In neueren Studien wird die Gabe eines P2Y12-Hemmers wie Clopido-grel oder Ticagrelor favorisiert. Clopidogrel hat auch ein kleineres spontanes Blutungsrisiko als Aspirin. In den Guidelines hat Clopidogrel bei einer Aspirin-Intoleranz eine IB-Indikation, bei einer etablierten ASCVD als Alternative noch eine IIbA-Indikation. Bei ca. 40% der Patienten besteht eine hohe Variabilität in der Medikamentenaktivierung (Prodrug) resp. in der Plättchenhemmung.
Nach einer Revaskularisation bei ACS od. CCS findet man in den Guidelines ein instruktives Slide betreffend Art und Länge der antithrombotischen dualen Therapie (12 resp. 6 Monate). Diese richtet sich nach der Art der Intervention, dem Ischämie- resp. Blutungsrisiko.
Eine Verkürzung oder Herabsetzung der DAPT auf Clopidogrel sollte bei Patienten mit Diabetes nach ACS vermieden werden, da diese ein hohes kardiovaskuläres Risiko aufweisen. Unter Clopidogrel bestehen zu wenig Wirksamkeitsdaten und eine schlechtere Bioverfügbarkeit.
Bei Patienten mit generalisierter Atherosklerose (polyvascular) und einem hohen Risiko für eine Ischämie oder einen Schlaganfall und niederem Blutungsrisiko sollte die zusätzliche Gabe von 2x tgl. 2,5mg Rivaroxaban auf Grund der COMPASS Studie berücksichtigt werden – HR für cv Tod, Apoplexie, MI =0,76 (IIaB) (15).
Patienten mit symptomatischer ASCVD und/oder Revaskularisierung mit einer Indikation für eine Langzeit-OAK profitieren ebenfalls von einem Plättchenhemmer. Dabei muss das Blutungsrisiko beachtet werden. Bezüglich Triple-Therapie (Hospitalisationszeit) resp. Dualer Pathway Inhibition (DPI) (Clopidogrel + NOAK) bei VHFLI und ASCVD mit PCI – vergleiche Guidelines.
Magenschutz: mit Pantoprazol. Bei einer antithrombotischen Kombinationstherapie IA, bei einem Medikament alleine IIaA. Bei Gabe von Clopidogrel cave: Interaktion mit Omeprazol und Esomeprazol mit verminderter Wirksamkeit an den Thrombocyten. Es besteht dafür eine Kontraindikation.
Lipidtherapie
LDL-Senkung je nach cv Risiko (T2DM + ASCVD, TOD, od. Score2-D) – vgl. (1). Sehr hoch <1,4/hoch <1,8/moderat <2,6mmol/l. Bei einem Wert >2,6mmol/l potentes Statin in Kombination mit Ezetrol, i.R. Bempedoinsäure, PCSK9-H. oder PCSK9-Synthese H. LDL-Senkung auch bei einer CKD. Bei einer eGFR <60ml/min/1.73m2: LDL-Ziel <1,8 mmol/l, bei einer eGFR ≤ 30ml/min/1.73m2 oder ≤30-44ml/min/1.73m2 und einer UACR ≥30mg/g: LDL-Ziel <1,4 mmol/l, wie bei einer CHK.
Herzinsuffizienz und T2DM
Bei einem T2DM besteht ein deutlich höheres Risiko für eine HI. Diese kann auch deutlich schneller auftreten. Daher ist eine regelmässige Suche mit Anamnese und Frage nach Symptomen sehr wichtig (IA). Hilfreich ist dabei der Biomaker NT-pro-BNP (≥ 125pg/ml im SR, ≥ 365pg/ml im VHFLI), ein Ruhe-EKG, allenfalls ein Thorax-Rö, ein Routinelabor inkl. TSH, Ferritin und Transferrin-Sättigung und ein transthorakales Echo. Dieses HI Screening hat eine IC-Indikation.
SGLT2-H., ARNI/ACE-H., Betablocker und MRA gehören nach den ESC-Guidelines 2021 zu den «fantastic four» der medikamentösen HI-Basis-Therapie bei einer LV-EF <40% (HFrEF) (10). Es zeigt sich auch ein deutlicher Benefit der SGLT2-H. bezüglich Mortalität und Hospitalisation wegen HI mit einer LV-EF >40% (HFmrEF) und einer LV-EF >50% (HFpEF) (11). Die SGLT2-H. Dapa- und Empagliflozin haben auf Grund der grossen cv Outcome Studien mit Senkung des cv Todes und der HI-Hospitalisationen eine IA-Indikation.
Koronare Herzkrankheit und T2DM
Eine Revaskularisation sollte bei Angina pectoris trotz medikamentöser Therapie und bei einer Ischämie >10% des LV durchgeführt werden. Auch bei einem STEMI und einer Mehrgefässerkrankung ist diese indiziert. Bei einer komplexen CHK ist eine ACBP zu bevorzugen. Bei allen ACS-Patienten muss ein T2DM ausgeschlossen werden. Eine Blutzuckertherapie soll mit Medikamenten mit einem cv Benefit durchgeführt werden – SGLT2-H. u./od. GLP-1 RA. Metformin sollte berücksichtigt werden (IIa).
Arrhythmien und T2DM
Gelegenheitsscreening bzgl. VHFLI ab 65 Jahren (IB). Ein Vorhofflimmern muss bei T2DM Patienten <65 Jahre bei weiteren cv Risikofaktoren gesucht werden, da dieses in dieser Population häufiger auftritt (IC). Ein systematisches Screening ist bei Personen ≥75 Jahre oder bei einem hohen cv Risiko und bei einem erhöhten Strokerisiko sinnvoll (IIaB).
Chronische Niereninsuffizienz (CKD) und T2DM
Die Niereninsuffizienz ist aufgrund der cv Mortalität ein «silent killer». Die 5-Jahres-Todeswahrscheinlichkeit liegt bei 33%, für eine Dialyse bei 12%. Bei einem T2DM mit CKD und einer Albuminurie (≥30mg/g, A2/A3) besteht eine stark erhöhte 10 Jahres Inzidenz von >40% bez. cv Mortalität. Leider wird diese Erkrankung von Ärzten und Patienten zu wenig und zu spät erkannt. Diabetiker müssen regelmässig auf eine CKD gescreent werden: eGFR EPI und UACR im morgendlichen Spontanurin (IA).
Auch hier ergeben sich einige Neuerungen: Auf Grund der bahnbrechenden Studien DAPA-CKD 2020 und EMPA-KIDNEY 2022 (8,9) sind SGLT2-H. bei einer CKD, unabhängig von kardiovaskulären Erkrankungen oder T2DM, mit einer eGFR <60ml/min/1.73m2 und oder einer Albuminurie klar indiziert. Cana-, Dapa- und Empagliflozin sind nephroprotektiv. Unter diesen Medikamenten kommt es zu einer deutlich verzögerten Abnahme der GFR und zu einer sign. Abnahme der Mikro-/Albuminurie. Die SGLT2-H. können ab einer eGFR ≥20ml/min/1.73m2 eingesetzt werden.
Auch kardiovaskulär kommt es bei Dapa- und Empagliflozin zu einer deutlich protektiven Wirkung: RRR bei Dapagliflozin -29 % für den kombinierten Endpunkt Klinikeinweisung wegen HI und kardiovaskulärer Tod. Bei Empagliflozin ein geringeres Fortschreiten der Niereninsuffizienz resp. des kardiovaskulären Todes von 28%. SGLT2-H. werden zur HI-Prävention bei Patienten mit CKD und/oder T2DM empfohlen. Auch ohne T2DM haben die beiden SGLT2-H. einen vollen Nutzen bei einer CKD (1). Man sollte möglichst früh mit diesem Medikament beginnen.
Finerenon bei DKD
Ein weiteres neues nephro- und kardioprotektives Medikament bei einer diabetischen Nephropathie (DKD), bei gleichzeitigem Einsatz eines ACE-H./ARB, ist Finerenon. Dieses verhindert eine pro-fibrotische und proinflammatorische Genexpression. Einsatz: vgl. Abbildung 1.
In der FIDELIO-DKD und FIGARO-DKD Studie wird der positive Nutzen von primär 10 dann 20mg Finerenon, einem neuen nicht steroidalen Mineralokortikoid-Rezeptor-Antagonist (ns MRA) mit deutlich selektiverer Rezeptor-Bindung, bei einer DKD bis zu einer eGFR ≥25ml/min und einer Urin-Albumin-Kreatinin-Ratio (UACR) ≥30mg/g (A2) unter RAAS-Hemmung, einem Statin und einem Serumkalium ≤4,8mmol/l, bei 13026 Patienten mit einem Durchschnittsalter von 65 Jahren, klar bewiesen – verzögerte Progression der CKD oder renaler Tod und weniger cv Ereignisse (cv Tod, nicht fataler MI und Stroke und Hospitalisierung wegen HI) (16,17). Klinische Endpunktdaten zu Finerenon bestehen aktuell ausschliesslich für die DKD. Typische NW der älteren steroidalen MRA’s wie eine Gynäkomastie oder eine Hyperkaliämie können vermieden werden. Trotzdem sollte auch bei Finerenon eine Kaliumkontrolle erfolgen – eine Hyperkaliämie wurde in der FIDELITY Studie, welche obige beiden Studien zusammenfasste, in 1.7% nachgewiesen. Das Serumkalium darf bei Therapiebeginn nicht ≥4,8 mmol/l betragen; engmaschige Kontrollen sind wichtig. Stopp bei ≥5,5mmol/l.
Senkung des renalen Endpunkts um 23%, Dialyse um 20%; des cv Endpunkts um 14%, HI-Hospitalisationen um 22%. NNT über 3 Jahre von 60. Ein Albuminurie Screening lohnte sich um diese Risiken zu senken, hatten doch 40% dieser Patienten eine eGFR von ≥60ml/min/1.73m2 (18). Finerenon on top der Standardtherapie reduziert das Risiko von cv und renalen Endpunkten bei Patienten mit einem T2DM über ein sehr breites Spektrum der DKD. Die Substanz ist aktuell bei einem CKD-Stadium 3 oder 4 ohne T2DM noch nicht zugelassen – vgl. Abbildung 4.
Bei einer moderaten bis schweren CKD bedarf es einer Behandlung eines: Vit. D-Mangels, einer renalen Anämie, einer Azidose und einer Hyperphosphatämie durch den Nephrologen.
Summary
Gemäss der KDIGO-2022- (4), der ESC- und ESH-2023- (1,19) und den ADA-2023-Leitlinien (20) haben wir 2024 bei einer CKD ± einem T2DM eine kardiorenale organoprotektive Therapie. Diese besteht aus einem gesunden Lebensstil, einer mediterranen Ernährung (viel Obst, Gemüse, Kalium >3,5g/die, wenig rotes Fleisch), Eiweiss 0,6-0,8g/kg/die, wenig Kochsalz (<5g/die), einer Gewichtsreduktion, einer Blutzucker- (HbA1c <7%) und BD-Normalisierung (120-130/70-80mmHg) nach biol. Alter, einer Statin-/Ezetimib-Therapie mit einem LDL-Ziel <1,4mmol/l und aktuell 4 medikamentösen Säulen und einem regelmässigen körperlichen Fitnesstraining:
► SGLT2-Hemmer: bei T2DM ± Atherosklerose; HI; CKD eGFR ≥20ml/min/1.73m2; Fortsetzung SGLT2-H. bis zur
Dialyse; evtl. mit Metformin sofern eGFR ≥30ml/min/1.73m2 (Dosisanpassung)
► ACE-H./ARB: bei Diabetes; Hypertonie (>130/80mmHg); CKD mit Albuminurie >30mg/g (A2); BD-Selbstkontrolle, 24h-BD; cave: maskierte Hypertonie; wenn möglich max. zugelassene Dosis. Bei Hypertonie Fixkombinationen mit CCB/Diuretika, BD <130/80 mmHg bei Proteinurie; i.R. MRA
► Finerenon, ns MRA: bei T2DM + CKD und einer persistierenden Albuminurie ≥300mg/g bei eGFR: >60 (A3) oder >30mg/g bei eGFR: 25-60 ml/min/1.73m2 (A2) trotz RAAS-H.
Serum Kalium ≤4,8mmol/l, eGFR ≥25ml/min/1.73m2
► GLP-1 RA: bei T2DM ± Atherosklerose, CKD bei zu hohen Bz-Werten, trotz SGLT2-H./Metformin (eGFR ≥30ml/min/1.73m2); GLP-1 RA eGFR >15ml/min/1.73m2, evtl. weitere Bz senkende Medikamente. Gew. reduktion, zusätzliche Senkung des cv Risikos und Senkung einer Albuminurie durch GLP-1 RA.
► Exercise Training: bei allen Patienten; Ausmass je nach Komorbiditäten. Wenn möglich mind. 150min./Woche bei mittlerer Intensität (50-70% max. HF), verteilt auf 3 Tage mit nicht mehr als 2 Tage Pause, zusätzlich 2x wöchentlich leichtes Krafttraining.
Wir können mit den RAAS-Hemmern in ausreichender Dosierung und den drei neuen Substanzen: SGLT2-H., GLP-1 RA und Finerenon das kardiovaskuläre und renale Risiko deutlich senken und so eine evidenzbasierte personenzentrierte Therapie nach den neuen internationalen Guidelines einleiten (1,4,18,19). Die Zukunft wird hier weitere Erkenntnisse (u.a. 6 medikamentöse Säulen) bringen.
Copyright bei Aerzteverlag medinfo AG
Zweitabdruck aus «info@herz+gefäss» 02/03-2024
Ärztlicher Direktor
Chefarzt Kardiologie
Hochgebirgsklinik Davos
Herman-Burchard-Strasse 1
7265 Davos Wolfgang
jan.vontobel@hgk.ch
Zelglistrasse 17
8127 Forch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Marx N. et al., 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes, European Heart Journal (2023) 00, 1–98, https://doi.org/10.1093/eurheartj/ehad192
2. Buchmann N. et al., Der koronarkranke Diabetiker: moderne Therapieansätze und Behandlungspfade, Aktuel Kardiol 2023 ;12 :137-142
3. KDIGO, Kidney Int Suppl 2013;3: 112-119
4. KDIGO, Kidney Int Suppl 2022; Clinical Practice Guideline for Diabetes Managment in CKD, Kidney International 2022;102 (suppl.5 S): S1-S127
5. Yanai H. et al., Exercise Therapy for Patients with Type 2 Diabetes: A Narrative Review, J Clin Med Res 2018; 10(5): 365-369
6. Dürst U., SGLT2-H. in der Therapie, Teil 1 Herzinsuffizienz, Der informierte Arzt, Sept. 2023
7. Dürst U., SGLT2-H. in der Therapie, Teil 2 Niereninsuffizienz, Der informierte Arzt, Nov.2023
8. Heerspink HJL. et al., Dapagliflozin in Patients with Chronic Kidney Disease, DAPA-CKD, N Engl J Med 2020 Oct 8 ;383(15):1436-1446
9. Herrington WG. et al., Empagliflozin in Patients with Chronic Kidney Disease, EMPA KIDNEY, N Engl J Med 2022; 388:117-127
10. McDonagh TA. et al., Heart Failure Guidelines ESC 2021; EHJ 2021 Sep 21;42(36):3599-3726
11. Mc Donagh Th.A. et al., 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure, European Heart Journal (2023) 00, 1–13, https://doi.org/10.1093/eurheartj/ehad195
12. Kosiborod MN et al., Semaglutide in patients with heart failure with preserved ejection fraction and obesity, 25. August 2023 DOI: 10.1056/NEJMoa2306963
13. Lincoff AM et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023 Nov 11. doi: 10.1056/NEJMoa2307563. Epub ahead of print. PMID: 37952131
14. ASCEND Trial, Effects of aspirin for primary prevention in persons with diabetes mellitus, N Engl J Med 2018; 379:1529-1539
15. Eikelboom J.W. et al., Rivaroxaban with or without aspirin in stable cardiovascular disease, COMPASS Trial, N Engl J Med 2017; 377:1319-1330
16. Bakris GL. et al., Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes, FIDELIO DKD, N Engl J Med 2020 Dec 3;383(23):2219-2229
17. Pitt B. et al., Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes, FIGARO DKD, N Engl J Med 2021;385 :2252-2263
18. Agarwal R et al., Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis, Eur Heart J 2022 Feb. 10;43(6):474-484
19. Mancia G et al., ESH Guidelines 2023, J Hypertens 2023, Jun 21
20. American Diabetes Association, Diabetes care 2023;46(Suppl 1): S 191-S 202