Herz-Kreislauf-Erkrankungen stellen weltweit die häufigste Todesursache dar (1). Eine gesunde Lebensweise und insbesondere eine Anpassung der Ernährungsgewohnheiten sind ein wesentlicher Bestandteil bei der Vorbeugung und Behandlung der koronaren Herzerkrankung (2). Trotz der grossen Relevanz von Ernährungs-assoziierten Faktoren in der Pathogenese der koronaren Herzerkrankung sind eine routinemässige Erfassung des Ernährungsstatus sowie eine strukturierte Beratung hinsichtlich präventiver Ernährungsinterventionen durch geschultes Fachpersonal in vielen Institutionen nicht etabliert. In diesem Artikel werden die Zusammenhänge von Ernährungsfaktoren im Rahmen der koronaren Herzerkrankung erläutert sowie aktuelle Empfehlungen zum Gewichtsmanagement und zu einzelnen Nahrungsmitteln hinsichtlich der kardiovaskulären Prävention dargestellt.
Cardiovascular diseases are the most common cause of death worldwide (1). A healthy lifestyle and, in particular, changes to dietary habits are an essential part of the prevention and treatment of coronary heart disease (2). Despite the great relevance of nutrition-related factors in the pathogenesis of coronary heart disease, routine assessment of nutritional status and structured counselling on preventive nutritional interventions by trained professionals is not established in many institutions. This article explains the links between dietary factors and coronary heart disease and presents current recommendations on weight management and individual foods with regard to cardiovascular prevention.
Keywords: Koronare Herzerkrankung (KHK), Atherosklerose, Übergewicht, Adipositas, herzgesunde Ernährung
Einfluss der Ernährung auf atherosklerotische Prozesse
Die Atherosklerose ist gekennzeichnet durch chronische inflammatorische Prozesse innerhalb der Gefässwände, die zu einer zunehmenden Funktionsstörung des Endothels, Lipideinlagerungen und Plaquebildungen führen. Eine übermässige Nahrungsaufnahme mit Ansammlung von metabolisch ungünstigem Fettgewebe im Körper sowie westliche Ernährungsmuster tragen zu einer chronischen Sekretion von proinflammatorischen Zytokinen im Körper bei (3, 4). Hingegen zeigen Studien, dass bestimmte, eher pflanzlich-betonte Ernährungsmuster mit niedrigeren Entzündungsmarkern im Blut einhergehen und mit geringeren atherosklerotischen Gefässveränderungen assoziiert sind (5, 6, 7). Insbesondere eine mediterrane Ernährung scheint sich protektiv hinsichtlich kardiovaskulärer Ereignisse auszuwirken, so dass diese in den aktuellen Leitlinien empfohlen wird (8, 9, 10).
Es ist wichtig zu betonen, dass weniger die Auswahl einzelner Lebensmittel, sondern vielmehr das gesamte Ernährungsmuster eines Individuums einen Einfluss auf die kardiovaskuläre Mortalität zu haben scheint (11). Dementsprechend muss die Anwendung von zeitlich begrenzten Diäten oder die Zufuhr einzelner Nahrungsergänzungsmittel kritisch betrachtet und stattdessen eine langfristige, individuell an Alter, Gewicht, Lebensgewohnheiten und das kardiovaskuläre Risiko angepasste Ernährungsumstellung mit potenziell protektiven Nahrungsbestandteilen angestrebt werden (12).
Übergewicht und Adipositas bei kardiovaskulären Erkrankungen
Das Vorhandensein von Übergewicht (WHO-Definition: BMI 25 bis < 30 kg/m2) oder Adipositas (WHO-Definition: BMI ≥ 30 kg/m2) begünstigt einerseits die Entstehung von kardiovaskulären Risikofaktoren (u. a. arterielle Hypertonie, Dyslipidämie und Typ-2-Diabetes) und ist anderseits auch direkt mit einer erhöhten Wahrscheinlichkeit für kardiovaskuläre Erkrankungen assoziiert (13). Insbesondere das viszerale Fettgewebe trägt, am ehesten durch eine Ausschüttung von proinflammatorischen und proatherogenen Zytokinen, zu einem erhöhten kardiometabolischen Risiko bei (14).
Obwohl Übergewicht und Adipositas prinzipiell durch ein Ungleichgewicht zwischen Energiezufuhr und Energieverbrauch zu erklären sind, sind die Ursachen komplex und multifaktoriell zu betrachten. Sowohl genetische, intrauterine und hormonelle Einflüsse als auch frühkindliche und lebenslange Gewohnheiten können die individuelle Entwicklung von Übergewicht beeinflussen, wobei die Zunahme in den letzten Jahrzehnten stark durch gesellschaftliche Faktoren (z. B. leichter Zugang zu stark verarbeiteten Lebensmitteln, veränderte Essgewohnheiten und vermehrt sitzender Lebensstil) begünstigt wurde (15, 16). Da es insbesondere im Erwachsenenalter schwierig ist, empfohlene Ernährungsinterventionen langfristig aufrechtzuerhalten und kalorienreduzierte Diäten häufig mit einer erneuten Gewichtszunahme einhergehen, sollte in der Gesellschaft die Prävention von Übergewicht und Adipositas bereits in frühen Lebensjahren im Vordergrund stehen. Ansätze zur Gewichtsreduktion bei erwachsenen Patienten umfassen eine Kombination aus regelmässiger körperlicher Aktivität, quantitativen und qualitativen Anpassungen der Ernährungsgewohnheiten und allenfalls psychologischen Interventionen, die je nach Ausprägung der angestrebten Gewichtsreduktion mit pharmakologischen oder bariatrischen Verfahren ergänzt werden können (2).
Diätetische Interventionen zur Gewichtsreduktion zielen meist auf eine reduzierte Kalorienzufuhr mit einem Energiedefizit von 500-750 kcal/Tag ab, die jedoch an das individuelle Körpergewicht und an vorliegende Begleiterkrankungen angepasst werden müssen (17). Dies kann durch verschiedene Strategien, wie z. B. durch eine Verkleinerung der Portionsgrösse, Vermeidung von ungesunden Zwischenmahlzeiten, Reduktion von freiem Zucker und hochverarbeiteten Lebensmitteln sowie durch eine Verringerung des Alkoholkonsums erzielt werden. Die Erhöhung des Proteingehaltes (1,0–1,2 g pro kg Körpergewicht) trägt zu einem verstärkten Sättigungsgefühl und zur Vermeidung eines Muskelverlustes (in Kombination mit körperlicher Aktivität) bei (18). In der SELECT-Studie konnte zudem durch eine pharmakologisch induzierte Gewichtsreduktion mittels GLP1-Rezeptoragonisten (Semaglutid) bei Patienten mit einem BMI ≥27 kg/m2 und bereits bestehender kardiovaskulärer Erkrankung das Risiko eines unerwünschten kardiovaskulären Ereignisses (Tod durch Herz-Kreislaufversagen, Herzinfarkt oder Schlaganfall) signifikant reduziert werden, wobei diese Effekte nicht allein auf die Gewichtsreduktion zurückzuführen sind (19).
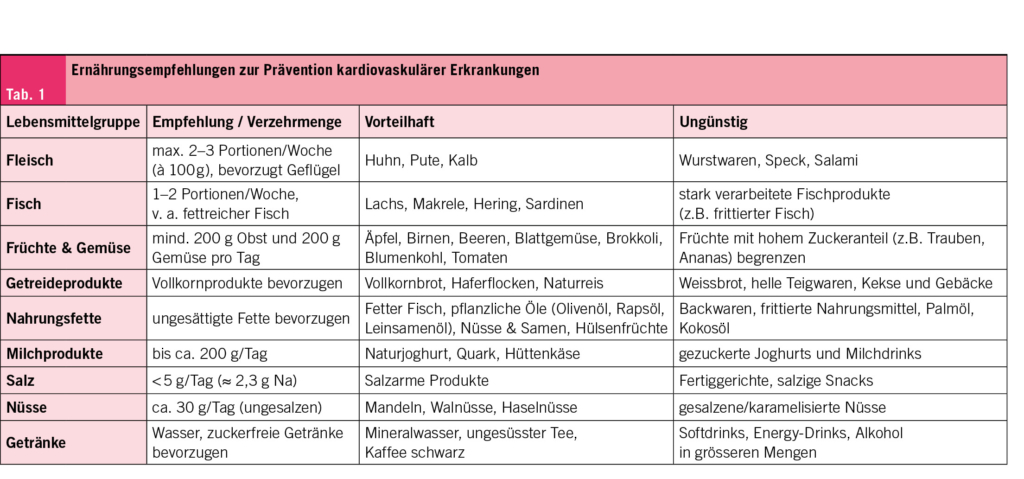
Ernährungsempfehlungen zur Prävention von kardiovaskulären Erkrankungen
Fleisch und Fisch
In einigen Metaanalysen prospektiver Beobachtungsstudien konnte eine erhöhte kardiovaskuläre Mortalität bei vermehrtem Fleischkonsum aufgezeigt werden, wobei eine starke Heterogenität in den Studienergebnissen zu beobachten ist (20, 21). Diese Heterogenität ist am ehesten aufgrund der Tatsache zu erklären, dass einerseits zwischen verschiedenen Fleischsorten mit unterschiedlichem Fett- und Eisengehalt sowie andererseits zwischen verschiedenen Verarbeitungsprozessen des Fleisches, vor allem durch Einsatz von Konservierungsstoffen wie Salz, Nitrit- und Nitratzusätzen, unterschieden werden muss. Insbesondere der Konsum von verarbeitetem Fleisch (z. B. Speck, Wurst, Salami) zeigt eine starke Assoziation mit kardiovaskulären Endpunkten, während unverarbeitetes «rotes Fleisch» (z. B. Rind- oder Schweinfleisch) eine weniger eindeutige und «weisses Fleisch» (z. B. Hühnchen- oder Truthahnfleisch) keine signifikante Assoziation bezüglich der kardiovaskulären Mortalität aufweist (22, 23, 24). Basierend auf diesen Erkenntnissen wird derzeit ein Fleischkonsum nur in moderaten Mengen (zwei bis drei Portionen je 100 g pro Woche), bevorzugt als möglichst unverarbeitetes und «weisses» Fleisch, empfohlen (25).
Ein regelmässiger Fischverzehr ist hingegen mit einer signifikant verringerten Inzidenz und Mortalität für Herz-Kreislauf-Erkrankungen verbunden, wobei auch diesbezüglich regionale Unterschiede aufgrund verschiedener Fischsorten, Zubereitungsprozesse und einer möglichen Kontamination mit Schadstoffen diskutiert werden (24, 26, 27). Die Vorteile des Fischkonsums im Hinblick auf die Prävention von Atherosklerose werden im Allgemeinen auf den höheren Gehalt an langkettigen Omega-3-Fettsäuren in fettreichen Fischen (z. B. Lachs, Hering, Makrele) zurückgeführt. Als Mechanismen für die protektiven Effekte der Omega-3-Fettsäuren, zu denen unter anderem die Eicosapentaensäure (EPA) und Docosahexaensäure (DHA) gehören, werden eine Optimierung des Lipidprofils, eine verbesserte Endothelfunktion und Plaquestabilität sowie eine Modulation von inflammatorischen und immunologischen Prozessen diskutiert (28, 29). Der tatsächliche Effekt der Omega-3-Fettsäuren auf kardiovaskuläre Ereignisse in der klinischen Praxis und insbesondere die Empfehlung einer zusätzlichen Supplementation wird jedoch weiterhin kontrovers diskutiert (30, 31, 32). In den aktuellen europäischen Leitlinien der Kardiologie wird daher ein Fischkonsum von ein bis zwei Portionen pro Woche empfohlen (10). Ein noch höherer Fischkonsum muss auch aus Gründen der Nachhaltigkeit angesichts der weltweiten Überfischung der Meere kritisch hinterfragt werden. Die zusätzliche Supplementierung von Omega-3-Fettsäuren (in Form von 2 x 2 g Icosapent-Ethyl) kann hingegen bei Patienten mit hohem kardiovaskulärem Risiko und erhöhten Triglyceridwerten (>1.5 mmol/L bzw. 135 mg/dl) trotz Statintherapie erwogen werden (10).
Gemüse und Früchte
Der Konsum von Obst und Gemüse ist dosisabhängig mit einem signifikant niedrigeren Risiko für kardiovaskuläre Ereignisse assoziiert (23, 33, 34). Bei häufigem Verzehr von Obst ist jedoch eine erhöhte Kalorienaufnahme durch einzelne Obstsorten mit hohem Anteil an schnell resorbierbaren Kohlenhydraten (z. B. Trauben, Ananas) zu vermeiden. Die vorteilhaften Effekte von Obst und Gemüse werden vorwiegend auf ihren hohen Ballaststoffgehalt und die enthaltenen Polyphenole zurückgeführt, welche günstige Auswirkungen auf den Glukose- und Lipidstoffwechsel sowie antioxidative und entzündungshemmende Eigenschaften aufweisen (35). In den Empfehlungen der europäischen Gesellschaft für Kardiologie wird der Verzehr von jeweils mindestens 200 g Obst und Gemüse pro Tag empfohlen (10).
Vollkornprodukte und Hülsenfrüchte
Der Konsum von raffinierten Getreideprodukten, die einen hohen glykämischen Index aufweisen (z. B. Weissmehlprodukte), ist mit einem gesteigerten Atheroskleroserisiko assoziiert (36). Hingegen wirkt sich der Ersatz der raffinierten Kohlenhydrate durch Vollkornprodukte aufgrund des erhöhten Nahrungsfasergehaltes, der Dichte an gesunden Nährstoffen (u. a. Vitamine, Spurenelemente) sowie der vorteilhaften postprandialen Effekte, günstig auf das metabolische und kardiovaskuläre Risiko aus (23, 37). Des Weiteren ist auch der regelmässige Verzehr von Hülsenfrüchten, die neben einem hohen Gehalt an Proteinen und Nahrungsfasern zusätzliche sekundäre Pflanzenstoffe beinhalten, mit einer Reduktion des kardiovaskulären Risikos verbunden (25, 38, 39). In den Leitlinien der europäischen Gesellschaft für Kardiologie wird die erhöhte Zufuhr von Nahrungsfasern (30 – 45 g pro Tag) mit Hilfe von Vollkornprodukten, Hülsenfrüchten sowie Obst und Gemüse empfohlen (10).
Nahrungsfette
In Bezug auf das kardiovaskuläre Risiko scheint mehr die Zusammensetzung der Nahrungsfette als die absolute Menge in der Ernährung von Bedeutung zu sein. Insbesondere Lebensmittel mit einem hohen Anteil an industriell produzierten Transfettsäuren (z. B. Backwaren, frittierte Nahrungsmittel) sind mit einem höheren Risiko für kardiovaskuläre Erkrankungen und plötzlichen Herztod assoziiert (40). Gesättigte Fettsäuren (v. a. tierische Lebensmittel, wie Fleisch und fettige Milchprodukte) sollten möglichst durch ein- und mehrfach ungesättigte Fette (z. B. fetter Fisch, pflanzliche Öle, Nüsse und Hülsenfrüchte) ersetzt werden (41, 42, 43). Pflanzliche Speiseöle mit einem hohen Anteil an ungesättigten Fettsäuren, wie natives Olivenöl und Leinsamenöl, wirken sich im Gegensatz zu Palm- oder Kokosöl, unter anderem aufgrund des hohen Gehaltes an Öl- und Linolsäure sowie Tocopherol (Vitamin E), vorteilhaft auf das Lipidprofil und kardiovaskuläre Risiko aus (44). Bei Umsetzung einer «fettarmen» Ernährung ist hingegen darauf zu achten, dass dies nicht durch einen erhöhten Anteil an raffinierten Kohlenhydraten kompensiert wird, da dies mit einem erhöhten Risiko für Adipositas, Typ-2-Diabetes und kardiovaskuläre Erkrankungen einhergeht (25).
Milchprodukte und Eier
Aufgrund des hohen Anteils an gesättigten Fettsäuren wurde bis vor wenigen Jahren von fettreichen Milchprodukten in der Ernährung abgeraten. Allerdings enthält diese sehr heterogene Gruppe an Lebensmitteln auch viele vorteilhafte Bestandteile, wie mittelkettige gesättigte Fette, verzweigtkettige Aminosäuren, Vitamin K und Kalzium (45). Sowohl fettreiche als auch fettarme Milchprodukte zeigen bis zu einem Verzehr von 200 g pro Tag keine signifikanten Assoziationen mit dem Auftreten einer koronaren Herzerkrankung (46). Ein moderater Konsum von Milchprodukten, auch mit höherem Fettanteil, ist daher unter Berücksichtigung der Gesamtenergiezufuhr vertretbar (25).
Hinsichtlich des Konsums von Eiern finden sich in den vergangenen Jahren teils widersprüchliche Ergebnisse. In mehreren Metaanalysen konnte durch einen moderaten Verzehr (max. 1 Ei pro Tag) kein signifikant erhöhtes kardiovaskuläres Risiko nachgewiesen werden (47, 48, 49). Hingegen liess sich in Populationen, die bereits eine erhöhte Aufnahme von Nahrungscholesterin und gesättigten Fettsäuren in der Ernährung aufweisen, durchaus eine dosisabhängig gesteigerte kardiovaskuläre Mortalität durch den vermehrten Konsum von Eiern feststellen (50, 51, 52). Eine mögliche Ursache für die heterogenen Ergebnisse können unter anderem auch verschiedene Zubereitungsarten sowie eine individuell variable Reaktion auf diätetisches Cholesterin, insbesondere bei bereits bestehender Hyperlipidämie, sein (53). Zusammenfassend sollte daher eine Begrenzung des Konsums von Eiern, vor allem bei Patienten mit bereits bestehender koronarer Herzerkrankung, diskutiert werden (25).
Salzkonsum
Trotz komplexer physiologischer Zusammenhänge und teils heterogener Studienergebnisse lassen sich durch eine Verringerung des Salzkonsums in der Nahrungsaufnahme positive Auswirkungen auf das kardiovaskuläre System, welche über den Effekt einer Blutdrucksenkung hinausgehen, erkennen (54). In einer vor wenigen Jahren publizierten Metaanalyse aus 24 Kohortenstudien konnte demnach ein linearer Zusammenhang zwischen der Höhe der nutritiven Salzaufnahme und dem Auftreten von kardiovaskulären Erkrankungen nachgewiesen werden (55). Derzeit wird in den Empfehlungen der Kardiologie eine Reduktion des Salzkonsums auf unter 5 g pro Tag (entspricht ca. 2,3 g Natrium) angestrebt, wobei dies in der Regel nur durch den Verzicht auf hochprozessierte Nahrungsmittel in unserer Ernährung zu erreichen ist (10).
Nüsse
Der regelmässige Verzehr von ungesalzenen Nüssen ist in mehreren Studien mit einer Reduktion von Herz-Kreislauf-Erkrankungen assoziiert, so dass eine tägliche Portion (etwa 30 g) empfohlen wird (56, 57). Die positiven Effekte werden unter anderem aufgrund des hohen Gehaltes an Nahrungsfasern, ungesättigten Fettsäuren sowie antioxidativen und antiinflammatorischen Bestandteilen, insbesondere Vitamin E, Polyphenole und Omega-3-Fettsäuren, erklärt (58).
Getränke
Der Konsum von ungezuckerten Kaffee- oder Teeprodukten in moderater Menge (etwa drei Tassen pro Tag) ist anhand der derzeitigen Studienlage mit einer Reduktion des kardiovaskulären Risikos verbunden (59, 60). Der regelmässige Konsum von zuckerhaltigen Getränken (Soft- und Energydrinks) ist hingegen mit einem signifikant erhöhten Risiko für Herz-Kreislauf-Erkrankungen assoziiert (61). Der hohe Fruktosegehalt in diesen Getränken fördert die Triglycerid-Synthese in der Leber und trägt zur Entwicklung von Übergewicht, Dyslipidämie und Insulinresistenz bei (62). Es ist zu erwähnen, dass auch für niedrigkalorische Süssgetränke mit Zuckerersatzstoffen (Light- oder Zero-Getränke) eine leicht erhöhte Inzidenz von kardiovaskulären Erkrankungen festgestellt wurde und diese daher nicht als Alternative empfohlen werden sollten.
Der Zusammenhang zwischen Alkoholkonsum und koronarer Herzerkrankung wird in den letzten Jahren differenzierter betrachtet. Ein häufig postuliertes reduziertes Risiko für kardiovaskuläre Ereignisse durch einen moderaten Alkoholkonsum (sog. J-förmige Beziehung) muss aufgrund von methodischen Mängeln und Verzerrungen in einzelnen Studien mit Vorsicht interpretiert werden (63, 64). In neueren Daten konnten bezogen auf die Gesamtmortalität weder ein sicherer Schwellenwert noch gesundheitliche Vorteile bei einem Konsum von niedrigen Mengen von Alkohol nachgewiesen werden (65, 66, 67). Ein chronisch erhöhter Alkoholkonsum ist stattdessen dosisabhängig sowohl mit ungünstigen kardiovaskulären Effekten als auch mit zahlreichen medizinischen sowie psychischen Folgeerkrankungen assoziiert (67, 68). Dementsprechend sollte Alkohol vorwiegend als Genussmittel, welches in moderaten Mengen unter Einhaltung von «alkoholfreien Tagen» gelegentlich konsumiert werden kann, betrachtet werden (10, 69).
Fazit
In der Kardiologie gewinnt die Berücksichtigung von Übergewicht und Adipositas sowie ernährungsmedizinischen Aspekten in den vergangenen Jahren, nicht zuletzt aufgrund der medikamentösen Möglichkeiten durch GLP1-Rezeptoragonisten zur Gewichtsreduktion, an Bedeutung. Es ist jedoch in der Prävention und langfristigen Therapie der koronaren Herzerkrankung essenziell, dass dies nicht auf eine alleinige medikamentöse Intervention beschränkt bleibt. Zwar ist eine langfristige Umstellung von individuellen Ernährungsgewohnheiten eine grosse Herausforderung, jedoch ist die konsequente Berücksichtigung von Ernährungs-assoziierten Risikofaktoren innerhalb der ärztlichen Konsultation ein wesentliches Element zur Förderung einer nachhaltigen Lebensstilanpassung. Strukturierte Behandlungsabläufe mit Integration ernährungstherapeutischer Massnahmen, Vermittlung von notwendigem Wissen zu Ernährungsfragen sowie eine enge Zusammenarbeit mit den Fachpersonen der Ernährungstherapie sollten fester Bestandteil in der Behandlung der koronaren Herzerkrankung sein.
Copyright
Aerzteverlag medinfo AG
Facharzt Kardiologie und Allgemeine Innere Medizin,
Leitung stationäre kardiovaskuläre Rehabilitation
Zentrum für Rehabilitation & Sportmedizin
Freiburgstrasse 18
3010 Bern
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. WHO. The top 10 causes of death. URL: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death [Stand: 10.11.2024].
2. Koskinas KC, Van Craenenbroeck EM, Antoniades C, et al.; ESC Scientific Document Group. Obesity and cardiovascular disease: an ESC clinical consensus statement. Eur Heart J. 2024 Oct 7;45(38):4063-4098.
3. Polkinghorne MD, West HW, Antoniades C. Adipose Tissue in Cardiovascular Disease: From Basic Science to Clinical Translation. Annu Rev Physiol. 2024 Feb 12;86:175-198.
4. Namazi N, Larijani B, Azadbakht L. Dietary Inflammatory Index and its Association with the Risk of Cardiovascular Diseases, Metabolic Syndrome, and Mortality: A Systematic Review and Meta-Analysis. Horm Metab Res. 2018 May;50(5):345-358
5. Craddock JC, Neale EP, Peoples GE, Probst YC. Vegetarian-Based Dietary Patterns and their Relation with Inflammatory and Immune Biomarkers: A Systematic Review and Meta-Analysis. Adv Nutr. 2019 May 1;10(3):433-451.
6. Ocagli H, Berti G, Rango D, et al. Association of Vegetarian and Vegan Diets with Cardiovascular Health: An Umbrella Review of Meta-Analysis of Observational Studies and Randomized Trials. Nutrients. 2023 Sep 22;15(19):4103.
7. Dybvik JS, Svendsen M, Aune D. Vegetarian and vegan diets and the risk of cardiovascular disease, ischemic heart disease and stroke: a systematic review and meta-analysis of prospective cohort studies. Eur J Nutr. 2023 Feb;62(1):51-69.
8. Estruch R, Ros E, Salas-Salvado J, et al. Primary prevention of cardiovascular disease with a Mediterranean diet supplemented with extra-virgin olive oil or nuts. N Engl J Med 2018;378.
9. Martínez-González MA, Gea A, Ruiz-Canela M. The Mediterranean Diet and Cardiovascular Health. Circ Res. 2019 Mar;124(5):779-798.
10. Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337.
11. Michels KB, Wolk A. A prospective study of variety of healthy foods and mortality in women. Int J Epidemiol. 2002 Aug;31(4):847-54.
12. Suter PM, Darioli R, Noseda G, Schulthess G: Ernährung und kardiovaskuläres Risiko. Kardiovaskuläre Medizin, Ausgabe 7 (2004), 16-25.
13. Caleyachetty R, Thomas GN, Toulis KA, et al. Metabolically Healthy Obese and Incident Cardiovascular Disease Events Among 3.5 Million Men and Women. J Am Coll Cardiol. 2017 Sep 19;70(12):1429-1437.
14. Caleyachetty R, Thomas GN, Toulis KA, et al. Metabolically Healthy Obese and Incident Cardiovascular Disease Events Among 3.5 Million Men and Women. J Am Coll Cardiol. 2017 Sep 19;70(12):1429-1437.
15. Chourdakis, M. ESPEN LLL Nutrition in Obesity, Module 23.2: Obesity: Assessment and Prevention. URL: https://www.espen.org/lll-courses?view=page&course_id=112&page_id =3508 [Stand: 10.11.2024].
16. Blüher M. Obesity: global epidemiology and pathogenesis. Nat Rev Endocrinol. 2019 May;15(5):288-298.
17. Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation. 2014 Jun 24;129(25 Suppl 2):S102-38.
18. Bischoff SC, Ockenga J, Eshraghian A, et al. Practical guideline on obesity care in patients with gastrointestinal and liver diseases – Joint ESPEN/UEG guideline. Clin Nutr. 2023 Jun;42(6):987-1024.
19. Lincoff AM, Brown-Frandsen K, Colhoun HM, et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023 Dec 14;389(24):2221-2232.
20. O’Sullivan TA, Hafekost K, Mitrou F,et al. Food sources of saturated fat and the association with mortality: a meta-analysis. Am J Public Health. 2013 Sep;103(9):e31-42.
21. Zeraatkar D, Han MA, Guyatt GH, et al. Red and Processed Meat Consumption and Risk for All-Cause Mortality and Cardiometabolic Outcomes: A Systematic Review and Meta-analysis of Cohort Studies. Ann Intern Med. 2019 Nov 19;171(10):703-710.
22. Abete I, Romaguera D, Vieira AR, Lopez de Munain A, Norat T. Association between total, processed, red and white meat consumption and all-cause, CVD and IHD mortality: a meta-analysis of cohort studies. Br J Nutr. 2014 Sep 14;112(5):762-75.
23. Bechthold A, Boeing H, Schwedhelm C,et al. Food groups and risk of coronary heart disease, stroke and heart failure: A systematic review and dose-response meta-analysis of prospective studies. Crit Rev Food Sci Nutr. 2019;59(7):1071-1090.
24. Lupoli R, Vitale M, Calabrese I, Giosuè A, Riccardi G, Vaccaro O. White Meat Consumption, All-Cause Mortality, and Cardiovascular Events: A Meta-Analysis of Prospective Cohort Studies. Nutrients. 2021 Feb 20;13(2):676.
25. Riccardi G, Giosuè A, Calabrese I, Vaccaro O. Dietary recommendations for prevention of atherosclerosis. Cardiovasc Res. 2022 Mar 25;118(5):1188-1204.
26. Zhang B, Xiong K, Cai J, Ma A. Fish Consumption and Coronary Heart Disease: A Meta-Analysis. Nutrients. 2020 Jul 29;12(8):2278.
27. Jayedi A, Zargar MS, Shab-Bidar S. Fish consumption and risk of myocardial infarction: a systematic review and dose-response meta-analysis suggests a regional difference. Nutr Res. 2019 Feb;62:1-12.
28. Casas R, Castro-Barquero S, Estruch R, Sacanella E. Nutrition and Cardiovascular Health. Int J Mol Sci. 2018 Dec 11;19(12):3988.
29. Borow KM, Nelson JR, Mason RP. Biologic plausibility, cellular effects, and molecular mechanisms of eicosapentaenoic acid (EPA) in atherosclerosis. Atherosclerosis. 2015 Sep;242(1):357-66.
30. Abdelhamid AS, Brown TJ, Brainard JS, et al. Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2018 Jul 18;7(7):CD003177.
31. Kapoor K, Alfaddagh A, Stone NJ, Blumenthal RS. Update on the omega-3 fatty acid trial landscape: A narrative review with implications for primary prevention. J Clin Lipidol. 2021 Jul-Aug;15(4):545-555.
32. Kaur G, Mason RP, Steg PG, Bhatt DL. Omega-3 fatty acids for cardiovascular event lowering. Eur J Prev Cardiol. 2024 Jun 3;31(8):1005-1014.
33. Aune D, Giovannucci E, Boffetta P, et al. Fruit and vegetable intake and the risk of cardiovascular disease, total cancer and all-cause mortality-a systematic review and dose-response meta-analysis of prospective studies. Int J Epidemiol. 2017 Jun 1;46(3):1029-1056.
34. Zhan J, Liu YJ, Cai LB, Xu FR, Xie T, He QQ. Fruit and vegetable consumption and risk of cardiovascular disease: A meta-analysis of prospective cohort studies. Crit Rev Food Sci Nutr. 2017 May 24;57(8):1650-1663.
35. Bozzetto L, Annuzzi G, Pacini G, et al. Polyphenol-rich diets improve glucose metabolism in people at high cardiometabolic risk: a controlled randomised intervention trial. Diabetologia. 2015 Jul;58(7):1551-60.
36. Livesey G, Livesey H. Coronary Heart Disease and Dietary Carbohydrate, Glycemic Index, and Glycemic Load: Dose-Response Meta-analyses of Prospective Cohort Studies. Mayo Clin Proc Innov Qual Outcomes. 2019 Feb 26;3(1):52-69.
37. Marshall S, Petocz P, Duve E, et al. The effect of replacing refined grains with whole grains on cardiovascular risk factors: a systematic review and meta-analysis of randomized controlled trials with GRADE clinical recommendation. J Acad Nutr Diet 2020;120:1859–1883.
38. Anderson JW, Smith BM, Washnock CS. Cardiovascular and renal benefits of dry bean and soybean intake. Am J Clin Nutr. 1999 Sep;70(3 Suppl):464S-474S.
39. Marventano S, Izquierdo Pulido M, Sánchez-González C, et al. Legume consumption and CVD risk: a systematic review and meta-analysis. Public Health Nutr. 2017 Feb;20(2):245-254.
40. Zhu Y, Bo Y, Liu Y. Dietary total fat, fatty acids intake, and risk of cardiovascular disease: a dose-response meta-analysis of cohort studies. Lipids Health Dis. 2019 Apr 6;18(1):91.
41. Li Y, Hruby A, Bernstein AM, Ley SH, et al. Saturated Fats Compared With Unsaturated Fats and Sources of Carbohydrates in Relation to Risk of Coronary Heart Disease: A Prospective Cohort Study. J Am Coll Cardiol. 2015 Oct 6;66(14):1538-1548.
42. Hooper L, Martin N, Jimoh OF, Kirk C, Foster E, Abdelhamid AS. Reduction in saturated fat intake for cardiovascular disease. Cochrane Database Syst Rev. 2020 May 19;5(5):CD011737.
43. Eichelmann F, Prada M, Sellem L, et al. Lipidome changes due to improved dietary fat quality inform cardiometabolic risk reduction and precision nutrition. Nat Med. 2024 Oct;30(10):2867-2877.
44. García-González A, Quintero-Flórez A, Ruiz-Méndez MV, Perona JS. Virgin Olive Oil Ranks First in a New Nutritional Quality Score Due to Its Compositional Profile. Nutrients. 2023 Apr 28;15(9):2127.
45. Mozaffarian D, Wu JHY. Flavonoids, dairy foods, and cardiovascular and metabolic health: a review of emerging biologic pathways. Circ Res 2018;122:369–384.
46. Guo J, Astrup A, Lovegrove JA, Gijsbers L, Givens DI, Soedamah-Muthu SS. Milk and dairy consumption and risk of cardiovascular diseases and all-cause mortality: dose-response meta-analysis of prospective cohort studies. Eur J Epidemiol. 2017 Apr;32(4):269-287.
47. Fernandez ML. Dietary cholesterol provided by eggs and plasma lipoproteins in healthy populations. Curr Opin Clin Nutr Metab Care. 2006 Jan;9(1):8-12.
48. Alexander DD, Miller PE, Vargas AJ, Weed DL, Cohen SS. Meta-analysis of Egg Consumption and Risk of Coronary Heart Disease and Stroke. J Am Coll Nutr. 2016 Nov-Dec;35(8):704-716.
49. Drouin-Chartier JP, Chen S, Li Y, Schwab AL, et al. Egg consumption and risk of cardiovascular disease: three large prospective US cohort studies, systematic review, and updated meta-analysis. BMJ. 2020 Mar 4;368:m513.
50. Godos J, Micek A, Brzostek T, et al. Egg consumption and cardiovascular risk: a dose-response meta-analysis of prospective cohort studies. Eur J Nutr. 2021 Jun;60(4):1833-1862.
51. Zhong VW, Van Horn L, Cornelis MC, et al. Associations of Dietary Cholesterol or Egg Consumption With Incident Cardiovascular Disease and Mortality. JAMA. 2019 Mar 19;321(11):1081-1095.
52. Zhuang P, Wu F, Mao L, Zhu F, Zhang Y, Chen X, Jiao J, Zhang Y. Egg and cholesterol consumption and mortality from cardiovascular and different causes in the United States: A population-based cohort study. PLoS Med. 2021 Feb 9;18(2):e1003508.
53. Zhao B, Gan L, Graubard BI, Männistö S, Albanes D, Huang J. Associations of Dietary Cholesterol, Serum Cholesterol, and Egg Consumption With Overall and Cause-Specific Mortality: Systematic Review and Updated Meta-Analysis. Circulation. 2022 May 17;145(20):1506-1520.
54. Robinson AT, Edwards DG, Farquhar WB. The Influence of Dietary Salt Beyond Blood Pressure. Curr Hypertens Rep. 2019 Apr 25;21(6):42.
55. Wang YJ, Yeh TL, Shih MC, Tu YK, Chien KL. Dietary Sodium Intake and Risk of Cardiovascular Disease: A Systematic Review and Dose-Response Meta-Analysis. Nutrients. 2020 Sep 25;12(10):2934.
56. Becerra-Tomás N, Paz-Graniel I, W C Kendall C, et al. Nut consumption and incidence of cardiovascular diseases and cardiovascular disease mortality: a meta-analysis of prospective cohort studies. Nutr Rev. 2019 Oct 1;77(10):691-709.
57. Chen GC, Zhang R, Martínez-González MA, Zhang ZL, Bonaccio M, van Dam RM, Qin LQ. Nut consumption in relation to all-cause and cause-specific mortality: a meta-analysis 18 prospective studies. Food Funct. 2017 Nov 15;8(11):3893-3905.
58. Lorenzon Dos Santos J, Quadros AS, Weschenfelder C, Garofallo SB, Marcadenti A. Oxidative Stress Biomarkers, Nut-Related Antioxidants, and Cardiovascular Disease. Nutrients. 2020 Mar 3;12(3):682.
59. Ding M, Bhupathiraju SN, Satija A, van Dam RM, Hu FB. Long-term coffee consumption and risk of cardiovascular disease: a systematic review and a dose-response meta-analysis of prospective cohort studies. Circulation. 2014 Feb 11;129(6):643-59.
60. Chung M, Zhao N, Wang D, et al. Dose-Response Relation between Tea Consumption and Risk of Cardiovascular Disease and All-Cause Mortality: A Systematic Review and Meta-Analysis of Population-Based Studies. Adv Nutr. 2020 Jul 1;11(4):790-814.
61. Yin J, Zhu Y, Malik V, et al. Intake of Sugar-Sweetened and Low-Calorie Sweetened Beverages and Risk of Cardiovascular Disease: A Meta-Analysis and Systematic Review. Adv Nutr. 2021 Feb 1;12(1):89-101.
62. Taskinen MR, Packard CJ, Bore´n J. Dietary fructose and the metabolic syndrome. Nutrients 2019;11:1987.
63. Georgescu OS, Martin L, Târtea GC, et al. Alcohol Consumption and Cardiovascular Disease: A Narrative Review of Evolving Perspectives and Long-Term Implications. Life (Basel). 2024 Sep 9;14(9):1134.
64. Manthey J, Shield K, Rehm J. Alcohol and health. Lancet. 2022 Nov 19;400(10365):1764-1765.
65. Zhao J, Stockwell T, Naimi T, Churchill S, Clay J, Sherk A. Association Between Daily Alcohol Intake and Risk of All-Cause Mortality: A Systematic Review and Meta-analyses. JAMA Netw Open. 2023 Mar 1;6(3):e236185.
66. Jiesisibieke ZL, Schooling CM. Impact of Alcohol Consumption on Lifespan: a Mendelian randomization study in Europeans. Sci Rep. 2024 Oct 25;14(1):25321.
67. Anderson BO, Berdzuli N, Ilbawi A, et al. Health and cancer risks associated with low levels of alcohol consumption. Lancet Public Health. 2023 Jan;8(1):e6-e7.
68. Wood AM, Kaptoge S, Butterworth AS, et al. Risk thresholds for alcohol consumption: combined analysis of individual-participant data for 599 912 current drinkers in 83 prospective studies. Lancet. 2018 Apr 14;391(10129):1513-1523.
69. Ding C, O’Neill D, Bell S, Stamatakis E, Britton A. Association of alcohol consumption with morbidity and mortality in patients with cardiovascular disease: original data and meta-analysis of 48,423 men and women. BMC Med. 2021 Jul 27;19(1):167.